小檗碱激活巨噬细胞自噬并改善动脉粥样硬化斑块脆弱性
2020-05-30杨黎星黄雨晴高洪婷
刘 琴,杨黎星,石 婧,黄雨晴,高洪婷,鞠 瑞,郭 磊
(中国医学科学院基础医学研究所 北京协和医学院基础学院 药理系,北京 100005)
动脉粥样硬化(atherosclerosis,AS)是多种心血管疾病的发病基础,严重影响人们的群体健康和生活质量。许多研究表明血糖及血脂代谢异常均可以引起动脉粥样硬化,动脉粥样硬化斑块是其标志性病变表现[1]。稳定的动脉粥样硬化病变进展缓慢,而易损斑块突然破裂则常常引起血栓的形成,从而导致急性冠状动脉综合征(acute coronary syndrome,ACS),是导致世界上致死率及致残率的主要病因[2]。斑块破裂的脆弱性是动脉粥样硬化的关键风险过程,降低斑块易损性是一种有效的心血管风险预防策略。动脉粥样硬化是一种慢性炎性反应血管疾病,血管炎性反应加剧了动脉粥样硬化斑块的恶化,使脆弱的动脉粥样硬化斑块易于破裂[3-4]。巨噬细胞移动抑制因子(macrophage mgration inhibitory factor,MIF)是一种重要的参与免疫和炎性反应的因子。MIF基因沉默可抑制动脉粥样硬化,增加斑块稳定性[5]。研究证明,NLRP3炎性小体在慢性炎性反应和胆固醇代谢中起着关键作用[6]。活化的NLRP3炎性体能够加剧巨噬细胞脂质沉积和动脉粥样硬化[7]。最近的研究表明,炎性体由自噬调节[8],而自噬与动脉粥样硬化斑块的脆弱性紧密相关[9],研究发现自噬的上调可以改善动脉粥样硬化的进展并降低动脉粥样硬化斑块的脆弱性[10]。
小檗碱(berberine,BBR)是从中药黄连中提取的主要有效成分,属于异喹啉类生物碱,又名黄连素,具有多方面的药理作用。现代药理研究发现,小檗碱可以通过抑制炎性反应防治动脉粥样硬化[11]。然而其对高糖及高脂引起的动脉粥样硬化易损斑块的作用及相关机制尚不明确。本研究旨在通过动物实验考察小檗碱对高糖及高脂引起的动脉粥样硬化易损斑块的作用,并以佛波酯诱导分化的Thp1细胞为研究对象,探讨小檗碱对MIF分泌、NLRP3活化以及自噬过程的影响,以期发现小檗碱稳定动脉粥样硬化斑块的可能机制。
1 材料与方法
1.1 材料
1.1.1 实验动物:健康ApoE-/-(apolipopotein E-/-),载脂蛋白E基因敲除小鼠(8周龄,SPF级,雄性,体质量22~25 g),购买自斯贝福(北京)生物技术有限公司,自由摄食摄水,喂养环境温度为18~25 ℃,湿度为50%~60%,明暗交替周期为12 h。实验前适应性饲养1周。
1.1.2 细胞系:人单核细胞系Thp1(中国医学科学院基础医学研究所细胞资源中心)。
1.1.3 药品及试剂:小檗碱(BBR)、 胆固醇(cholesterol,CHOL)、链脲佐菌素(streptozotocin,STZ)(MCE公司);脂多糖(lipopolysaccharide,LPS)、DMSO(Sigma-Aldrich公司);阿托伐他汀(atorvastatin)(辉瑞制药公司);恩格列净(empaglifozin)(Booehringer Ingelheim Pharma GmbH & Co.KG);RPMI-1640培养基(中国医学科学院基础医学研究所细胞资源中心);胎牛血清(Gibco公司);CCK8试剂盒(上海翊圣生物科技有限公司);人及小鼠IL-1β ELISA试剂盒[依科赛生物科技(太仓)有限公司];Western blot一抗ASC(Immunoway公司);AMPK、p-AMPK、mTOR、p-mTOR(CST公司);MIF、NLRP3、 p-SP1、 LC3Ⅱ/Ⅰ(Abcam公司);β-actin、caspase1、SP1、SQSTM1/P62、二抗(Proteintech公司);免疫组织学实验一抗α-SMA、MoMa-2、MIF、NLRP3、天狼猩红染色试剂盒 (Abcam公司);通用型免疫组化检测试剂盒 (Proteintech公司); 饱和油红O染色液、HE染色试剂盒(北京索莱宝科技有限公司)。
1.2 方法
1.2.1 动物造模、分组及给药:实验动物的分组和给药方案(图1),小鼠适应性饲养1周后,随机分为对照组(control)、高糖组(hyperglycemia)及高脂组(hyperlipidemia),其中高糖组小鼠腹腔注射链脲佐菌素(STZ)[剂量45 mg/(kg·d)] 5 d,对照组与高脂组腹腔注射柠檬酸盐缓冲液(sodium carboxylmethyl cellulose, CMC-Na);高脂组从第1周开始采用高脂饲料(high fat diet, HFD)(配方:15%脂肪,1.25%胆固醇,0.5%胆酸盐)喂养,直至实验结束取材;造模2周后 (第4周)从高糖组随机取10只小鼠组成药物预防组(pre-BBR50),开始接受小檗碱治疗[灌胃给药,50 mg/(kg·d)]; 造模4周后(第7周),高糖组随机分成高糖模型组[model(STZ)]、BBR25、50、100(STZ)组、阿托伐他汀组 [atorvastatin(STZ)]

图1 动物实验流程图Fig 1 Flowchart of animal experiments
及恩格列净组[empagliflozin(STZ)],高脂组随机分成高脂模型组[model(HFD)]及BBR50(HFD)组,各组分别接受图1中所示的溶剂或药物治疗;第13周结束时安乐死实验取材。
1.2.2 组织制备,免疫组织学分析:第13周,各组小鼠进行眼眶取血,分离血清,ELISA检测血清中IL-1β含量。通过心室灌注福尔马林进行组织固定,分离出从升主动脉至髂动脉的主动脉全长,保留主动脉弓3大分支,剥去血管外周脂肪及肌肉组织;主动脉全长,进行油红O染色测量脂质斑块覆盖的表面积。取主动脉根部组织,进行包埋切片(冰冻切片8 μm,石蜡切片5 μm),分别进行组织学和免疫组织化学染色(HE、油红O、天狼猩红、MoMa-2、α-SMA、MIF、NLRP3)。通过自动图像分析系统(Image-Pro Plus 6.0)对这些指标的表达进行定量,阳性染色(棕色)面积与动脉粥样硬化斑块面积的比值代表了它们的相对含量。 斑块的脆弱性指数计算公式为: (油红O% +MoMa-2%)/(α-SMA%+胶原%)[12-13]。剩余动物的组织用PBS灌注并在液氮中速冻,并保存在-80 ℃下用于随后的蛋白质提取。
1.2.3 细胞培养及处理:用RPMI-1640培养基进行Thp1细胞培养及传代。以5×106个/孔细胞接种于6孔板中,用终浓度为50 ng/mL的佛波酯(phorbol 12-mgristate 13-acetate,PMA)处理Thp1细胞24 h诱导其分化为巨噬细胞,弃去上清,用PBS洗2次,换新培养基;依次作如下分组:1)对照组(control);2)模型(LPS+CHOL)组(10 μg/mL LPS及0.5 μmol/L的胆固醇晶体刺激);3)BBR5、10、20 μmol/L给药组;处理24 h后收样检测。
1.2.4 CCK8法检测活力:对照组、模型组、BBR5、10、20 μmol/L给药组细胞,以1×105个细胞/10 μL的剂量加入CCK8试剂培养4 h,待液体呈橙色时,用酶标仪测定450 nm处的吸光度值(A),进行统计分析。
1.2.5 ELISA检测细胞上清液及小鼠血清中IL-1β含量:按试剂盒说明书进行操作。
1.2.6 Western blot:取主动脉组织及收集的细胞,用预冷的PBS洗2次,加入裂解液,4 ℃静置30 min,15 000×g离心10 min,取上清,进行BCA蛋白定量。总蛋白经SDS-PAGE分离后,转移到PVDF(0.45 μm)膜上。用5%脱脂奶粉封闭60 min,加入稀释后的一抗4 ℃孵育过夜。取出PVDF膜,TBST洗3次,每次7 min。加入二抗,室温摇床孵育1 h。取出PVDF膜并用TBST再洗3次。将PVDF膜用发光试剂ECL显色,Tanon化学发光成像仪检测。
1.3 统计学分析

2 结果
2.1 一般观察性指标的比较
2.1.1 小鼠每周体质量的变化:实验开始时,各组之间体质量无明显差异;对照组和高脂组在喂养后每周的体质量逐渐上升,并在第7周开始给与药物治疗后逐渐趋于稳定;高糖各组在腹腔注射造模后体质量略有下降,之后逐步回升并趋于稳定;对照组与高脂组小鼠体质量显著高于高糖各组(P<0.001),高糖各组之间体质量差异无统计学意义(图2)。
2.1.2 小鼠每周血糖变化:对照组与高脂组血糖正常(小于10 mmol/L),高糖组在注射STZ后2周血糖出现明显升高,并持续高血糖(大于20 mmol/L);给与药物治疗后,除药物预防组及降糖药恩格列净组从第11周开始血糖得到改善(血糖下降1~2 mmol/L)外,其余各组对血糖无明显改善(图3)。
2.2 小鼠主动脉粥样硬化病变情况
与对照组相比,高糖及高脂组动脉粥样硬化病变情况均有较显著的恶化(P<0.01),斑块增大,油红O染色面积增大,脂质含量增多;给与药物治疗后,病变情况有所改善,小檗碱组斑块面积及脂质含量均显著降低(P<0.05),其中药物预防组效果更好(P<0.01);阳性药阿托伐他汀及恩格列净组脂质含量显著降低(P<0.01),斑块面积有所下降,但无统计学意义(图4)。
2.3 斑块脆弱性指数
根据病理切片染色及免疫组织学检测结果,应用计算公式:(油红O% +MoMa-2%)/(α-SMA%+胶原%)[12-13]求得斑块脆弱性指数。与STZ模型组和高脂模型组相比,不同剂量的小檗碱治疗组,斑块脂质及巨噬细胞含量显著降低(P<0.05),胶原及平滑肌含量显著升高(P<0.05),斑块脆弱性指数显著下降(P<0.05),斑块稳定性增加,其中药物预防组效果最好(图5)。

*P<0.05, **P<0.01, ***P<0.001 compared with model(STZ) group图2 小鼠体质量变化曲线Fig 2 Change curve of mouse body
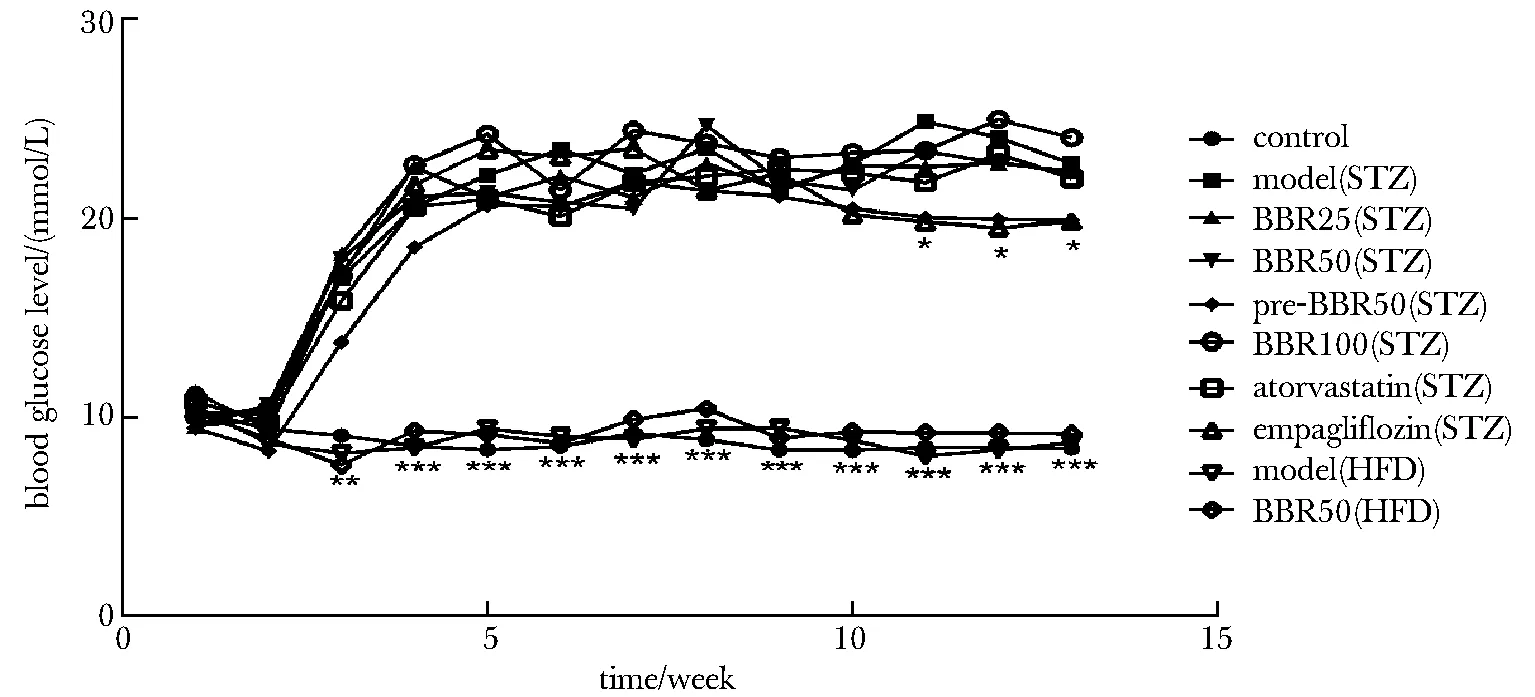
*P<0.05, **P<0.01, ***P<0.001 compared with model(STZ) group图3 小鼠血糖变化曲线Fig 3 Mice blood glucose change curve
2.4 BBR对血清IL-1β、主动脉及斑块部位NLRP3、自噬、MIF的影响
与模型组[model(STZ)、model(HFD)]相比,小檗碱组血清IL-1β水平显著降低(P<0.01) (图6C);主动脉及斑块部位的NLRP3(以及相关因子ASC、caspase-1)表达显著下调(P<0.05) (图6B、6D、6E);自噬相关蛋白LC3Ⅱ/LC3Ⅰ比率显著升高(P<0.05),SQSTM1/P62显著下调(P<0.05) (图6F);MIF表达显著下降(P<0.01) (图6A、6G);同时Thp1细胞经过实验处理后的Western blot结果也显示,与模型组(LPS+CHOL)相比,小檗碱组MIF显著下调(P<0.05),SP1磷酸化过程受到抑制(图6H)。
2.5 BBR通过AMPK/mTOR通路激活自噬,进而下调炎性因子NLRP3及IL-1β
与模型组(LPS+CHOL)相比,小檗碱组炎性体NLRP3及炎性因子IL-1β显著降低(P<0.05);自噬相关蛋白LC3Ⅱ/LC3Ⅰ比率显著增加(P<0.05),SQSTM1/P62显著下调(P<0.05);小檗碱明显诱导了AMPK的活化,同时降低了p-mTOR/ mTOR的比率(图7)。

Representative images of aortic root section staining: A.HE staining; B.Oil Red O staining; C.quantitative result of plaque area (%) (plaque area/aortic cross-sectional area); D.Oil Red O (lipid) (%) (red stained area/aorta total surface area) quantitative results;*P<0.05,**P<0.01,***P<0.001 compared with model(STZ) group;#P<0.05,##P<0.01 compared with model(HFD) group

3 讨论
本研究表明小檗碱可明显下调STZ诱导的高血糖及高脂饮食诱导的高血脂ApoE-/-小鼠炎性因子IL-1β的表达,抑制炎性体NLRP3的活化,下调斑块脂质和MoMa-2(巨噬细胞)的含量、上调胶原(天狼猩红染色)和α-SMA(平滑肌细胞)的含量,改善斑块脆弱性,稳定斑块,抑制动脉粥样硬化斑块的进展。
自噬是细胞的一种基本代谢过程,研究表明自噬在AS中有保护作用[14-15]。巨噬细胞作为炎性细胞,在动脉粥样硬化过程中起着关键作用,而巨噬细胞自噬则起保护作用,如抑制炎性反应、稳定斑块等。巨噬细胞自噬受损可能导致包括AS在内的许多疾病[16]。Razani等[17]研究发现,自噬功能受损会引起炎性体活化,进一步促进AS的发展。本研究首先检测到小檗碱通过自噬依赖性机制减轻了炎性反应(NLRP3及IL-1β下调),这也通过增加LC3Ⅱ/LC3Ⅰ比率和降低SQSTM1/p62来证明(在自噬相关蛋白中,LC3-Ⅰ向LC3-Ⅱ的转化被广泛用作自噬激活的标志物;SQSTM1/p62是一个自噬降解底物,其积累表明自噬不足)。有研究表明,有益的自噬过程可减少ox-LDL诱导的巨噬细胞炎性反应[18]。本研究证明了小檗碱可诱导有益的自噬过程,这可能部分抑制了LPS与胆固醇晶体共同诱导的炎性反应。此外,本研究探索了小檗碱诱导自噬的潜在分子机制。 AMPK/mTOR是细胞自噬的重要调节剂,小檗碱在心血管疾病中的保护作用需要AMPK[19]。本研究发现小檗碱明显诱导了AMPK的活化,降低了p-mTOR/ mTOR的比率,证明了AMPK/mTOR信号通路可能参与了小檗碱诱导的巨噬细胞自噬。

Representative images of aortic root section staining: A.Oil Red O staining, B.picrosirius Red staining; representative images of aortic root section immunohistochemistry: C.MoMa-2; D.α-SMA; E.plaque quantitative results of lipid%(Oil Red O stained area/aortic cross-sectional area); F.quantified result of plaque collagen%(picrosirus Red stained area (dark red)/aortic cross-sectional area); G.plaque quantitative results of MoMa-2% (macrophage) (positive staining area (brown)/aortic cross-sectional area); H.plaque α-SMA% (smooth muscle cells) (positive staining area (brown)/aorta cross-sectional area); I.statistical results of the vulnerability index of plaques;*P<0.05,**P<0.01,***P<0.001 compared with model(STZ) group;#P<0.05,##P<0.01,###P<0.001 compared with model(HFD) group

Representative images of aortic root section immunohistochemistry: A.MIF,B.NLRP3; C.serum IL-1β ELISA test results; D.plaque NLRP3%(positive staining area (brown)/aortic cross-sectional area) quantitative results; E.Western blot results of MIF, NLRP3, ASC, and caspase-1 in aortic homogenate; F.Western blot results of LC3Ⅱ/LC3Ⅰ and SQSTM1/P62 in aortic homogenate; G.plaque quantitative results of MIF% (positive staining area (brown)/aortic cross-sectional area); H.Western blot results of Thp1 cell experiment MIF and p-SP1/SP1;*P<0.05,**P<0.01,***P<0.001 compared with model(STZ) group;#P<0.05,##P<0.01,###P<0.001 compared with model(HFD) group; A,B:×5,scale bar=50 μm


Thp1 cell experiment: A.CCK-8 viability test results and supernatant IL-1β ELISA results; B.MIF, NLRP3, ASC, caspase-1 Western blot results; C.autophagy related proteins LC3Ⅱ/LC3Ⅰ and SQSTM1/P62 Western blot results; D.Western blot results of p-AMPK/AMPK and p-mTOR/mTOR;*P<0.05,**P<0.01,***P<0.001 compared with model(LPS + CHOL) group
图7 BBR通过AMPK/mTOR通路激活自噬而下调NLRP3及IL-1β
MIF是一个多效细胞因子,它既参与动脉粥样硬化[20]也参与糖尿病[21]的疾病进程。本研究发现与非糖尿病正常饮食的ApoE-/-小鼠相比,高脂饮食及注射STZ诱导高血糖的小鼠,主动脉组织及动脉粥样硬化斑块部位的MIF显著升高,给予小檗碱治疗后,MIF明显下调;细胞实验也证实小檗碱可明显下调MIF,抑制SP1磷酸化过程(MIF基因表达的正向调节剂[22]),可见小檗碱可通过抑制MIF启动因子SP1磷酸化而下调MIF的表达,从而改善动脉粥样硬化斑块的脆弱性。
本研究结果阐明了小檗碱对高糖及高脂引起的动脉粥样硬化易损斑块的保护作用,改善其脆弱性,稳定斑块,同时初步探索了潜在的分子机制,其中自噬可能起重要的保护作用。AMPK/mTOR信号通路可能有助于调节小檗碱诱导的自噬。自噬进一步抑制炎性体NLRP3及炎性因子IL-1β的表达,改善炎性反应。另外,小檗碱还可通过抑制MIF的表达而发挥保护作用。
