人重组腺病毒rAd-IL-23R的构建与功能鉴定
2020-05-30苑晓梅
苑晓梅,刘 力
(中国医学科学院基础医学研究所 北京协和医学院基础学院 病原生物学系,北京 100005)
白介素23(interleukin 23,IL-23)配体属于IL-12家族,是由p19和p40亚基组成的异源二聚体,二者分别被IL-23受体(IL-23 receptor,IL-23R)和IL-12Rβ1识别[1]。活化的巨噬细胞和树突细胞分泌IL-23配体后,可激活记忆T细胞产生IL-23R[2],通过稳定Th17辅助性T细胞的分化与扩增来促进IL-17细胞因子表达,也可以通过激活γδT细胞和固有淋巴样细胞(innate lymphoid cell, ILC)促进IL-17分泌[3]。IL-23可促进肿瘤发展进程[4]。而本实验室前期研究发现,在人子宫颈癌(HeLa)细胞系中瞬时转染IL-23R可降低IL-23配体的表达水平,并诱导凋亡增加[5]。
但是,瞬时转染质粒的效率相对较低,进一步深入研究具有局限性。腺病毒系统感染效率较高,宿主适应范围广,外源DNA片段容纳量较大,易于提高病毒滴度、浓缩和储存,安全性高[6]。因此,本研究构建了表达白介素23受体的人重组腺病毒(human recombinant adenovirus expressing interleukin 23 receptor,rAd-IL-23R),并探究其对HeLa细胞增殖及凋亡的影响。
1 材料与方法
1.1 材料
1.1.1 细胞系:人子宫颈癌(HeLa)细胞系、人胚肾细胞系HEK-293A(中国医学科学院基础医学研究所细胞资源中心)。
1.1.2 主要试剂:BJ5183感受态细胞(北京博迈德生物技术公司)和DH5α感受态细胞(北京天根生物科技公司);SalⅠ、XhoⅠ限制性内切酶、分子克隆试剂盒(TaKaRa公司);PmeⅠ和PacⅠ限制性内切酶(NEB公司);质粒小提试剂盒(Aidlab公司);琼脂糖凝胶回收试剂盒和ECL化学发光液(北京威格拉斯生物技术公司);DMEM-高糖培养基(Gibco公司);小牛血清(NCS);BCA蛋白定量试剂盒(Thermo Fisher Scientificals公司);anti-β-actin一抗,anti-caspase 3一抗(Proteintech公司);anti-cleaved-caspase 3一抗(Sigma-Aldrich公司);anti-IL-23R(Abcam公司);HRP标记山羊抗兔二抗(北京中杉金桥生物技术有限公司);CCK-8试剂(MCE公司);凋亡检测试剂盒(北京四正柏生物科技公司)。
1.2 方法
1.2.1 构建表达人IL-23R的重组腺病毒质粒:以SalⅠ和XhoⅠ为限制性酶切位点,将IL-23R核酸序列整合入pShuttle-CMV载体的多克隆位点,构建pShuttle-CMV-IL-23R穿梭质粒。
pShuttle-CMV-IL-23R穿梭质粒经PmeⅠ线性化后转化进入BJ5183感受态细胞,与骨架载体pAdEasy-1进行同源重组(图1)。重组子经过卡那霉素筛选,挑取10~20个单克隆扩增并提取质粒,随后分别通过PacⅠ及SalⅠ/XhoⅠ 酶切进行初步鉴定。
选取鉴定正确的pAd-IL-23R质粒于DH5α感受态细胞中进行转化扩增,随后提取质粒,并进行PacⅠ及SalⅠ/XhoⅠ酶切鉴定。
1.2.2 表达人IL-23R的重组腺病毒的包装与扩增:pAd-IL-23R经PacⅠ线性化回收后,转染HEK-293A细胞,1周后收取细胞及培养基,反复冻融3次,离心收集上清rAd-IL-23R病毒液。采用rAd-IL-23R病毒液继续感染HEK-293A细胞,约3 d收取细胞及培养基,继续反复冻融3次,离心收集上清rAd-IL-23R病毒液,此时rAd-IL-23R病毒滴度有所提升,重复此操作,直至出现明显细胞病变(cytopathic effect,CPE),表现为细胞间隙增大,细胞变大变圆、脱落,呈葡萄串状等异常生长变化。rAd-GFP病毒液采用同样方法提升病毒滴度。
1.2.3 病毒滴度测定:采用TCID50法测定病毒滴度。HEK-293A细胞接种于96孔板,rAd-IL-23R病毒液进行10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8梯度稀释后感染293A细胞,每个梯度设置10个复孔,剩余16孔做为阴性对照;rAd-GFP病毒液进行同样操作。定期在显微镜下观察并补充培养基,7~10 d待不再出现新的CPE时,计数每个病毒稀释液梯度出现CPE的孔数,采用KARBER统计法计算TCID50滴度T=1+d(S-0.5) /100 μL。d=lg稀释度,本实验稀释度为10,故d=1;S=阳性比率之和。

图1 pShuttle-CMV-IL-23R和pAdEasy-1重组示意图Fig 1 Recombinant diagram of pShuttle-CMV-IL-23R and pAdEasy-1
1.2.4 细胞培养与病毒感染:在37 ℃ 5% CO2的潮湿环境中,采用10%小牛血清加DMEM培养HeLa细胞和HEK-293A细胞。将细胞接种于12孔板或96孔板,24 h后更换无血清培养基,并加入病毒孵育4 h,随后补充血清至完全培养基,继续培养。
1.2.5 Western blot检测细胞中蛋白表达水平:收集病毒感染24 h后的细胞,加细胞裂解液在冰上裂解并提取细胞总蛋白质,BCA法测定蛋白液浓度,制备样品依次进行SDS-PAGE,转膜,在含5%脱脂奶粉的TBST溶液中37 ℃封闭1 h,在4 ℃条件下与一抗杂交过夜,室温二抗杂交1 h,最终加入ECL发光液检测细胞中相应蛋白质的表达水平。
1.2.6 细胞增殖实验:等量HeLa细胞接种于96孔板,次日接种病毒,24 h后加入CCK-8试剂37 ℃孵育2 h,在450 nm下测量吸光度值。使用计数后的HeLa细胞,梯度稀释后进行细胞增殖实验以绘制标准曲线并计算细胞增殖数目,每组均设置3个重复孔。
1.2.7 细胞凋亡实验:感染病毒24 h后,收集2×105~5×105/mL HeLa细胞,PBS轻柔洗涤,在1×结合缓冲液中用annexin Ⅴ-FITC室温避光染色10 min,随后加入 PI染色,采用流式细胞仪在1 h内进行检测。
1.3 统计学分析
2 结果
2.1 pAd-IL-23R质粒酶切产物的鉴定
2个pAd-IL-23R质粒1、2及其酶切产物经0.8%琼脂糖凝胶电泳后,第3、4泳道的PacⅠ单酶切产物大小分别为~30 kb和3.0 kb,第5、6泳道的SalⅠ/XhoⅠ双酶切产物大小包括1.89 kb,与预测相符,说明pAd-IL-23R质粒构建成功(图2)。
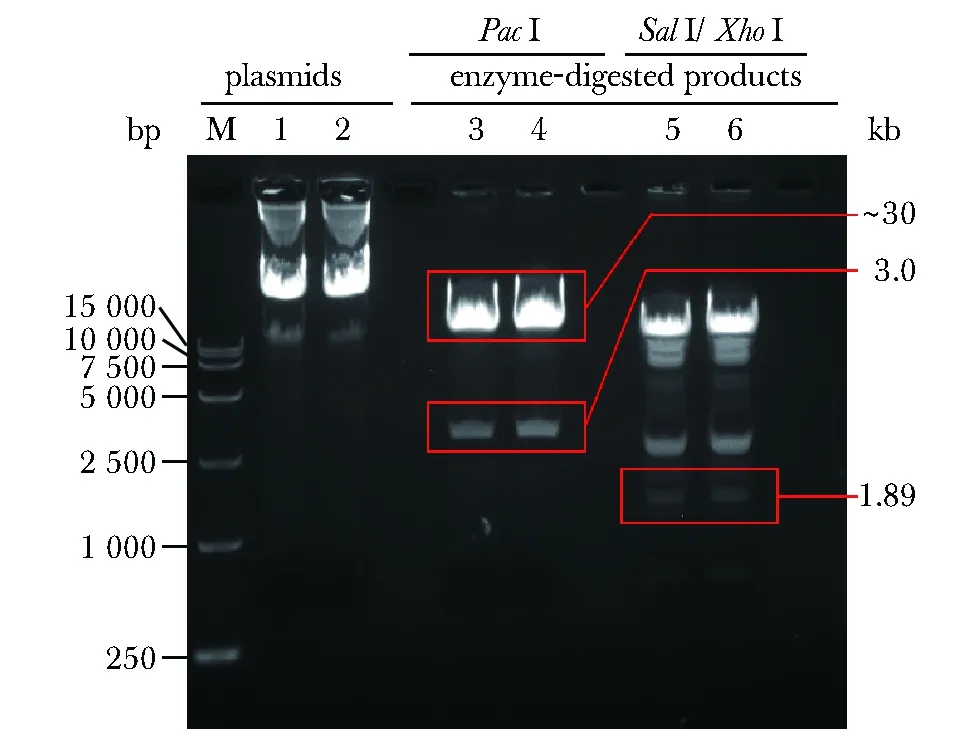
M.DNA marker (DL 15 000); 1,2.showed the sizes of pAd-IL-23R plasmids; 3,4.showed the sizes of PacⅠ enzyme-digested products of pAd-IL-23R plasmids; 5,6.showed the sizes of SalⅠ/XhoⅠ enzyme-digested products of pAd-IL-23R plasmids图2 pAd-IL-23R质粒及其酶切产物琼脂糖凝胶电泳Fig 2 Agarose gel electrophoresis of pAd-IL-23R plasmids and enzyme-digested products
2.2 rAd-IL-23R滴度测定及其在HEK-293A细胞中的表达
HEK-293A细胞感染rAd-IL-23R后出现CPE,细胞间隙增大,细胞变大变圆,呈葡萄串状(图3A),测定rAd-IL-23R和rAd-GFP的病毒滴度分别为106.5TCID50/mL和107.5TCID50/mL。随着rAd-IL-23R感染复数(multiplicity of infection,MOI)的增加,HEK-293A细胞中IL-23R的表达量也随之增高(图3B)。
2.3 rAd-IL-23R对HeLa细胞增殖的影响
以2 MOI的rAd-GFP做为阴性对照组,rAd-IL-23R对HeLa细胞的增殖呈显著的剂量依赖性抑制作用(图4)。
2.4 rAd-IL-23R对HeLa细胞凋亡的影响
随着rAd-IL-23R MOI的增高,HeLa细胞的凋亡率明显增加(P<0.05)(图5A,5B);且随着IL-23R蛋白表达量的增加,caspase 3被激活,表现为caspase 3前体的表达量降低,而被切割后的cleaved-caspase 3表达水平显著增高,具有明显的剂量效应(图5C)。
3 讨论
IL-23与IL-23R结合后可激活Janus激酶(Janus kinases,JAK2),进而诱导信号传导及转录激活蛋白(signal transducers and activators of transcrip-tion factor,STAT)、有丝分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和磷脂酰肌醇3-激酶(phosphatidylinositol kinase 3-kinase,PI3Ks)信号的下游效应分子[7],同时还可通过NF-κB信号通路的激活发挥效应[8]。IL-23/IL-23R对启动、维持和加速IL-23/IL-17炎性反应信号传导通路至关重要,参与维持慢性炎性反应进展及肿瘤形成[9]。Blaine等[10]发现IL-23R敲除小鼠中Th17的表型减少,从而加速口腔癌的癌前病变进程。本实验室前期研究发现IL-23R在宫颈癌细胞中同样可发挥抑癌样基因作用,促进细胞凋亡[5]。癌前病变时DNA损伤引起的细胞凋亡有助于清除有害细胞,阻止肿瘤发生;而凋亡功能紊乱可导致肿瘤发生,与细胞增殖失控、 肿瘤进展和治疗耐药相关,因此,恢复肿瘤细胞对凋亡的敏感性可能有助于疾病治疗[11]。

A.morphological changes of 293A cells that were mock-infected or infected with rAd-IL-23R(×10); B.Western blot analysis on the expression of the IL-23R treated with different MOI of rAd-IL-23R; β-actin was included as a internal control
图3 rAd-IL-23R对293A细胞形态及蛋白表达的影响
Fig 3 Effect of rAd-IL-23R on phenotype and protein expression of 293A cells

*P<0.05, **P<0.01 compared with rAd-GFP group图4 rAd-IL-23R对HeLa细胞增殖的影响Fig 4 Effect of rAd-IL-23R on proliferation of
实验室前期应用的质粒瞬时转染技术主要适用于体外实验,对于后续的体内实验仍具有一定局限性。腺病毒载体是一种在体内外传递表达基因的有效方式,可以在分裂、休眠及终末分化任一时期的细胞中稳定高表达,此外,腺病毒不整合到宿主基因组,且免疫原性相对较低[6]。综合治疗方式及临床表现,腺病毒载体药物在基因治疗方面具有明显的优势,是目前临床实验中最常见的治疗载体之一[12]。

A, B.flow cytometric analysis on apoptosis of HeLa cells;*P<0.01 compared with blank control group; C.Western blot analysis on the expression of caspase 3, cleaved-caspase 3 and IL-23R; expressions of β-actin were served as internal controls; data was the one representive of at least two independent experiments with similar results
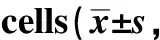
本研究采用AdEasyTM系统,将携有IL-23R的穿梭载体与腺病毒骨架载体进行同源重组,成功构建了人重组腺病毒rAd-IL-23R,该病毒可感染人子宫颈癌(HeLa)细胞系,且呈剂量依赖性抑制细胞增殖并诱导凋亡发生,这为进一步深入探索IL-23R在宫颈癌细胞中的生物学功能提供了研究基础。
