Hsp90靶向抑制多肽P7与多西他赛联用对肺腺癌细胞系A549的协同抗肿瘤作用
2020-05-30吴友明刘娜斯曹明月刘雁勇
吴友明,刘娜斯,曹明月,黄 薇,刘雁勇,杨 楠
(中国医学科学院基础医学研究所 北京协和医学院基础学院 药理学系,北京 100005)
根据《2018年全球癌症统计报告:全球185个国家36种癌症发病率和死亡率的估计》,肺癌的全球发病率及死亡人数均高居榜首[1]。肺癌发病患者中约80%是非小细胞肺癌(non-small cell lung cancer, NSCLC),5年生存率从IA期患者的67%降至IIIA期患者的23%[2]。因此,对非小细胞肺癌的治疗是一个亟待解决的难题。多西他赛(docetaxel,DTX)是紫杉醇的半合成类似物,被广泛用于治疗NSCLC,然而化学抗药性是限制其应用的主要障碍[3-4]。
热休克蛋白90(heat shock protein 90, Hsp90)在帮助致癌蛋白(包括Akt,EGFR,Met,Her-2等)的成熟和稳定中起着重要作用[5],而这些蛋白在肿瘤细胞的凋亡,增殖中发挥着重要作用。Hsp90抑制剂与抗肿瘤药物联用时,能够显著提高治疗效果[6-7]。在前期研究中,本研究室通过噬菌体展示技术发现了具有完全自主知识产权的七肽P7(序列 LPLTPLP),其作为一种小分子多肽能够特异性识别细胞表面Hsp90(KD=6.53×10-5mol/L),并诱导其降解,为一种兼具靶向和抑制的双功能多肽[8]。本研究探讨了P7与DTX联合应用诱导细胞凋亡的相关机制,为增强DTX疗效、降低毒性提供了新的研究思路。
1 材料与方法
1.1 试剂与材料
人肺腺癌细胞系(human lung adenocarcinoma cell line)A549(中国医学科学院基础医学研究所细胞资源中心);CCK-8细胞增殖-毒性试剂盒、凋亡检测试剂盒(上海东仁化学科技有限公司);多西他赛(DTX)(北京中硕医药科技发展有限公司);多肽P7(上海吉尔生化公司合成);所有单克隆抗体(Cell Signal Technology公司)。
1.2 方法
1.2.1 细胞培养:人肺腺癌细胞系A549在含有10%胎牛血清和适量抗生素的RPMI 1640培养基中培养。培养条件为37 ℃、5% CO2。
1.2.2 CCK-8法检测细胞活性:将A549细胞接种至96孔板中(3×103个细胞/孔),过夜后加药处理,分别是:1)DTX组:0~10 μmol/L共设8个浓度梯度;2)P7组:0~10 mmol/L共设8个浓度梯度;3)0~10 μmol/L DTX(7个浓度梯度)联用1、10和50 μmol/L P7。培养48 h后,加入10 μL CCK-8试剂,37 ℃孵育1~2 h,采用TECAN Infinite F50 酶标仪在波长450 nm处检测吸光度值。采用GraphPad软件绘制细胞生存曲线并计算IC50。
1.2.3 蛋白免疫印迹法检测:使用蛋白免疫印迹法检测DTX和P7单用或联用对相关蛋白表达水平的影响。取对数增殖期的A549细胞接种于10 cm细胞培养皿,每皿1×106个细胞,培养过夜后进行加药处理。分组如下:空白对照组;P7(10 μmol/L)单药组;DTX(1 nmol/L)单药组;P7(10 μmol/L)与DTX(1 nmol/L)联合用药组。然后继续培养48 h,提取细胞蛋白及蛋白免疫印迹法见参考文献[9]。
1.2.4 流式细胞仪凋亡检测:采用流式细胞计量术检测多肽DTX与P7单用或联合处理后A549细胞的凋亡率。按照上述实验方法培养并分组处理细胞,流式细胞计量术步骤见参考文献[10]。样品准备完成后,使用BD AccuriTMC6流式细胞仪上机检测分析。
1.3 统计学分析
2 结果
2.1 多肽P7与化疗药物DTX联合对A549细胞存活的影响
结果表明,DTX能够抑制A549细胞的存活,半数抑制浓度(IC50)为(0.45±0.22)nmol/L(图1A)。为了探讨DTX与Hsp90双功能靶向抑制多肽P7联用的可能性,首先检测了P7对A549细胞的毒性,其IC50为(75.6 ± 13.7)μmol/L(图1B)。据此,本研究将不同浓度梯度的DTX分别联合1、10和50 μmol/L P7共处理,结果表明联合用药后DTX的IC50明显降低(图1C)。
此外,本研究还计算了联合作用指数(combined index, CI),判断DTX与P7的协同性,方法见参考文献[11]。计算公式:CI=DA/ICXA +DB/ICXB(A、B代表两种不同药物,ICXA和ICXB是两种药物单独使用使生长抑制率达X时的药物浓度,DA和DB是两药联用使生长抑制率达X时两种药物的浓度)。当CI>1、CI=1或CI<1时,两药分别为拮抗、叠加或协同作用。分析抑制率Fa-合用指数CI曲线显示,当DTX+1 μmol/L P7 effect(Fa)大于0.13时、DTX+10 μmol/L P7 effect(Fa)大于0.53时,CI都小于1,这进一步表明DTX和P7有协同作用(图 1D)。
2.2 DTX与P7联合用药促进细胞凋亡
A549细胞经DTX 1 nmol/L或P7 10 μmol/L单独处理48 h后,细胞凋亡率分别为6.86%±1.36%和13.7%±2.54%;当DTX 1 nmol/L与P7 10 μmol/L共处理48 h后,DTX与P7联用组细胞凋亡率为22.9%±3.12%,与对照组相比显著升高(P<0.01),是其6.5倍;与DTX单药组相比,DTX与P7联用组细胞凋亡比例也显著升高(P<0.05),约为DTX组的1.7倍(图2A,B)。凋亡相关蛋白结果显示,与对照组相比,DTX与P7联合处理显著降低了抗凋亡因子Bcl-2的蛋白表达水平(P<0.05)(图2C,D)。同时,与对照组相比,DNA修复酶PARP表达量显著降低(P<0.05)以及水解产物cleaved-PARP表达量显著升高(P<0.05)(图2C,E,F)。与DTX组相比,DTX与P7联用组cleaved-PARP的表达量显著上升4倍(P<0.05)(图2C,F)。
2.4 DTX与P7联合用药对耐药相关蛋白的影响
不同药物处理后,给药组与对照组相比,DTX与P7联用组以及P7单药组的主要穹窿蛋白MVP(major vault protein,MVP)表达量显著降低(P<0.05);与DTX组相比,DTX与P7联用组的MVP表达量显著降低(P<0.05)(图3A,B)。

A.cytotoxicity of DTX was assessed in A549 cells following 48 hours treatment; B.cell cytotoxicity of P7 was assessed in A549 cells following 48 hours treatment; C.effects of DTX combined with P7 on survival of A549 cells; D.Fa-CI plot
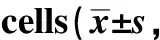

A.following 48 hours treatment with vehicle control,P7 10 μmol/L or DTX 1 nmol/L or P7 10 μmol/L combined with DTX 1nmol/L, A549 cells were subjected to annexin V/PI staining and flow cytometry analysis to quantify cell apoptosis rate; B.bar charts showed quantification of cell death data from 3 independent experiments, including early apoptotic cells (right bottom quadrant) and late apoptotic cells (right upper quadrant); C.effect of DTX or/and P7 on apoptosis-related proteins in A549 cells by Western blot;D.Bcl-2 expression levels following the treatment of DTX or/and P7;E.PARP expression levels following the treatment of DTX or/and P7;F.cleaved-PARP expression levels following the treatment of DTX or/and P7;*P<0.05,**P<0.01 compared with vehicle control;#P<0.05 compared with DTX group
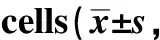

A.effect of DTX or/and P7 on multidrug-resistant proteins in A549 cells by Western blot; B.MVP expression levels following the treatment of DTX or/and P7;*P<0.05 compared with control group;#P<0.05 compared with DTX group

3 讨论
Hsp90参与了众多信号调控,其主要作用是维持细胞内众多蛋白的结构稳定性。因此,抑制肿瘤细胞内的Hsp90往往导致胞内多种信号传导通路不稳定,最终抑制肿瘤细胞的生存与转移[12]。研究发现,癌细胞中Hsp90的表达水平比正常细胞高2~10倍[13]。因此,Hsp90成为了热门抗肿瘤药物研发靶点,目前的抑制剂包括:ganetespib、AUY922和17-DMAG等。但由于肝毒性较大等原因,临床实验均未达到理想的效果[14],限制了其进一步的发展。
由于靶向肽独有的高亲和力、高组织渗透率,能避免产生上述不良反应。且其高亲和力靶向性能够使得其在与化疗药联合使用时降低单独用药的给药剂量,从而减小药物的不良反应。本研究室前期研究发现了具有Hsp90靶向与抑制双重功能的多肽P7[8]。为利用DTX与P7联合用药,探究其对NSCLC细胞A549的影响创造了条件。
本研究在确定了DTX与P7具有协同作用后,进一步探讨了抗凋亡蛋白Bcl-2,以及细胞凋亡的关键指标——PARP的剪切。Bcl-2可以抑制由多种细胞毒因素所引起的细胞凋亡,但其本身不能促进DNA修复。而PARP作为一种DNA修复酶,在细胞凋亡发生时将被剪切失去酶活力形成cleaved-PARP。cleaved-PARP的上调表明药物对细胞凋亡的诱导作用。本研究发现,DTX和P7联合用药能显著降低抗凋亡因子Bcl-2,同时cleaved-PARP显著升高,说明DTX和P7协同增效促进了细胞凋亡。为了进一步探讨其促进凋亡的原因,本研究检测了DTX和P7联合用药对主要穹窿蛋白(MVP)表达水平的影响。MVP的过表达是细胞耐药的原因之一,其可能介导了药物的转运过程[15]。肿瘤细胞可能通过过表达MVP来降低细胞内DTX浓度,从而抑制细胞凋亡。本研究结果显示,DTX和P7联合用药,能够显著降低MVP表达量。这提示DTX与P7联合给药可能是通过降低MVP促进其凋亡的。
综上所述,P7能协同DTX抑制A549细胞的存活并诱导其凋亡。其机制可能与降低凋亡抑制蛋白Bcl-2表达水平、失活DNA修复酶PARP及降低耐药蛋白MVP表达有关。本研究为未来提高NSCLC细胞对DTX的药物敏感性及降低其不良反应提供了新的研究思路。
