缺磷响应基因OsSQD2.1对水稻生长发育的影响
2020-05-30刘璐许传山孙雅菲胡志艾昊刘秀丽王小文孙淑斌
刘璐 许传山 孙雅菲 胡志 艾昊 刘秀丽 王小文,4 孙淑斌,*
缺磷响应基因对水稻生长发育的影响
刘璐1许传山2孙雅菲3胡志1艾昊1刘秀丽1王小文1,4孙淑斌1,*
(1南京农业大学 资源与环境科学学院,南京 210095;2临沂市兰山区农业局, 山东 临沂 276000;3上海市农业科学院 生态环境与保护研究所, 上海 201403;4南京农业大学 园艺学院 园林系,南京 210095;*通信联系人,E-mail: sunshubin@njau.edu.cn)
【】旨在研究水稻缺磷响应基因对水稻生长发育的影响,从而解析其作用。通过生物信息学的方法,确定基因及蛋白结构并分析启动子上的顺式作用元件;通过荧光定量PCR检测,研究不同缺素条件下的表达;测定T-DNA插入突变体和沉默干涉材料不同时期表型、磷含量和净光合速率,研究对转基因植株生长发育及光合作用的影响。基因编码区全长为3548 bp,位于第1染色体上,具有11个外显子和10个内含子,OsSQD2.1属于糖基转移酶家族;启动子上含有多个缺磷响应顺式作用元件;受缺磷诱导,缺硫抑制。营养生长期突变体或沉默材料地上部长度和主根长均显著低于野生型。生殖生长期,突变体或沉默材料株高和千粒重显著低于野生型,结实率无显著差异。的突变与沉默增加正常供磷时叶片中的总磷,在缺磷条件时野生型相比无明显差异;此外,苗期和成熟期突变体的净光合速率显著低于野生型,初步推测影响水稻净光合速率。受缺磷响应,并影响水稻生长发育。
磷; 缺磷响应; 缺磷; 水稻; 生长发育
磷(phosphorus, P)在植物体内含量约占植物干质量的0.05%~0.50%,是植物生长发育必需的大量营养元素之一[1]。它是生物体内生物膜、蛋白质、核酸、磷脂、ATP等重要物质的组成成分,广泛参与植物体内碳水化合物转运、糖类物质及脂类物质的代谢等过程,并在种子萌发、花粉发育和果实的形成等过程中起重要作用[2-6]。植物主要吸收土壤溶液中的正磷酸盐满足自身需求(Pi),由于其易被土壤中的钙、铁、铝等固定,土壤磷有效性低成为植物生长的重要限制因子[7]。
为了适应磷缺乏环境,植物在长期的进化过程中形成了一系列的适应性机制[8-9]。缺磷条件下,叶绿体类囊体中的磷脂(肌醇-6-磷酸、磷脂酰乙醇胺、磷脂酰甘油、磷脂酰肌醇)降解,释放可溶性磷酸盐,同时糖脂(单半乳糖甘油二脂和双半乳糖甘油二脂)和硫脂(SQDG)合成增加,功能上回补磷脂是常见的植物适应缺磷胁迫环境的机制之一[10-12]。目前,硫代异鼠李糖甘油二酯(简称硫脂,SQDG)的合成已经明确需要三个反应[13]。首先,通过尿苷二磷酸葡萄糖焦磷酸化酶3(UGP3)将1-磷酸葡萄糖转化为尿苷二磷酸葡萄糖(UDP-glucose)[14]。然后尿苷二磷酸硫代异鼠李糖合酶(Sulfoquinovosyl diacylglycerol 1, SQD1)将尿苷二磷酸葡萄糖转化为尿苷二磷酸硫代异鼠李糖(UDP-SQ)[11, 15-16]。在最后一步中,硫代异鼠李糖甘油二酯合酶(Sulfoquinovosyl diacylglycerol 2, SQD2)将甘油二酯(DAG)与尿苷二磷酸硫代异鼠李糖反应生成硫代异鼠李糖甘油二酯[15-17]。所编码的SQD2酶除了能够催化SQDG的合成外,还可以在缺磷时催化生成葡糖醛酸基甘油二酯(GlcADG)[14]。比较而言,GlcADG与SQDG结构相似,但拟南芥中GlcADG只在缺磷条件下合成,正常供磷条件下则不能合成GlcADG;此外,拟南芥在缺失GlcADG时叶绿素分解加快,植株变白,最终会严重破坏拟南芥自身生长。由此可知,在缺磷条件下GlcADG有助于拟南芥生长[10,14]。
国内外对水稻家族基因已有一定研究基础,并已证实了在水稻中有三个2的同源基因,根据同源性高低,分别将它们命名为(),和[18]。的基因功能已被部分报道,OsSQD2.2与UDP-SQ不能直接生成SQDG,但在参与类黄酮合成以及介导水稻一级和二级糖分配的过程中均起了重要作用[17]。水稻中的功能尚未明确。本研究通过生物信息学手段分析了的基因及氨基酸结构、启动子顺式作用元件和在不同缺素下的表达模式,为研究的生物学功能奠定了基础。同时,利用创制的转基因材料,研究了对水稻不同生育期生长发育的影响,旨在揭示该基因通过调控养分利用,从而影响水稻生长发育的机理。
1 材料与方法
1.1 试验材料
水稻材料包括水稻日本晴、中花11、突变体材料(购于华中农业大学突变体库)和RNAi株系(-Ri1、-Ri2,本实验室孙雅菲师姐构建)。
1.2 OsSQD2.1的序列分析及克隆
根据拟南芥的(AF454354)基因序列在NCBI(http://www.ncbi.nlm.nih.gov)做BLASTx分析得到水稻中同源基因(Os07g0100300),(Os01g0142300),(Os03g0265 100),并可知基因结构。根据GeneBank公布的全长cDNA序列设计引物,以水稻日本晴叶片的cDNA为模板,扩增得到的全长编码框(open reading frame,ORF)。经测序确定其实际的cDNA序列,并与网站上公布的cDNA序列和基因组序列,利用DNAMAN软件比对分析,以确定其内含子和外显子的结构。引物合成和测序由南京金唯智生物公司完成。
1.3 OsSQD2.1基因启动子基序分析
基因的表达受上游相关转录因子的调控,而转录因子对基因的调控是通过与顺式调控元件作用完成的。通过Softberry软件和RSA-Tools(http://rsat. ulb.ac.be/rsat/)软件来分析基因转录起始位点和顺式作用元件分布的位置和数量(启动子长度为2184 bp)。本研究分析的与磷酸盐胁迫相关的顺式作用元件包括W-box(TTGACY),P1BS(GNATATNC)和PHO-like元件(GDHGTGG)。
1.4 植物生长条件与缺素表达模式检测
为了研究在不同元素缺乏处理下的表达模式,对野生型(日本晴)进行了不同营养元素(P、S)缺乏处理。将水稻野生型种子经30%次氯酸钠(NaClO)消毒30 min后,用自来水清洗5~6次,直至将残留的次氯酸钠洗净。随后将洗好的种子放于水面,并置于37℃恒温培养箱,暗培养2~3 d催芽,待露白后,将种子移动至人工气候室,人工气候室温度为20℃~32℃,光照周期14 h(昼)/10 h(夜),并用1/2营养液培养[19]。待水稻长至两叶一心后移栽至中转箱,并分别进行缺磷(0 µmol/L Pi, –P)和缺硫(20 µmol/L S, –S)处理,7 d后分别采根和地上部样品。使用Trizol提取叶片总RNA,然后用Vazyme反转录试剂盒进行反转录。以上均按试剂盒说明书进行操作。根据NCBI网站提供的mRNA序列,利用引物设计软件Primer 5.0设计的定量引物,并以水稻基因(Os03g0718100)为内参基因,和引物序列详见表1。常规qRT-PCR体系均为 20µL:PCR预混液10µL,上下游引物各1 µL,模板(基因组 DNA或 cDNA)1µL,双蒸水7µL。

表1 OsActin和OsSQD2.1的定量PCR序列
1.5 转基因材料水培实验
野生型和转基因材料用1/2 MS培养基发苗,7 d后选取长势一致的幼苗移入15 L培养箱中,每箱30株苗,先清水缓苗然后全营养液培养。全营养液成分参照IRRI水稻完全营养液配方[20]。营养液用4 mol/L HCl调pH至5.5,每2 d换一次营养液。水培3周后观察表型并统计相关生理数据。
1.6 转基因材料磷含量的测定
在成熟期时取盆栽野生型、转基因材料的叶片,105℃下杀青30 min后于70℃下烘至恒重,磨碎,称取磨碎的植株样品0.05 g,采用硫酸-双氧水消煮法和钼锑抗比色法测定总磷含量。
1.7 转基因材料盆栽实验
待野生型、突变体及沉默干涉材料长至三叶一心时,分别将中花11、纯合突变体、-RNAi株系Ri1、Ri2移至桶中,进行盆栽实验。盆栽实验在南京农业大学牌楼实验基地进行,土壤为江苏省南京地区酸性黄棕壤。土壤中的全氮含量为0.91 g/kg,有效磷含量18.91 mg/kg,速效钾含量185.67 mg/kg,有机质含量11.56 g/kg;pH值为5.08。每桶装15 kg土壤,磷肥施用量为160 mg/kg,氮肥分三次施入基肥0.1 g/kg,分蘖肥0.15 g/kg,穗肥0.06 g/kg,不施钾肥(所用土壤中速效钾含量较高),每个株系5个重复。在成熟期分别对野生型、突变体及沉默干涉材料的株高、结实率、千粒重等农艺性状进行考查。
1.8 OsSQD2.1突变体及沉默材料净光合速率测定
处理材料分别为苗龄为30 d正常供磷的水培苗(培苗方法参考1.5)以及成熟期土培水稻(田间种植参考1.7)。使用Li-Cor 6400型光合作用测定仪的红蓝光源分别于人工气候室9:00−15:00和田间9:00−12:00测定新完全展开叶的净光合速率。叶室内的光照强度为1500 μm/(m2∙s), CO2浓度为400~ 420 μm/mol(大气CO2浓度),叶片温度和叶室内空气湿度分别控制在25℃~28℃和40%~60%。将叶片放入叶室后,待数据稳定时(约需10 min)记录数据。
1.9 数据统计分析
所有测定数据在Graphpad Prism 6.0中整理,经SPSS软件进行差异显著性分析。
2 结果与分析
2.1 OsSQD2.1基因与蛋白结构分析
是呈组成型表达并能够编码合成硫代异鼠李糖甘油二酯合成酶SQD2的基因,定位在拟南芥第1染色体上。将基因序列在NCBI进行同源搜索,水稻中获得3个同源基因,按其同源性高低分别命名为和[18]。BLAST和GenomeScan分析表明,位于水稻第1染色体上;基因的编码区全长为3548 bp。如图1所示,和分别含有11、11、11和10个外显子。在水稻和拟南芥中,基因均是由两端较长的外显子和中间较短的外显子构成。其中,水稻基因的第1外显子比拟南芥中基因少233 bp,而最后一个外显子却比拟南芥中的多266 bp。两基因核酸相似性最高为84%。经NCBI(http://www.ncbi.nlm.nih.gov)蛋白结构域分析,比较AtSQD2及OsSQD2家族三个基因蛋白结构域(图1-B),发现三个基因编码的蛋白质均具有糖基转移结构域GT-like,由此可知,OsSQD2.1、OsSQD2.2、OsSQD2.3与拟南芥SQD2同属于糖基转移酶家族中的GT-like家族。
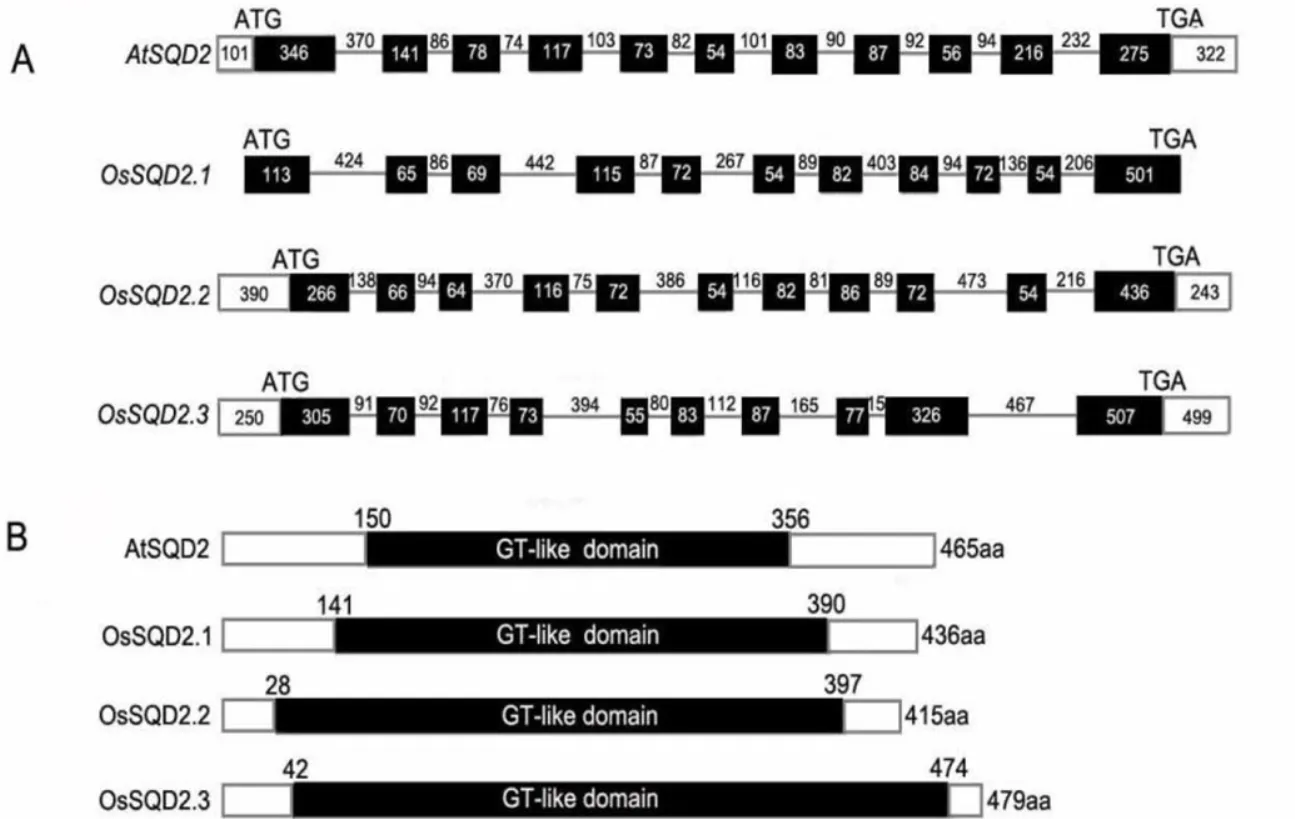
A-AtSQD2、OsSQD2.1、OsSQD2.2及OsSQD2.3基因的内含子和外显子长度与位置;白色方块代表UTR区域,黑色方块代表外显子,直线代表内含子;数字代表各区域的碱基数。B-氨基酸结构及关键结构域;黑色方块代表GT-like结合结构域,黑色方块上方的数字代表此结构域所在氨基酸的位置。
Fig. 1.Comparison of genes and domain structures ofin rice and.
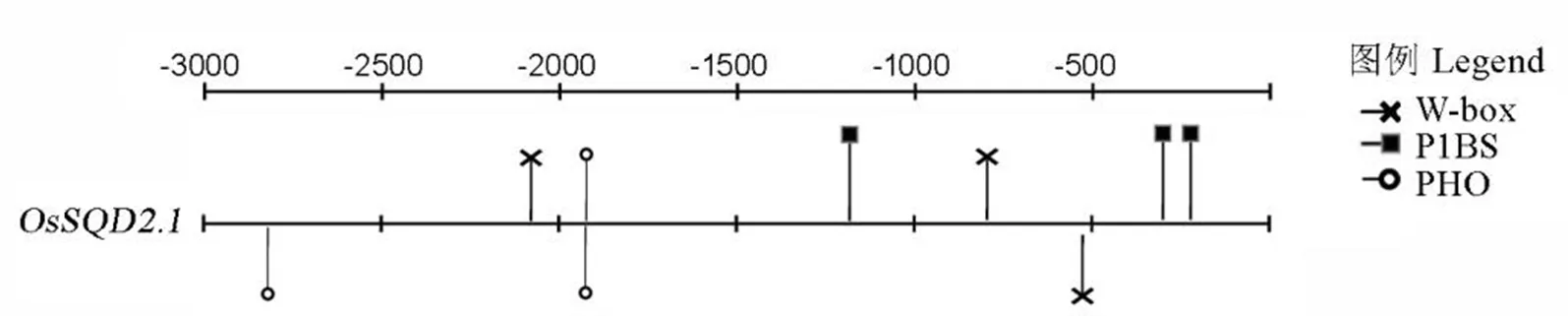
图2 OsSQD2.1基因启动子顺式作用调控元件分析
Fig. 2. Motif analysis of the identified promoters of
2.2 OsSQD2.1基因启动子基序分析
通过运用RSA-Tools(http://rsat.ulb.ac.be/rsat/)对OsSQD2.1进行启动子分析,结果显示在的启动子中含有3个W-box基序(TTGACY),2个PHO-like元件基序(GDHGTGG)和3个P1BS基序(GNATATNC),推测可能受缺磷调控(图2)。
2.3 OsSQD2.1的缺素表达模式
拟南芥中合成SQDG需要亚硫酸盐参与,且缺硫会影响编码合成UDPG的UGP3的基因表达量[13-14],同时分析发现启动子区域内含有与缺磷相关的顺式调控作用元件PIBS和W-box。在此基础上验证是否受缺磷及缺硫响应。如图3所示,在水培缺磷及缺硫处理7 d后检测发现,缺磷处理时无论在地上部或根部的表达量均显著上调而在缺硫处理时的表达量显著下调。该结果表明受缺磷诱导,并受缺硫抑制。
2.4 OsSQD2.1基因T-DNA插入的突变体的获得与鉴定
根据基因序列信息,从华中农业大学国家植物基因研究中心(武汉)创建的水稻增强子捕获系T-DNA插入突变体库购买突变体号为RMD_04Z11FO86的突变体株系。根据网站提供的信息可知,中外源T-DNA插入在第1外显子中(图4-A)。随后通过两轮PCR扩增法鉴定获得突变体纯合体(图4-B、C)。第一轮PCR引物分别位于目的基因片段的5′和3′端的侧翼基因序列上,用以鉴定该基因上有没有T-DNA插入所导致的无法正常转录现象;第二轮PCR引物分别位于T-DNA序列和侧翼基因序列上,以确保T-DNA插入的存在。所以,当且仅当第一轮PCR无片段扩出而第二轮PCR有特异性片段扩出时,可鉴定并判断在该等位基因上有T-DNA的插入,即该基因的突变纯合体。因此,我们首先利用LP、RP和BP(引物位置如图4-A所示)进行两轮PCR验证,随后采用RT-PCR技术,利用引物P3和P4(引物位置如图4-A所示)对获得的纯和突变体进行进一步的半定量分子鉴定(图4-A)。经两轮PCR鉴定可知,所购买突变体株系在第一个外显子确有T-DNA的插入(图4-B),半定量分子鉴定表明,T-DNA插入的确导致了该基因无法正常转录,完全沉默(图4-C)。

不同字母表示显著性差异达到5%水平。下图同。
Fig. 3. Relative expression ofin response to phosphorus deficiency(-P) and sulfur deficiency(-S).
2.5 OsSQD2.1突变与沉默对水稻苗期表型的影响
为了研究缺失和突变后对水稻营养生长阶段的影响,对纯合突变体和RNAi材料(Ri1和Ri2)进行水培幼苗的表型鉴定(图5)。发芽3周后,观察到与野生型相比,和-RNAi生长明显受抑制(图5-A),其中,突变体和RNAi材料根部及地上部长势明显弱于野生型。和-RNAi地上部长度显著矮于野生型,其中,突变体地上部比野生型矮了43%(图5-B)。此外,和-RNAi的主根长度明显比野生型短小,长度依次为WT>Ri2>>Ri1(图5-C)。这些结果表明,的缺失和沉默抑制了水稻营养生长期的生长发育。

A—OsSQD2.1突变体插入信息;B, C—两轮PCR鉴定纯合体及RT-PCR鉴定沉默效果。
Fig. 4. Identification of homozygous T-DNA insertion mutants of
2.6 OsSQD2.1突变与沉默对水稻成熟期叶片磷含量的影响
为了研究突变对生殖生长阶段的水稻植株叶片磷浓度的影响,设置160 mg/kg(模拟正常供磷)和0 mg/kg(缺磷)的磷处理。结果如图6所示,正常供磷条件下,与野生型相比,和-RNAi株系叶片中的总磷含量有显著增高的趋势。这三个株系叶中的总磷含量分别增加了30.7%、38.4%、23%。而缺磷条件下与野生型相比突变体或沉默干涉材料总磷含量无明显差异。
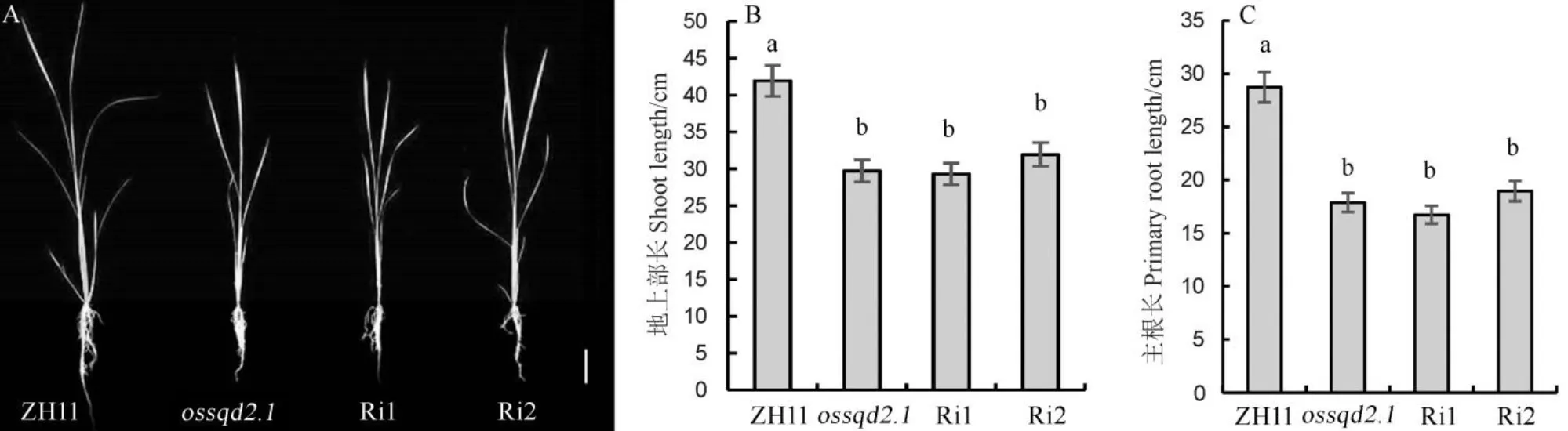
图5 OsSQD2.1突变体及沉默材料(Ri1和Ri1)的苗期表型
Fig. 5.Phenotype ofmutation and silencing(Ri1 and Ri1) at seedling stage(Mean±SE,=5).
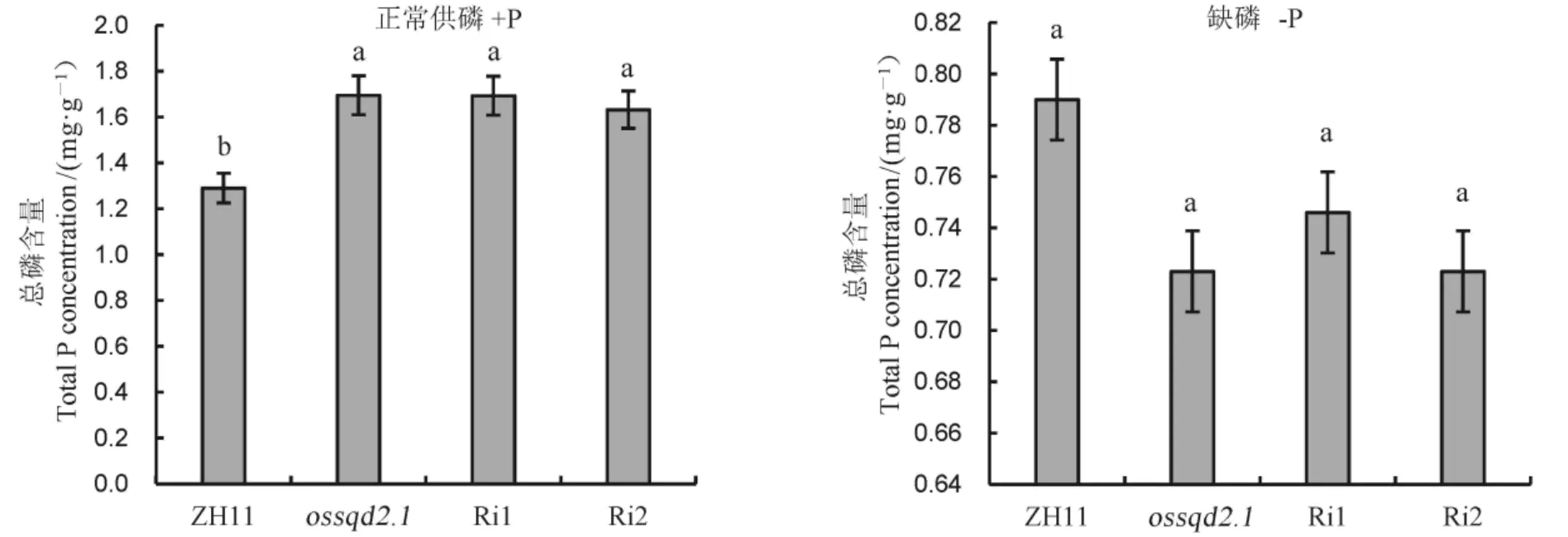
图6 正常供磷和缺磷条件下盆栽实验中野生型、ossqd2.1和OsSQD2.1-RNAi材料(Ri1和Ri1)叶片总磷含量
Fig. 6. Total P concentration in leaves of pot-cultured wild type,and-RNAi materials(Ri1 and Ri1) under Pi-sufficient and Pi-deficiency conditions(Mean±SE,=5).

图7 OsSQD2.1突变体及沉默材料(Ri1和Ri1)农艺性状分析
Fig. 7. Phenotype of WT,and-RNAi lines(Ri1 and Ri1) at maturity stage(Mean±SE,=5).
2.7 OsSQD2.1的突变和沉默抑制水稻生殖生长阶段的株高
通过鉴定成熟期、-RNAi与野生型的表型,发现成熟期突变体与-RNAi的生长同样受到抑制(图7-A);突变体与RNAi材料的株高均明显低于野生型(图7-B),其中突变体株高比野生型低了17.3%。与野生型相比,突变体或沉默材料的千粒重显著降低,其中与野生型相比突变体结实率约下降41%(图7-D),结实率无明显差异(图7-C)。以上结果说明的突变与沉默除了影响营养生长期水稻的生长之外,对生殖生长阶段水稻的生长同样起了抑制作用。
2.8 OsSQD2.1的突变与沉默抑制水稻净光合速率
为了研究缺失和突变后对水稻不同时期净光合速率的影响,分别对鉴定所得的纯合突变体和RNAi材料(Ri1和Ri2)水培苗以及野生型和纯合突变体于田间土培苗进行净光合速率测定。结果如图8所示,水稻营养生长期与野生型相比,和-RNAi净光合光合速率显著降低,生殖生长期在田间突变体的净光合速率相对于野生型仍明显降低,且该时期的净光合速率低于营养生长期。推测可能影响水稻光合作用。
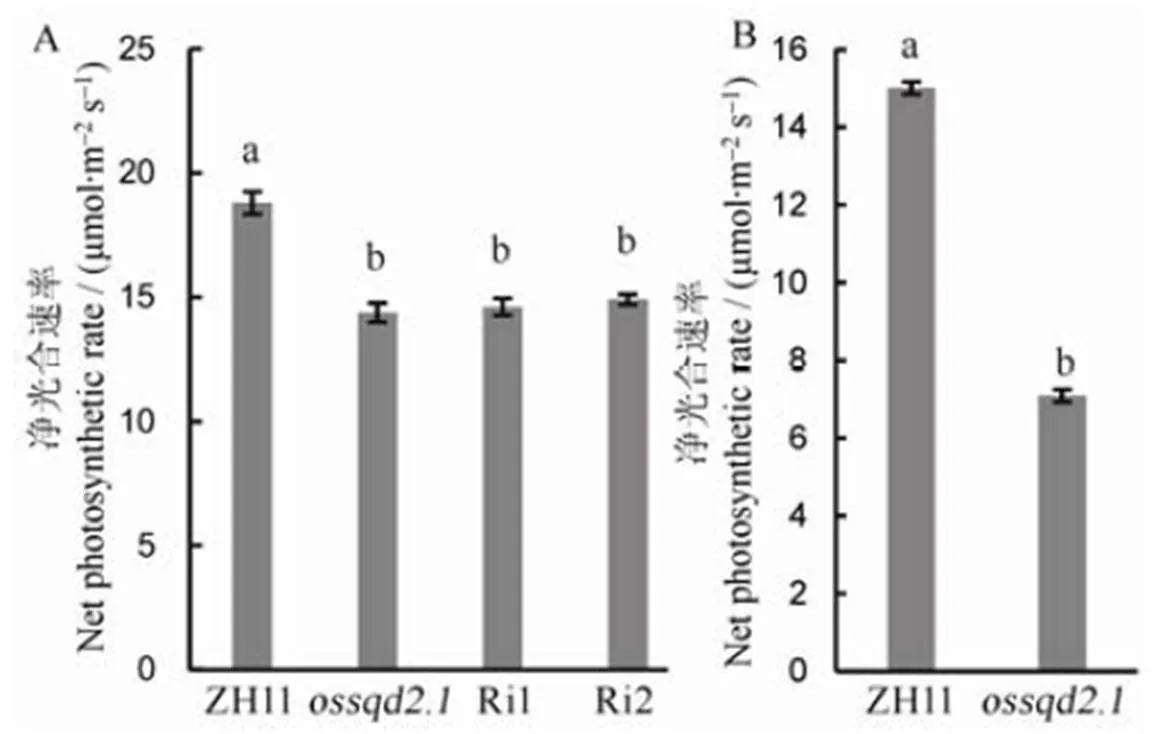
图8 OsSQD2.1突变体与沉默干涉材料(Ri1和Ri1)苗期(A)和成熟期(B)净光合速率
Fig. 8. Net photosynthetic rate of WT,and-RNAi lines(Ri1 and Ri1) at the seedling stage(A) and the maturity stage(B) (Mean±SE,=5).
3 讨论
是模式生物拟南芥中已被报道参与合成硫代异鼠李糖甘油二酯(SQDG)以及缺磷条件下又可生成葡糖醛酸基甘油二酯β-葡糖醛酸酶(GlcADG)的酶基因[10,13]。根据它的基因序列及蛋白功能结构域BLAST所获得的水稻中的同源基因有三个,按同源性高低分别命名为和[18]。其中,已被报道,OsSQD2.2与UDP-SQ不能直接生成SQDG,但它在类黄酮合成以及介导水稻一级和二级糖分配的过程中均起重要作用[18]。本研究通过对进行启动子分析,发现该基因的启动子含有3个W-box基序,2个PHO-like元件基序和3个P1BS基序,故而推测可能受缺磷调控。基因也明显受缺磷诱导[14]。本研究对该基因在不同供磷条件下进行检测,结果表明,在缺磷条件下水稻地上部和根部中的表达量均出显著上调。由此可见,与均为缺磷响应基因,且在磷素营养吸收与利用过程中行使功能。拟南芥中,AtSQD2所参与的酶促反应生成SQDG需要亚硫酸盐[15-17],在缺硫条件下该反应受抑制。水稻中,在缺硫条件下的表达与缺磷相反,的表达量在地上部和根部中均显著下调。这一结果表明可能为编码合成硫代异鼠李糖甘油二脂的酶的基因,且水稻中该反应同样需要硫的参与。总的来说,除了对磷响应之外,还响应硫,说明可能参与磷素和硫素的积累和利用过程。
自然界中,由于磷(P)肥易于固定在土壤中,且利用效率非常低,磷饥饿已成为提高作物产量和改善质量的主要限制因素之一[20]。近年来,已有研究报道表明,OsPHR2是调控Pi稳态网络的中央转录因子,OsPHR2作为监管中心可以控制至少两个途径:第一个途径是PHR2-MiRNA399-PHO2,这一途径包含一系列基因,包括和[19],[21],[22]和[23]。这些基因的过表达转基因水稻品系或抗性水稻突变体均具有P中毒的表型,叶片上有许多褐变点,并且Pi含量增加了。
国内外对水稻基因的研究仍然很少,但已证实该基因受缺磷诱导。为缺磷信号途径中的转录因子,的沉默导致的表达量下降,并削弱其响应缺磷的能力[21];OsMYB2P-1是转录因子,受缺磷诱导。超表达材料中地下部表达量明显上调;而干涉材料中地上部的表达量远低于超表达材料地上部[24]。而在OsSPX1-RNAi材料中的表达量明显降低[21]。可以推断水稻基因受和的正调控和的负调控。是否受的调控还不得而知。
水稻种子根是由胚发育而来且在幼苗期发挥着主要作用,水稻根系主要由胚后发育的不定根和侧根构成。不定根与种子根一样,都具有十分重要的作用,它能够促进水稻淹水状态下对养分和水分吸收以及气体交换。本研究发现,的突变和沉默显著抑制了水稻苗期主根的生长发育,说明水稻营养生长期影响了其生长发育。的突变体和沉默对水稻生殖生长期的株高和千粒重均有抑制作用,对结实率无明显影响。结合苗期野生型和转基因材料表型观察可知,对水稻苗期和成熟期的生发发育均有影响。正常供磷条件下的突变或沉默促进了总磷在叶片中的积累,推测参与了水稻磷素吸收和积累过程。本研究还发现苗期和成熟期突变体的净光合速率均显著小于野生型,故而推测在水稻光合作用中起到一定作用,而影响水稻不同时期的生长发育可能是通过影响水稻光合作用导致的,这一部分机理有待于进一步深入研究。
[1] Vance C P, Uhdestone C, Allan D L. Phosphorus acquistion and use: Critical adaptations by plants for securing a nonrenewable resource[J]., 2003, 157(3): 423-447.
[2] Raghothama K G, Karthikeyan A S. Phosphate acquisition[J]., 1999, 274(1-2): 665-693.
[3] Rausch C, Bucher M. Molecular mechanisms of phosphate transport in plants[J]., 2002, 216(1): 23.
[4] 张占田, 孙雅菲, 艾昊, 罗闻真, 冯冰, 孙文献, 徐国华, 孙淑斌. 水稻转录因子基因的时空表达特征及其在营养生长中的调控[J]. 中国水稻科学, 2018, 32(5): 427-436.
Zhang Z T, Sun Y F, Ai H, Luo W Z, Feng B, Sun W X, Xiu G H, Sun S B. Expression patterns and regulation of transcription factor genein vegetative growth in rice[J]., 2018, 32(5): 427-436. (in Chinese with English abstract)
[5] 冯冰, 孙雅菲, 艾昊, 刘秀丽, 杨晶, 刘璐, 高飞燕, 徐国华, 孙淑斌. 水稻蔗糖转运蛋白基因在磷素利用过程中的功能研究[J]. 中国水稻科学, 2018, 32(6): 549-556.
Feng B, Sun Y F, Ai H, Liu X L, Yang J, Liu L, Gao F Y, Xu G H, Sun S B. Overexpression of sucrose transporteraffects rice morphology and physiology., 2018, 32(6): 549-556. (in Chinese with English abstract)
[6] Richardson A E, Barea J M, McNeill A M. Acquisition of phosphorus and nitrogen in the rhizosphere and plant growth promotion by microorganisms[J]., 2009, 321(2): 305-339.
[7] Ai P H, Sun S B, Zhao J N, Fan X R, Xin W J, Guo Q, Yu L, Shen Q R, Wu P, Miller A J, Xu G H. Two rice phosphate transporters, OsPht1;2 and OsPht1;6, have different functions and kinetic properties in uptake and translocation[J]., 2009, 57(5): 798-809.
[8] Vance C P, Uhde-Stone C, Allan D L. Phosphorus acquisition and use: critical adaptations by plants for securing a nonrenewable resource[J]., 2003, 157: 423-447.
[9] Dissanayaka D M S B, William C P, Hans L, Siebers M, Marambe B, Wasaki J. Molecular mechanisms underpinning phosphorus-use efficiency in rice[J]., 2018, 10: 1111-1158.
[10] Jeong K, Baten A, Waters D L E, Pantoja O, Julia C C, Wissuwa M, Heuer S, Kretzschmar T, Rose T J. Phosphorus remobilization from rice flag leaves during grain filling: An RNA-seq study[J]., 2017, 15: 15-26.
[11] Tawaraya K, Honda S, Cheng W, Chuba M, Okazaki Y, Saito K, Oikawa A, Maruyama H, Wasaki J, Waqatsuma T. Ancient rice cultivar extensively replaces phospholipids with non-phosphorus glycolipid under phosphorus deficiency[J/OL]., 2018, doi:10.1111/ppl.12699.
[12] Nakamura Y. Phosphate starvation and membrane lipid remodeling in seed plants[J]., 2013, 52: 43-50.
[13] Okazaki Y, Otsuki H, Narisawa T. A new class of plant lipid is essential for protection against phosphorus depletion[J]., 2013, 4: 1510.
[14] Mehra P, Giri J. Rice and chickpea GDPDs are preferentially influenced by low phosphate and CaGDPD1 encodes an active glycerophosphodiester phosphodiesterase enzyme[J]., 2016, 35: 1699-1717.
[15] Sanda S, Leustek T, Theisen M J, Garavito R M, Benning C. RecombinantSQD1 converts UDP-glucose and sulfite to the sulfolipid head group uprecursor UDP-sulfoquinovose in vitro[J]., 2001, 276: 3941-3946.
[16] Yu B, Xu C, Benning C.disrupted inencoding sulfolipid synthase is impaired in phosphate-limited growth[J]., 2002, 99: 5732-5737.
[17] Zhan X Q, Shen Q W, Wang X M, Hong Y Y. The sulfoquinovosyltransferase-like enzyme SQD2.2 is involved in flavonoid glycosylation, regulating sugar metabolism and seed setting in rice[J]., 2017, 7(1): 4685-4692.
[18] 孙雅菲. 缺磷响应基因水稻生长发育和磷素吸收和利用中的功能研究[D]. 南京: 南京农业大学, 2018.
Sun Y F. Functional analysis of phosphate starvation response geneon growth, phosphate uptake and utilization in rice[D]. Nanjing: Nanjing Agricultural University, 2008.
[19] Doerner P. Phosphate starvation signaling: A threesome controls systemic Pi homeostasis[J]., 2008, 11: 536-540.
[20] Lynch J P. Root phenes for enhanced soil exploration and phosphorus acquisition: Tools for future crops[J]., 2007, 156: 1041-1049.
[21] Zhou J, Jiao F, Wu Z, Li Y, Wang X, He X, Zhong W, Wu P.is involved in phosphate-starvation signaling and excessive phosphate accumulation in shoots of plants[J]., 2008, 146: 1673-1686.
[22] Ai P, Sun S, Zhao J, Fan X, Xin W, Guo Q, Yu L, Shen Q, Wu P, Miller A. Two rice phosphate transporters, OsPht1;2 and OsPht1;6, have different functions and kinetic properties in uptake and translocation[J]., 2008, 57: 798-809.
[23] Dai X, Wang Y, Yang A, Zhang W H. OsMYB2P-1, an R2R3 MYB transcription factor, is involved in the regulation of phosphate-starvation responses and root architecture in rice.2012, 159(1): 169-183.
[24] Frentzen M. Phosphatidylglycerol and sulfoquinovo- syldiacylglycerol: Anionic membrane lipids and phosphate regulation[J]., 2004, 7: 270-276.
Effects of Phosphate Starvation Responses Geneon Growth in Rice
LIU Lu1, XU Chuanshan2, SUN Yafei3, HU Zhi1, AI Hao1, LIU Xiuli1, WANG Xiaowen1,4, SUN Shubin1,*
(1College of Resources and Environmental Science, Nanjing Agricultural University, Nanjing 210095, China;2Agricultural Bureau of Lanshan District, Linyi City, Linyi 276000, China;3Eco-Environmental Protection Research Institute, Shanghai Academy of Agricultural Sciences, Shanghai 201403, China;4Landscape Architecture Department, College of Horticulture, Nanjing Agricultural University, Nanjing 210095, China;*Corresponding author, E-mail: sunshubin@njau.edu.cn)
【】This work aims at confirming the effects of gene, involved in phosphate starvation responses on rice growth so as to reveal its function. 【】The bioinformatics method was used to determine thegene and its protein structure and the-acting elements on thepromoter. The expression ofunder different deficiency conditions was measured by real-time PCR. For an insight into the effects ofon the growth and photosynthesis of transgenic plants, we determined the phenotype, phosphorus content and net photosynthetic rate of DNA insertion mutants and silencing interfering materials at different growth stages. 【】The coding region of thegene is 3548 bp in length and it is located on chromosome 1, with 11 exons and 10 introns. OsSQD2.1 belongs to the glycosyltransferase family;promoter contains multiple reported-acting elements responsive to phosphorus deficiency;was induced by phosphorus deficiency and inhibited by sulfur deficiency. Compared with the wild type, the shoot length and primary root length during the vegetative growth period in the mutant or silencing materials were significantly lower than the wild type. During the reproductive growth, the plant height as well as 1000-grain weight of the mutant or silencing material was significantly lower than that of wild type, and there was no significant difference in seed setting rate; The total phosphorus contents in the leaves were not significantly different in the wild type under the phosphorus deficiency condition. In addition, the net photosynthetic rate of the seedling and mature mutants was significantly lower than that of the wild type, and it was presumed thataffected the net photosynthetic rate of rice. 【】The results confirm thatis phosphorus deficiency-responsive and affects rice growth.
phosphate; phosphate starvation response; phosphorus deficiency; rice; development
Q755; Q945.1
A
1001-7216(2020)03-0237-08
10.16819/j.1001-7216.2020.9074
2019-06-28;
2019-10-22。
国家自然科学基金资助项目(31672226);转基因生物新品种培育科技重大专项(2016ZX08009-003-005)。
