他汀相关肌肉症状的研究进展
2020-05-29何瑞徐志猛王来李萍闻晓东
何瑞,徐志猛,王来,李萍,闻晓东
(中国药科大学天然药物活性组分与药效国家重点实验室,江苏 南京 210009)
他汀类药物(以下简称他汀)是一种3-羟基-3-甲戊二酸单酰辅酶A 还原酶(3-hydroxy-3-methylglutaryl-coenzyme A reductase,HMG-CoAR)抑制剂,可以阻断人体内甲羟戊酸的合成(胆固醇合成的限速步骤)。他汀具有降低血脂浓度、有利于动脉粥样斑块稳定等多种作用,现已发展成为心脑血管疾病防治的主要一线和二线药物。根据美国国家健康统计中心的降脂药物处方报道,2003—2012年,美国40岁以上的成年人中,他汀的使用率从20%增加到28%;此外,随着年龄的增长,他汀的使用率显著增加,40~59岁群体中他汀使用率为17%,75岁及以上群体中使用率为48%[1]。全世界范围内,约有25%的65岁以上老人,服用他汀作为心血管疾病的一级或二级预防[2]。2018年美国心脏协会(American Heart Association,AHA)/美国心脏病学会(American College of Cardiology,ACC)等机构联合发布的血液胆固醇管理指南提出,高剂量他汀可用于高风险的心脑血管疾病、严重的高胆固醇血症、成年糖尿病患者的二级防治[3],未来他汀的使用率将会进一步升高。然而,据观察性研究估计,7%~29%的他汀使用者会产生肌肉不良反应,如轻度肌痛,或者伴随肌酸激酶(creatine kinase,CK)显著升高的严重肌肉症状,这也是临床上限制他汀使用的主要原因[4]。服用他汀产生横纹肌溶解的概率约为万分之一,但是出现肌肉疲劳等不良反应仍不容忽视[5]。由于缺少具体的肌肉损伤检测指标,患者生理性的肌肉疼痛和疲劳虽然频繁发生,却因不易于量化和检测而难以得到治疗。尽管大多数肌肉症状并不像横纹肌溶解症那样严重,但它们仍会导致患者生活质量下降,甚至停用他汀治疗,从而影响心血管疾病患者的治疗获益。
1 他汀相关肌肉症状的临床诊断
2014年,美国国家脂质协会(National Lipid Association,NLA)将他汀相关的肌肉症状(statinassociated muscle symptoms,SAMS)进一步分为肌痛、肌无力、肌炎、肌坏死和横纹肌溶解,其中横纹肌溶解是最严重的肌肉不良反应,代表骨骼肌的重大损伤,可能会危及生命[6-7]。SAMS有多种不同的定义方法(见表1[6,8])。目前,ACC/AHA/美国国家心肺和血液研究所(National Heart/Lung and Blood Institute,NHLBI)设定的定义在文献中使用最广泛。他们提出:“肌病”是描述所有骨骼肌相关不良反应的一般术语;“肌痛”是指不伴随CK 升高的肌肉酸痛或虚弱;“肌炎”是指伴随CK 升高的肌肉症状,通常CK 水平低于10倍正常值上限(upper limitsof normal,ULN);“横纹肌溶解症”定义为,伴随CK 水平显著升高(通常大于10倍ULN)的肌肉症状,并且伴随着肌酐水平升高,棕色尿液和尿肌红蛋白阳性[6,8]。

表1他汀相关肌肉症状的不同定义Table 1Definitions for statin-associated muscle symptoms
肌痛是最常见的肌肉不良反应,并且是引起他汀停药的最常见原因,而关于SAMS 具体的发生率,目前的临床研究并无统一的结论。Cochrane基金会对99项临床试验中37939例接受他汀治疗的患者进行分析发现,只有9.4%(3551例)的患者有肌痛症状,这一比例与接受安慰剂的患者(8%)相似[9]。在一项肌肉风险预测研究中,共纳入了7924例至少接受3个月高剂量他汀治疗的患者,其中10.5%的参与者有肌病[10]。而在注重肌肉症状的患者登记处或临床试验中,患者报告肌病的比例更高。在他汀对肌肉性能影响的研究中,一项盲法对照临床试验观察了患者6 个月中的肌肉状态变化,结果显示,接受80mg 阿托伐他汀治疗的患者中有9.4%有肌病,而安慰剂组为4.6%[11]。1999—2004年美国健康和营养调查中显示,接受他汀治疗的患者自我报告肌痛的患病率为23%[12]。在患者登记处,多达29%的他汀服用患者报告肌肉相关的症状[4]。另外,患者遇到不太明显的肌肉疼痛和肌肉无力的发生时,很可能会忽视症状而使得报告肌痛的概率降低。
目前,诊断他汀毒性(肌肉相关症状)最经典的检测指标为血清CK 水平,但其在临床使用时具有一定的误导性。因为在没有肌病的情况下也会出现高血清CK,反之亦然[13]。例如,Mohaupt 等[14]在约50%的CK 水平正常的他汀治疗患者中,检测到了肌肉结构性损伤,这证实了他汀造成的肌肉损伤并不一定伴随着CK 的升高。另外,乳酸脱氢酶、辅酶Q10(CoQ10)等也常被报道为他汀相关肌肉损伤的敏感标志物,但其在临床上使用受限。Burch等[15]试图通过使用骨骼肌钙蛋白I、肌球蛋白轻链3、肌酸激酶M异构体、脂肪酸结合蛋白3联合CK 和天冬氨酸转氨酶(aspartateaminotransferase,AST)一组肌肉毒性指标来监测药物诱导的骨骼肌损伤,并作为生物标志物,但是这些指标也依赖于肾功能和肌毒性物质类型,不具有普适性。有学者鉴于血清中microRNA 的长半衰期特性,将其作为组织损伤的潜在生物标志物,在与他汀共培养的C2C12肌管中,发现细胞外miR-499-5p增加[16],但是该指标对于他汀治疗患者的特异性和敏感性尚不明确。Mitchell 等[17]认为,对于处于高风险、二级预防的心血管事件人群来说,建立他汀相关性肌病的药物基因组学(pharmacogenomics,PGx)将是诊断他汀相关性肌病的主要方法,其结果具有相当的稳定性和可信度。这开辟了确定肌肉损伤新标志物的可能性,有助于更好地识别和诊断他汀引起的肌病。
2 影响他汀相关肌肉症状的危险因素
他汀种类和剂量,以及患者的基因、体质量指数、性别、年龄等均会影响SAMS的发展。巴基斯坦的一项临床研究表明:他汀导致的肌肉萎缩高发年龄段为40~50岁,其中女性发病率为57%,男性为47%,女性比男性更容易出现肌痛症状;肌痛程度与他汀的类型、使用持续时间以及剂量之间存在相关性[18]。他汀主要以内酯(如辛伐他汀、洛伐他汀)和β-羟酸(如普伐他汀、瑞舒伐他汀等)形式存在,一旦被吸收,他汀(酸和内酯形式)可通过内皮细胞的间隙,最终达到肝细胞,并通过生物转化后被排泄。不同种类他汀的药动学性质不同,其中洛伐他汀和辛伐他汀的生物利用度最低(<5%),而匹伐他汀最高(约50%),一般来说,生物利用度低的他汀更容易与其他药物发生药物相互作用[19]。亲水性他汀类药物不太容易进入肌细胞,因此导致肌病的风险较低。而亲脂性他汀,如辛伐他汀和阿托伐他汀发生肌病的概率最高。具有高生物利用度的亲脂性他汀西立伐他汀导致横纹肌溶解症的年发生率为3.4(1.6~6.5)每万人,已经被强制退出市场[20]。
他汀可通过直接与线粒体复合物Ⅲ的Qo位点结合,抑制线粒体的代谢活动,而内酯形式他汀对线粒体的抑制效果强于酸式他汀,低亲脂性的他汀(氟伐他汀、普伐他汀等)抑制作用较低,临床上报道肌病的概率较低[21]。他汀流入肝细胞的主要转运蛋白是有机阴离子转运多肽(organic anion transporting polypeptides,OATPs)中 的OATP1B1和OATP1B3[22-24],OATP1B1 由基因SCLO1B1编码。一项荟萃分析研究表明:SLCO1B1基因多态性与SAMS之间存在关联,11246例受试者中2355例患者出现肌病,并且c.521T > C变异携带者与辛伐他汀诱导的肌病之间有很强的关联;变体c.521T > C会导致SLCO1B1的转运功能降低,进而降低他汀的清除率,反之,则使他汀导致肌肉毒性概率增大[25]。对9项包括4442例患者对照研究的病例荟萃分析显示,具有变异C等位基因的个体更可能经历
SAMS[(TC + CC)vsTT:OR=2.09;95%CI:1.27~ 3.43][26]。现有研究表明:SLCO1B1基因T521C多态性与SAMS的风险增加有关,尤其是接受辛伐他汀治疗的患者。因此,在接受他汀之前进行基因测试对于个性化治疗非常有意义。
他汀不良事件不仅与他汀的种类、用量、持续时间及患者特异性相关,可能还取决于多种药物间的相互作用。研究显示,阿托伐他汀和辛伐他汀是CYP3A4的底物,CYP3A4抑制剂可增加辛伐他汀或阿托伐他汀的暴露,CYP3A4抑制剂与它们共同给药可能会升高横纹肌溶解症的发生率,而CYP3A4抑制剂对匹伐他汀的影响较小[27]。SWEDEGENE项目的一项研究共纳入47例他汀相关性肌病患者与3871 例正常对照患者,统计分析表明影响肌病的独立危险因素为:高他汀剂量(OR=1.54,95% CI:1.32~1.80,P< 0.000 1),伴随使用夫西地酸(OR=1002,95%CI:54.55~18 410,P< 0 .0001)、环孢菌素(OR=34.10,95%CI:4.43~262.45,P=0.0007)、吉非罗齐(OR=12.35,95%CI:2.38~64.10,P=0.0028)治疗等。并证实随着他汀剂量的增加,联合使用夫西地酸、环孢菌素、吉非罗齐等药物,他汀诱导肌病的概率均会升高[28]。另有研究认为,他汀与钙通道阻滞剂(地尔硫䓬)、抗心律失常药(胺碘酮)、免疫抑制剂(环孢菌素)、大环内酯类(克拉霉素)、抗真菌药(酮康唑)、细胞色素P450(cytochrome P450proteins,CYP)抑制剂和引起依赖(酒精、阿片类药物)的药物联合应用,均可能促进SAMS的发展[29]。因此,临床应建立患者的电子病历体系,了解患者同时使用的所有药物,并且按照处方建议避免同时使用能够发生相互作用的药物,分析影响他汀相关性肌病发展的不良因素,有助于提供更加有效的他汀治疗方案[30]。
⑩蝴蝶效应也叫拓扑学连锁反应,是指在一个动力系统中,初始条件下微小的变化能带动整个系统的长期的巨大的连锁反应.
3 他汀引起他汀相关肌肉症状的作用机制
他汀可促进脂肪酸合成,抑制胰岛素依赖的葡萄糖摄取[31],还会抑制快肌细胞中的β-羟基脂酰CoA 脱氢酶活性,使脂肪酸β-氧化降低[32];甲羟戊酸途径的下游产物以及类异戊二烯中间体合成减少[33],后者抑制胆固醇、CoQ10和多萜醇的合成,并且减少结构蛋白的异戊二烯化。另外,胆固醇减少可能还会影响胆汁酸和维生素D(vitamin D,VD)的代谢。他汀还可抑制线粒体呼吸链复合体Ⅰ和复合体Ⅲ,抑制线粒体氧化呼吸,使腺苷三磷酸(adenosine triphosphate,ATP)合成减少,肌浆内乳酸含量升高,导致发生肌无力、痉挛和肌痛。同时他汀诱导肌肉组织中活性氧簇(reactiveoxygen species,ROS)堆积,肌浆网和线粒体中Ca2+外泄,导致线粒体膜电位降低,激活Caspase3/Caspase9,诱导细胞凋亡,从而发生肌坏死。然而,不同种类的他汀引起SAMS的风险程度不同。这些差异可能与它们抑制胆固醇合成的相对效力相关,但也可能取决于其他效应,如他汀代谢、药物相互作用、剂量和亲脂性等[34-35]。综上所述,他汀进入机体并大量积累,可导致人体细胞产生病理生理学变化,从而产生SAMS,并且这种作用具有剂量和时间依赖性。
3.1 减少甲羟戊酸途径产物合成
他汀通过抑制HMG-CoAR 可减少甲羟戊酸途径代谢物,如CoQ10/牻牛儿牻牛儿焦磷酸(geranylgeranylpyrophosphate,GGPP)和法尼基焦磷酸(farnesyl pyrophosphate,FPP)的形成(见图1)。骨骼肌对于他汀的敏感程度是肝细胞的40倍,他汀可更有效地抑制肌细胞中的甲羟戊酸合成。研究显示,通过特异性敲除骨骼肌中HMG-CoAR,小鼠出现SAMS并伴随着血清CK 值升高和肌肉坏死,而口服补充甲羟戊酸可以完全逆转敲除小鼠的肌肉毒性[36]。另有研究认为,他汀引起的肌毒性依赖于骨骼肌中HMG-CoAR 酶活性以及甲羟戊酸途径的下游代谢物的缺陷;对于分化成肌管的小鼠成肌细胞,与洛伐他汀共同培养后,肌管发生萎缩,肌肉萎缩相关基因MAFbx表达水平升高,通过添加甲羟戊酸和geranylgeranol(GGPP的前体)可以防止肌肉损伤,添加farnesol(FPP 的前体)则无效[37]。因此,可以认为他汀诱导细胞的牻牛儿牻牛儿基化(geranylgeranylation)缺陷,限制了甲羟戊酸途径下游的GGPP 合成,诱导细胞凋亡,从而造成肌肉损伤。
CoQ10是线粒体氧化呼吸电子传递链(electron transport chain,ETC)的必需辅酶,在复合物Ⅰ和Ⅱ之间进行电子转移,故CoQ10减少可能会损害线粒体氧化呼吸和ATP的产生。研究显示,接受阿托伐他汀的小鼠中,其肌肉CoQ10降低近50%[38]。在接受阿托伐他汀的大鼠中,给予CoQ10可缓解肌病发展和ATP的减少[39]。尽管添加CoQ10可抑制西立伐他汀诱导的成肌细胞中肌节α-辅肌动蛋白降解,但骨骼肌收缩力仍然下降,表明CoQ10不足以克服他汀对甲羟戊酸途径的影响[40]。另有部分研究认为,SAMS可能与机体内总胆固醇和CoQ10水平无关,但可能与蛋白质异戊二烯化,尤其是N-连接糖基化的减少有关[41]。
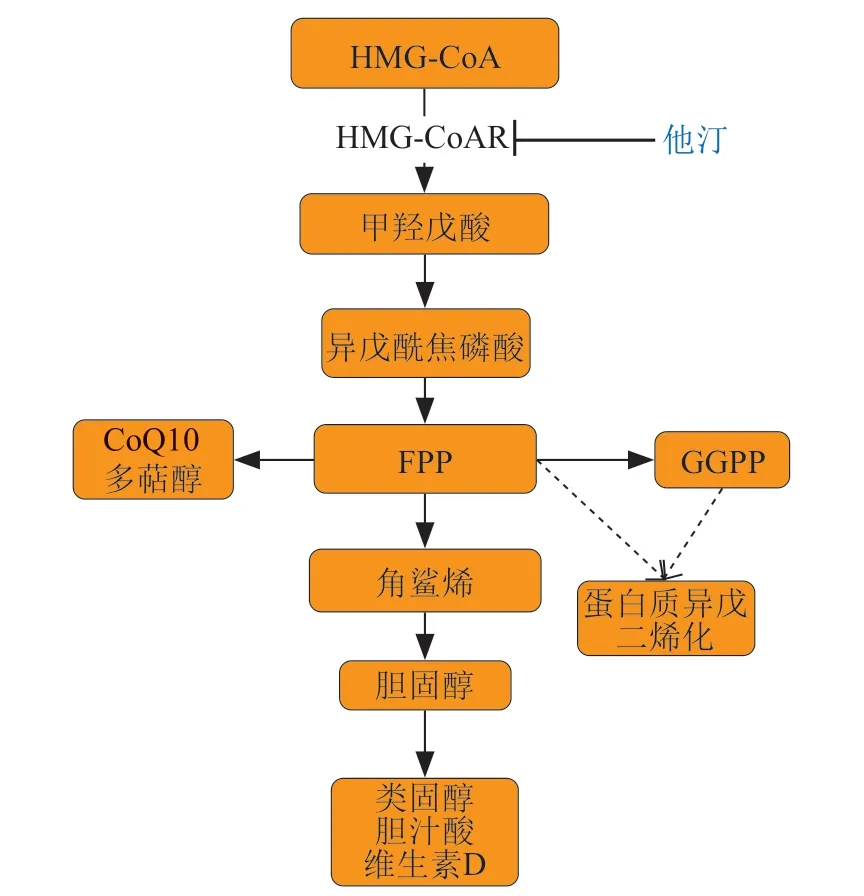
图1 胆固醇的生物合成通路Figure 1 Biosynthesis pathway of cholesterol
总之,他汀抑制HMG-CoAR,导致下游的甲羟戊酸途径合成产物减少,诱导细胞凋亡和(或)蛋白水解,引起肌肉萎缩,这可能与蛋白质异戊二烯化的减少有关。
3.2 抑制线粒体的代谢
线粒体是物质氧化还原反应的场所,负责为机体活动提供能量。研究显示,西立伐他汀、氟伐他汀、辛伐他汀和阿托伐他汀与大鼠的肌细胞和L6成肌细胞共培养,均能够降低线粒体呼吸、脂肪酸氧化和膜电位能力,增加线粒体肿胀和细胞色素C释放到肌浆,认为抑制线粒体呼吸的原因是抑制电子传递链以及氧化磷酸化的解偶联[42]。在C2C12 肌管中,辛伐他汀可降低线粒体膜电位和氧耗[43]。辛伐他汀可通过抑制复合物Ⅲ,增加线粒体O2-的产生[44]。西立伐他汀、匹伐他汀、洛伐他汀等酸和内酯形式均可以降低C2C12细胞的基础氧消耗率,以及复合物Ⅰ、复合物Ⅲ和甘油-3-磷酸脱氢酶驱动的最大呼吸,同时减少ATP产生;他汀通过直接与复合物Ⅲ的Qo位点结合,抑制泛醇、细胞色素C氧化还原酶活性和复合物Ⅲ驱动的呼吸作用,其中内酯形式他汀对线粒体的抑制效果强于酸式他汀[21]。在接受阿托伐他汀的大鼠跖肌中发现,线粒体DNA、细胞色素氧化酶1、核呼吸因子1表达降低,线粒体最大呼吸减少;此外,ROS增加,而超氧化物歧化酶(superoxidedismutase,SOD)和还原型谷胱甘肽减少;槲皮素可以消耗ROS,降低肌肉毒性[45]。在人骨骼肌纤维中,辛伐他汀可增强Ca2+浓度,这与Ca2+通过线粒体通透性转换孔(mitochondrial permeability transition pore,mPTP)和Na+-Ca2+交换(Na+-Ca2+exchange,NCE)通道释放有关;GGPP、FPP、甲羟戊酸或SOD模拟物不能抑制辛伐他汀诱导的Ca2+增加,这表明mPTP和NCE 通道的开放是由线粒体膜电位降低和线粒体内膜去极化引起[46]。
综上所述,他汀可与复合物Ⅰ和Ⅲ结合,抑制线粒体电子传递链,降低ATP和线粒体膜电位,并增强ROS产生。由于线粒体膜电位的降低,mPTP和NCE通道打开,Ca2+电流增加。同时,肌细胞中ATP的减少可能影响ATP结合盒家族(MDR1和BCRP)外排膜转运蛋白的活性,有利于他汀积聚到肌细胞中。
3.3 促进细胞凋亡
他汀可通过诱导线粒体损伤或抑制Ras同源基因家族成员A(Ras homolog gene family member A,RhoA)/ 蛋白激酶B(protein kinase B,AKT)级联反应这2种机制诱导细胞凋亡。例如,他汀可通过降低线粒体膜电位,打开mPTP 通道,使细胞色素C从线粒体膜间隙释放到肌浆中[42],随后激活Caspase9 和Caspase3,进而诱导肌管细胞凋亡[44]。阿托伐他汀可增强大鼠的糖酵解骨骼肌中氧化应激能力,升高Bax/Bcl-2比值,增加Caspase3活性,进而诱导细胞凋亡[47]。在接受辛伐他汀的小鼠肌肉中,RhoA 和AKT磷酸化减少,因此随着凋亡级联的激活,Caspase9和Caspase3的剪切也增加[48]。在C2C12肌管中,辛伐他汀通过胰岛素生长因子-1(insulin-likegrowth factor-1,IGF-1)阻 止AKT T308磷酸化;添加IGF-1可抑制肌肉萎缩和细胞凋亡,促进蛋白质合成[49]。
3.4 激活泛素-蛋白酶体系统
已有大量动物研究表明,由不同刺激引起的肌肉萎缩均伴随着由泛素-蛋白酶体系统(ubiquitinproteasome system,UPS)[50]和自噬[51]激活引起的蛋白质降解。在几乎所有类型的肌肉萎缩中,肌肉环状指基因1(muscle-specific ring-finger 1,MuRF1)和肌肉萎缩盒F基因(muscleatrophy F-Box,MAFbx/atrogin-1)的表达均明显升高[52]。肌肉的生长或萎缩主要取决于磷脂酰肌醇3-激酶(phosphoinositide3-kinase,PI3K)-AKT-哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路的活性[53]。在肌肉中,PI3KAKT信号通过抑制叉头盒蛋白(FoxO,forkhead box protein)转录因子来促进蛋白质积累,控制自噬程序的表达[54]。PI3K-AKT-mTOR 通路还会激活过氧化物酶体增殖物激活受体γ 共激活因子-1α(peroxisomeproliferator-activated receptor-γ cofactor 1α,PGC-1α),促进线粒体的生物合成和氧化代谢。然而,在肌肉萎缩期间,PI3K-AKT-mTOR 信号传导减少,因此蛋白质合成减少;同时FoxO3 被激活,通过触发UPS和自噬引起蛋白水解[51]。蛋白质降解加快以及蛋白质合成减少是引起肌肉萎缩的主要原因,而不同类型的肌肉消耗都是通过FoxO介导的肌肉萎缩相关基因的激活和PI3K-AKT-mTOR 通路信号传导减弱这同一途径。
研究显示,辛伐他汀可减少大鼠肌浆中磷酸化的AKT、FoxO1和FoxO3,并增加核组分中的FoxO1和FoxO3表 达;同时,诱导MAFbx和MuRF-1mRNA 的表达升高,肌纤维坏死和血清CK 升高[55]。在C2C12肌管中,洛伐他汀、辛伐他汀等能够降低AKT 和FoxO3Ser253磷酸化,增加MAFbx表达,进而诱导肌肉萎缩;而过表达的PGC-1α 可防止洛伐他汀诱导的肌肉萎缩[56]。辛伐他汀可损害线粒体电子传递链并降低ATP的浓度,随后激活能量传感器AMP依赖的蛋白激酶(adenosine5'-monophosphate-activated protein kinase,AMPK),诱导FoxO3a Ser588磷酸化,激活其核转位,并增强atrogin-1的表达[57-58]。
综上所述,他汀可以通过减少AKT 活化和FoxO3Ser253磷酸化,或者增强AMPK Thr172和FoxO3Ser588磷酸化、FoxO3Ser588的核转位,诱导MAFbx和MuRF-1的表达升高,最终引起肌病。
3.5 其他
在非常罕见的情况下,接受他汀治疗的患者会出现他汀诱导的自身免疫性肌病(statin-induced autoimmune myopathy,SIAM)。SIAM 发生率为2~3例每10万名患者,50岁以上患者患病风险较高[59]。这种疾病的特征是对称性近端肌无力,肌肉活检时可见肌细胞坏死以及HMG-CoAR 的自身抗体[60]。HMG-CoAR 自身免疫发展的潜在机制尚不清楚。目前有一些假设模型:1)Ⅱ类HLA 等位基因DRB1*11:01与抗HMG-CoAR 自身抗体的发展密切相关,且可能存在人种差异,白人患者和黑人患者在未接触他汀时,自身免疫性肌病与正常者DRB1*11:01的比值比分别为25和57[61-62];2)大多数组织中HMG-CoAR 表达较低,但当暴露于他汀时,肌肉和其他类型的细胞HMG-CoAR 的表达会显著增加[63];3)再生肌细胞中高表达的HMGCoAR 蛋白是正常肌细胞分化所必需[64]。因此,在遗传易感患者中,他汀诱导HMG-CoAR 过表达可能引起针对HMG-CoAR 的自身免疫性肌病。
4 他汀相关肌肉症状的防治方法
他汀肌肉毒性的防治方案包括改变用药剂量、持续时间、使用方案(每日1次改为每周2次),或者使用其他降脂类药物替代,以及给予营养物或补充治疗[65]。
PGx 是一个相对新的研究领域,旨在破译个体的基因构成与药物反应之间的关系,通过使用患者遗传信息预测药物反应和预防药物不良反应。SLCO1B1基因的PGx 检测可以为他汀治疗剂量等提供临床建议[66]。临床药物基因组学实施联盟(The Clinical Pharmacogenetics Implementation Consortium,CPIC)针对SLCO1B1基因多态性,对辛伐他汀的给药剂量提出如下建议:如果存在SLCO1B1的正常功能酶(TT),建议以正常起始剂量给予辛伐他汀;如果患者出现SLCO1B1的中效或低功能酶(TC或CC),则建议考虑降低辛伐他汀剂量或改用替代的他汀[67]。因此,利用SLCO1B1基因分型可以帮助医生决定哪种他汀最适合患者。对于因过早停用他汀而失去心脑血管疾病收益的患者来说,根据患者自身的基因差异选择合适的调整剂量或替代的他汀至关重要。
一项研究纳入了10180例患者,随机盲法给予患者阿托伐他汀(50%)和安慰剂(50%),发现阿托伐他汀治疗组和安慰剂组SAMS的年发生率无明显差异[298例(2.03%)]vs283例(2.00%)];反而在非随机非盲阶段,当患者知道自己正在使用他汀时,他汀治疗组SAMS 的年发生率有升高趋势[68]。考虑可能是因为患者对于他汀肌肉反应的负面期望,使得出现反安慰剂效应。另外,在患者服药期间应该尽量避免出现因这种反安慰剂效应引起的停药。当患者肌肉疼痛和(或)CK 升高时,对于症状轻微的患者必须降低他汀剂量,其症状更严重则必须停药。当肌痛症状缓解并且CK 正常化时,可以考虑重新暴露他汀。一项包括107835例患者的研究显示,大多数患者(92.2%)在停止一种他汀治疗后,可以再次接受新的或更高剂量的他汀,并可耐受至少12个月[69]。这证实了他汀的肌肉毒性是可逆的,大部分患者在停药后或者更换其他种他汀后肌肉毒性可以逐渐缓解。在这些情况下,建议使用普伐他汀或氟伐他汀,尽管这2种药物在降低低密度脂蛋白胆固醇(low density lipoprotein,LDL)方面效果较差,但是发生SAMS的概率较低已是共识。不能耐受任何他汀的患者可使用依泽替米贝和(或)胆汁酸螯合剂作为替代药物。如果LDL 水平没有明显改善,可以合并使用前蛋白转化酶枯草溶菌素9型(proprotein convertasesubtilisin/kexin type 9,PCSK9)抑制剂[70]。对于自身免疫性肌病患者,如果症状非常轻微,可以停止他汀治疗并注意密切观察;在肌肉疾病无法改善或继续恶化时,可尝试免疫抑制剂治疗方案[60]。
目前,关于他汀给予营养物补充治疗,使用最广泛的处方是补充CoQ10和VD。他汀可抑制HMG-CoAR,会减少甲羟戊酸下游产物VD的前体7-脱氢胆固醇的合成。VD可能通过激活维生素D受体(VDreceptor,VDR)-视黄醇类X 受体(retinoid X receptor,RXR)异二聚体,从而上调OATP1B1的表达,影响OATP1B1对他汀的转运。当VD缺乏时,OATP1B1表达减少,导致他汀血药浓度异常升高;另外VD是多种CYP酶的诱导剂,当其体内处于缺乏状态时,可能导致他汀体内暴露增加,使SAMS发生风险增加[71]。在146例患有肌痛、肌炎、肌病或肌坏死的患者中,VD补充剂(每周50000~100000U)可以安全地解决与低血清VD相关的他汀不耐受现象[72]。CoQ10 参与线粒体中的电子传递,具有抗氧化作用,被认为在骨骼肌的能量转移中起重要作用。目前,临床上关于补充CoQ10能否缓解肌肉毒性仍存在争议[73]。某些营养保健品,如红曲、佛手柑、小檗碱、朝鲜蓟、可溶性纤维、植物甾醇和甾烷醇在单独或与依泽替米贝结合使用时,可以使LDL 降低10%,改善内皮功能障碍和动脉粥样硬化,尽管这些保健品在心血管疾病预防和治疗方面的长期安全性和有效性证据不足,但其可作为他汀的替代疗法或附加疗法[74]。
5 结语
综上所述,他汀进入体内,在血液中累积,一方面直接抑制HMG-CoAR,减少下游甲羟戊酸途径的合成,导致下游胆固醇、CoQ10以及蛋白质异戊二烯化减少。另一方面进入细胞内,抑制线粒体的氧化呼吸,使Ca2+外泄,激活Caspase家族,导致细胞凋亡;抑制PI3K-AKT-MTOR 途径,上调AMPK 磷酸化,FoxO3出现核异位,最终诱导调节蛋白质生物合成的蛋白PGC-1ɑ 合成减少,控制蛋白质水解的泛素连接酶MAFbx/MuRF1合成增多,蛋白质降解损伤肌肉结构,进而产生SAMS。临床上对于他汀的肌肉毒性,除了患者主动报告疼痛和检测血清CK 值外,尚未建立明确的检测指标。SAMS受患者的基因、年龄、性别等因素影响,具有很大的个体差异,具体用药时应该充分考虑个人用药史,对于高危病人可以检测SLCO1B1基因型,选择合适的他汀种类及剂量,做到个体化治疗。
为了他汀的安全用药,将他汀不耐受反应控制在最小范围内,应提前与患者沟通药物情况,说明不良反应发生的概率极低以降低反安慰剂效应;劝诫患者戒烟酒,保持良好的生活习惯。同时紧密监测患者的血清谷丙转氨酶(alanine aminotransferase,ALT)、AST、CK 水平,并及时注意患者反馈,根据临床情况调整用药方案,以减少药物不良反应。当患者出现肌痛之后,应及时减小剂量,或停药并替换为其他降脂药物。同时可考虑VD、植物甾醇、红曲等营养补充疗法。对于自身免疫性肌病,必要时应该采取合理的免疫治疗。最后,为了改善对于SAMS的管理,迫切需要更多随机对照试验和临床结果,以便更好地确定最佳治疗策略。
