铂类抗肿瘤配合物的研究进展
2020-05-29朱阳程珺洁刘扬中
朱阳,程珺洁,刘扬中
(中国科学技术大学化学与材料科学学院,安徽 合肥 230026)
癌症是一种严重危害人类健康和生命的疾病,其临床表现有多样性、易扩散性和转移性等特点。近年来,全球癌症发病率与死亡率呈持续上升趋势。化疗是目前癌症治疗中最常用且最有效的手段之一,其中铂类配合物因抗癌谱广、疗效显著,被广泛用于临床研究。
作为最早的金属抗癌药物,顺铂(cisplatin)于1978年被美国食品和药品管理局(FDA)批准用于肿瘤化疗。迄今为止,顺铂仍然是化疗效果最好的几种药物之一,其对睾丸癌的治愈率高达95%[1]。然而,顺铂的肾毒性、神经毒性、耳毒性以及骨髓抑制等毒副作用,以及不同肿瘤产生的固有耐药性或获得耐药性[2-3],极大地限制了其临床应用。为了克服顺铂的毒副作用及耐药性,并进一步提高铂类药物的抗癌活性,在过去的40年里,大量的新型铂类化合物被合成出来用以尝试改善顺铂的不足,但实际进入临床试验的药物仅数十种[4]。近年来,美国国立卫生研究院(National Institutesof Health,NIH)列出了180 个国家约18600 例临床试验病例。但最终得到上市批准的仅有5种。其中第2代的卡铂(carboplatin)和第3 代的奥沙利铂(oxaliplatin)相继被FDA 批准,乐铂(lobaplatin)、奈达铂(nedaplatin)和依铂(heptaplatin)分别在中国、日本以及韩国上市[5-6](见表1)。鉴于铂类药物在临床上显著的抗癌效果,其作用机制目前仍被持续广泛关注。本文总结并探讨一些代表性铂(Ⅱ)和铂(Ⅳ)配合物的设计合成、抗肿瘤活性以及作用机制[7-10],以期对今后新型铂类药物的研究有所裨益。

表 1 临床中使用的铂类抗癌药物Table1 Platinum anticancer drugs clinically used
1 铂(Ⅱ)配合物
顺铂是铂(Ⅱ)配合物的典型代表。顺铂及其类似结构的铂(Ⅱ)配合物,具有保留基团和离去基团2种配体[6]。保留基团一般为N 配体,能够与Pt 形成热力学稳定的配位键。对保留基团的修饰会直接影响铂(Ⅱ)配合物与DNA 的结合效率[11]。离去基团包括单配位型阴离子配体和螯合型双阴离子配体,两者在化学反应中容易被取代,因此称为离去基团。铂(Ⅱ)配合物的水合作用及其与DNA反应的动力学活性,甚至化学计量比,都会因离去基团的改变而受到影响[12]。以顺铂为例,铂(Ⅱ)配合物的抗癌机制主要包含以下3个步骤[13]:
1)细胞的摄取。顺铂主要通过被动扩散和膜蛋白的主动运输被细胞吸收[14]。由于顺铂的尺寸较小,且具有电中性的平面结构,在很长一段时间内被认为是通过被动扩散进入细胞[15-16]。有研究发现与顺铂结构类似的化合物也不会抑制细胞对药物的摄取[6],表明铂类化合物可以有效地被细胞摄取进而发挥其功能。近年来,大量的研究表明,膜蛋白对于顺铂的细胞摄取具有重要作用。例如,顺铂的摄取量与铜转运蛋白hCtr1的表达水平密切相关[17-18],hCtr1的低表达可以降低细胞对药物的摄取从而导致细胞耐药。
2)水合作用与抗癌活性的激活。铂类配合物中离去基团的配位取代以及DNA 的配位结合效率对药物的活性而言至关重要。在顺铂与DNA 作用之前,氯离子作为离去基团被水置换。由于氯离子在血液中的浓度(~100mmol · L-1)显著高于细胞质中的浓度(~10mmol · L-1),当顺铂进入细胞后,氯离子浓度的降低促使顺铂发生水解作用。所形成的水合产物(cis-[Pt(NH3)2Cl(H2O)]+、cis-[Pt(NH3)2(H2O)2]2+)带有正电荷[19],因而易于与带有负电荷的DNA 发生静电作用从而发生配位取代。因此,顺铂的水合过程也是其活化过程。
3)DNA 的结合与损伤。DNA 通常被认为是铂类药物的作用靶点。顺铂水解后,其配位的水分子被DNA 碱基置换。一般而言,顺铂优先与DNA 的腺嘌呤和鸟嘌呤残基上的N7原子作用[20],以链内的d(GpG)交联为主,少数会发生d(ApG)链内交联[21]。交联将抑制DNA 转录,从而诱导细胞凋亡[22]。需要指出的是,尽管大量研究结果已证实核DNA 是铂类配合物的功能靶点,但铂类配合物与蛋白质和RNA 之间的作用同样不容忽视[23-26]。
然而,顺铂的毒副作用和耐药性极大地限制了其临床应用[27]。因此,科研工作者们通过对保留基团与离去基团的合理设计,得到大量新型铂(Ⅱ)配合物,并检测了其抗癌活性。
1.1 具有靶向配体的铂(Ⅱ)配合物
提高药物的靶向性有望减少顺铂及其类似物的毒副作用[6],增加肿瘤细胞对药物的摄取量,提高对肿瘤的治疗效果[28]。
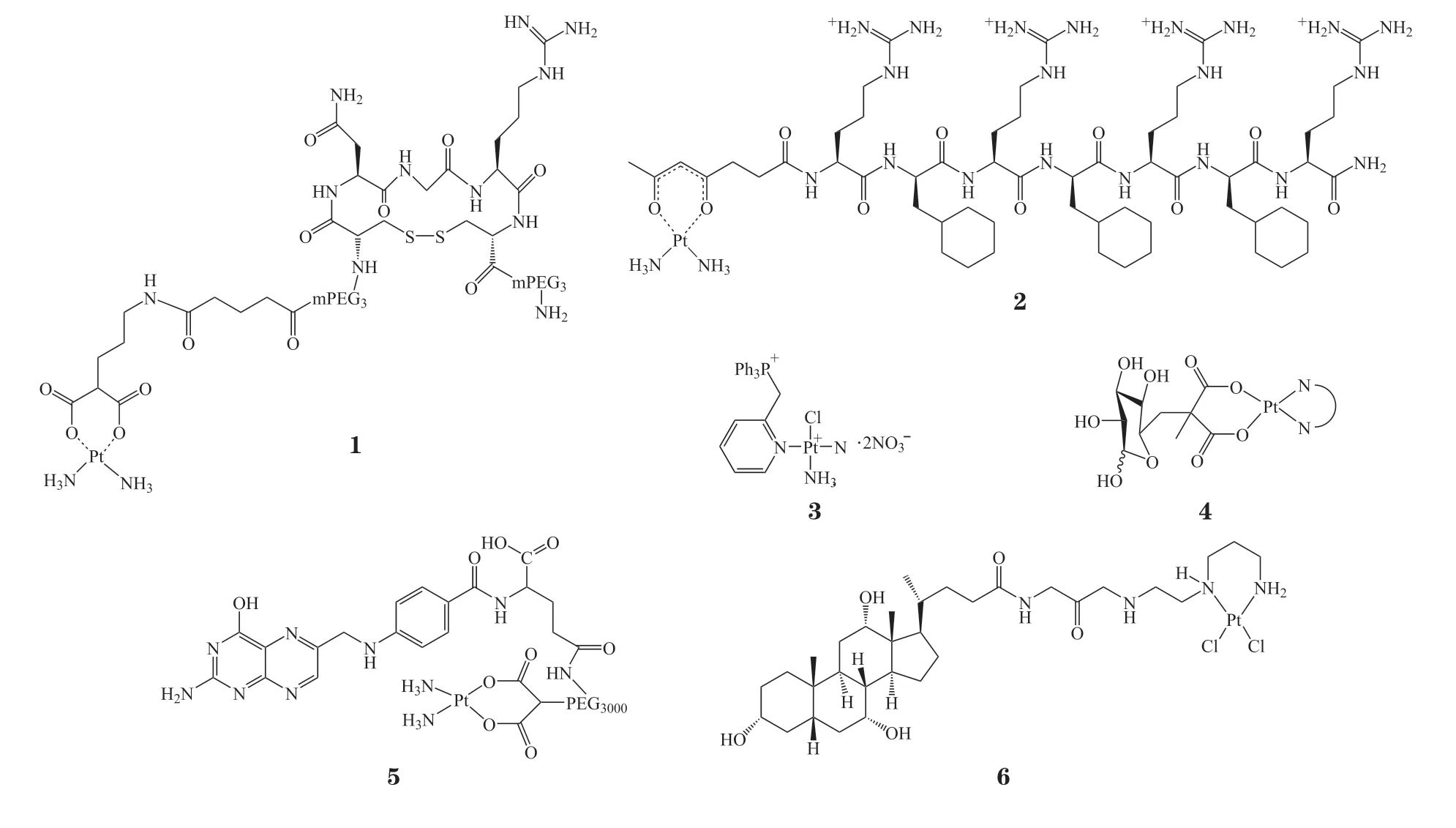
多肽因其体积小、免疫原性低、稳定性高、成本低廉等优势,被广泛用作靶向配体。例如,NGR肽单元(Asn-Gly-Arg)通过结合到细胞表面抗原CD13(氨肽酶N)上以特异性靶向乳腺癌细胞[29]。将NGR 作为配体合成的化合物1对于CD13受体过表达的细胞具有良好的选择性[30],实验结果显示肿瘤细胞对于该化合物的摄取量是卡铂的8 倍。线粒体在参与细胞的代谢、能量转换以及凋亡进程中扮演重要角色[31]。其中能量转换是线粒体中调节细胞内能量平衡最重要的功能[32-33]。因此,直接靶向线粒体有望进一步提高药物的抗肿瘤活性。结合线粒体穿透肽(MPPs)设计的靶向化合物2能够将药物特异性释放于线粒体中而不会损伤核DNA[34]。研究显示,配合物2 对A2780 细胞的IC50为(7.5±0.3)μmol · L-1,且抗癌活性不受耐药株的影响。与之类似,三苯基膦(TPP)是一种阳离子化合物,能够靶向线粒体。利用三苯基膦的靶向作用合成的化合物3 可将铂(Ⅱ)配合物定位于线粒体中,其对A549细胞的毒性强于顺铂,IC50仅为(8.7±1.6)μmol · L-1;同时,该化合物对正常肝细胞HL-7702的IC50为(64.5±3.2)μmol · L-1,远高于顺铂[(14.8±2.3)μmol · L-1]。
肿瘤细胞由于其特殊的代谢途径,需要大量摄入葡萄糖。对以葡萄糖为配体的奥沙利铂衍生物(4)的研究发现,该配合物在肿瘤区域能被有效摄取。配合物4 对A2780 细胞的IC50低至0.15μmol · L-1[35]。用葡萄糖转运体抑制剂处理后,细胞对该化合物的摄取量下降了51%,证明了葡萄糖配体的重要性。类似地,叶酸受体在多种癌细胞中也存在过表达的现象[36]。将聚乙二醇(PEG)化的叶酸作为配体得到的卡铂类似物(5),不仅靶向性强,血液循环时间也有所增加。研究表明,作用20h 后,化合物5的细胞摄取量约为卡铂的1.5倍。胆汁酸广泛存在于胆汁中,肝脏上皮细胞过表达大量的转运蛋白进而从血液中吸收胆汁盐,因此将胆汁酸结合到铂(Ⅱ)配合物上可以实现对肝癌的靶向治疗[37]。鉴于这一思路,研究人员制备了胆汁酸配位的铂(Ⅱ)配合物(6)[38]。尽管与顺铂相比,化合物6抑制癌细胞生长的活性较弱,但其提高了肝脏对药物的摄取,降低了原药的毒副作用。
1.2 其他功能配体的铂(Ⅱ)配合物
对于多数恶性肿瘤而言,单一治疗方式往往达不到理想的疗效。联合治疗有望发挥协同作用,增强治疗效果,同时降低药物的毒副作用。
光动力治疗(PDT)是一种通过特定波长的光诱导光动力试剂产生活性氧,从而杀死肿瘤细胞的方法[39]。相比传统治疗而言,PDT能够实现时间和空间上的可控性[40],在癌症治疗中具有一定的优势。卟啉和异卟啉是一类被美国FDA 批准的光动力治疗试剂,因其卓越的光物理性能以及对恶性组织的选择性而被广泛应用。通过化学键修饰在卟啉上螯合顺铂,有望实现光疗与化疗的协同作用[41],具有潜在的生物医学应用价值[42-45]。例如一类通过光诱导肿瘤消融的卟啉铂(7~10)[42],具有优越的抗肿瘤效果,并能够通过时空上的可控性,有效降低铂类配合物的毒副作用。以化合物9和10处理多种癌细胞,光照之后,两者对癌细胞的IC50都远远低于顺铂,均低于0.1mol · L-1;细胞摄取实验结果显示99.5%的化合物10分布在细胞核中。此外,研究人员还设计了一种近红外光激发的双联吡啶铂(11)用于肿瘤的诊断和治疗[46-47]。与顺铂相比,化合物11 在接受近红外激光照射后,抗肿瘤效果明显提高,并展现出优异的红外成像性能。
1.3 非经典的铂(Ⅱ)配合物
早期的构效关系研究表明,具有抗肿瘤活性的铂配合物在结构上具有一些共性,这类化合物被称为经典的抗肿瘤铂配合物。近年来的研究发现,一些非经典构效关系的铂配合物也表现出较好的抗肿瘤活性。在过去的几十年里,多种非经典铂配合物被设计合成,包括多核铂[48-52]、反式铂[49,53-55]、单功能铂等。这些化合物具有区别于顺铂等经典铂配合物的作用机制,在DNA 结合方式、蛋白质的反应选择性、反应动力学、产物的组成等方面表现出不同的特性,因而有望克服经典铂配合物的不足。
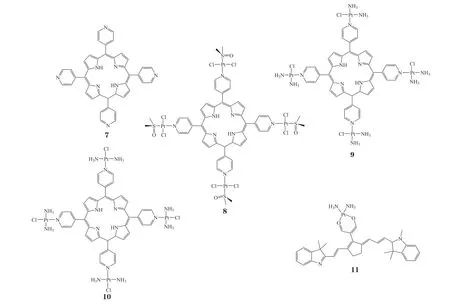
多核铂配合物的分子内具有2个或以上的铂原子,这类铂配合物可以通过非共价(静电、氢键)作用结合DNA。与传统的铂类化合物相比,三核铂具有更强的DNA 聚集能力,而且能够有效抑制DNA的转录以及抑制超螺旋DNA 中的拓扑异构酶-Ⅰ介导的弛豫。研究发现一些三核铂(12~ 14)具有聚集核酸和抑制酶活性的功能[54]。其中化合物14 的EC50(缩合剂在缩合中点的浓度)[(0.15±0.01)μmol · L-1]约为精胺[(4.1±0.5)μmol · L-1]的1/27。
在铂类化合物的早期研究中,研究人员发现,顺铂的反式异构体(trans-DDP)没有抗癌活性,因此当时认为顺式构象是铂化合物具有抗癌活性的必要条件。但后来发现,trans-DDP的一些类似物具有抗癌活性。这不仅推翻了过去的构效关系理论,同时也促进了反式铂化合物的研究。此外,反式铂化合物对一些顺铂耐药细胞具有更好的细胞毒性,如表2 所示[56]。对此,笔者课题组近年来研究了反式铂和顺铂与蛋白质或DNA 的作用机制[57-59]。实验结果显示,反式铂与顺铂对蛋白质具有不同的反应活性和选择性。
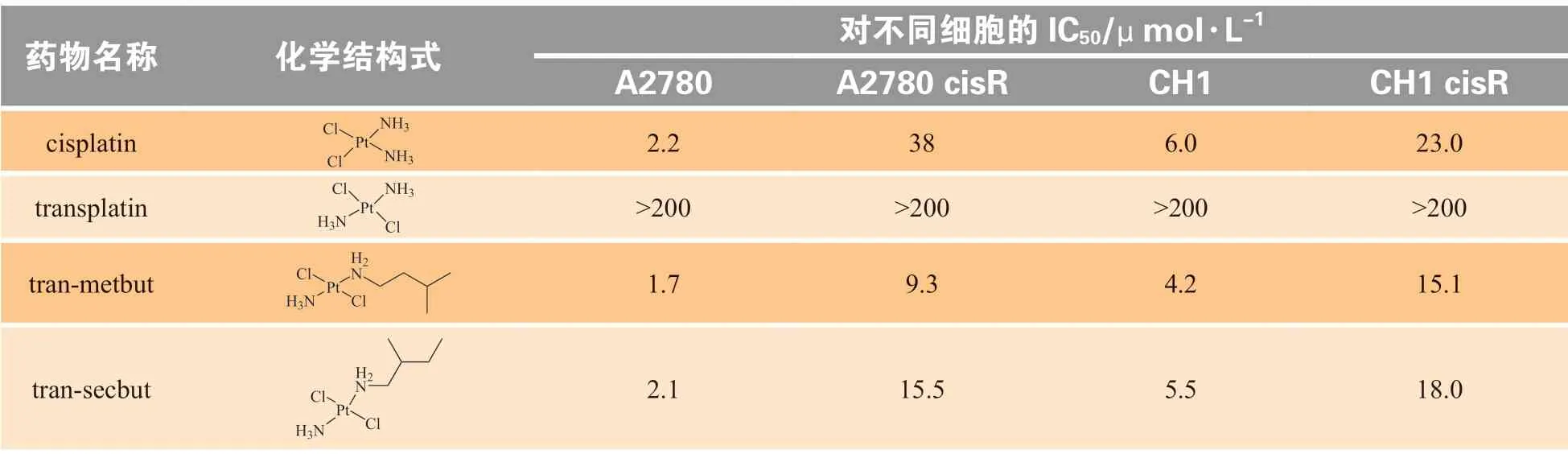
表2 反式铂化合物对耐药细胞的毒性[56]Table2 The toxicity of trans-platinumtodrug-resistant cells
2 铂(Ⅳ)配合物
铂(Ⅳ)配合物在进入细胞后,能够被细胞内的还原物质(如谷胱甘肽等)还原,释放顺铂、卡铂、奥沙利铂等铂(Ⅱ)配合物,因而被称作前药。不同于铂(Ⅱ)配合物的平面四边形结构,铂(Ⅳ)配合物是6 配位的八面体几何构型。因此与铂(Ⅱ)配合物相比,增加了化学修饰的可能性,同时更便于调节其生物化学性能。还原激活后,铂(Ⅳ)配合物转变为铂(Ⅱ)配合物[60],配体随之离开,发挥一系列生物活性功能。因此,与铂(Ⅱ)配合物相比,铂(Ⅳ)配合物具有一些明显的优势:1)良好的稳定性;2)与血浆中蛋白质的副反应少;3)易修饰以增加生物活性。目前已有若干铂(Ⅳ)配合物(15~18)进入临床试验阶段[61-64]。
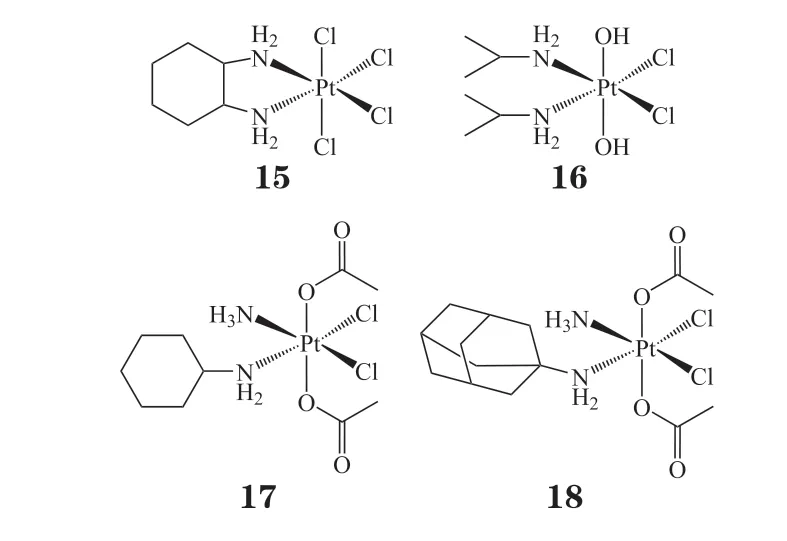
2.1 具有靶向配体的铂(Ⅳ)配合物
与铂(Ⅱ)配合物类似,提高靶向性同样能够增加铂(Ⅳ)配合物的细胞毒性,且因铂(Ⅳ)配合物更容易利用轴向配位修饰配体,使得靶向基团的引入更加便捷。
氯离子通道蛋白在多种肿瘤细胞膜上过表达,基质金属蛋白酶-2(MMP-2)在肿瘤的侵袭转移中起重要作用[65],两者都具有成为癌症治疗靶点的潜在价值。氯毒素由36个氨基酸组成,能够与氯离子通道蛋白和MMP-2 键合[66],从而抑制它们的活性。结合以上研究基础,研究人员开始尝试将氯毒素作为靶向配体应用于肿瘤治疗,合成了氯毒素-铂(Ⅳ)配合物(19)。细胞毒性结果显示,化合物19对HeLa 细胞的IC50为顺铂的4.3倍,未修饰氯毒素的铂(Ⅳ)配合物的IC50为顺铂的200 倍,表明氯毒素的修饰显著提高了铂(Ⅳ)配合物的细胞毒性。

基于瓦尔堡效应,葡萄糖受体在肿瘤细胞中大量过表达[67]。化合物20是首次报道的一类糖类铂(Ⅳ)配合物之一。研究发现,化合物20的细胞摄取量分别是奥沙利铂和顺铂的2.8和7.9倍;DNA 铂化量分别是奥沙利铂和顺铂的3.6 和3.1 倍。流式细胞分析结果表明化合物20能够有效促使肿瘤细胞进入停滞期,并诱导细胞凋亡,其体内抗肿瘤活性更是能达到奥沙利铂的4倍之高[68]。维生素是一种细胞生长促进剂,并在细胞信号通路以及基因调节中扮演着重要角色[69]。与维生素相关的多种受体普遍在肿瘤细胞表面过表达[70]。近年来,已有报道证实多种维生素(如维生素H、维生素B7)在肿瘤细胞中的摄取量明显高于正常细胞[71]。因此,将维生素作为铂(Ⅳ)配体有望得到潜在的靶向抗癌化合物,如用作靶向细胞生长抑制剂的生物素铂(21~22)[72]。研究结果显示,化合物21和22在乳腺癌MCF-7细胞中的细胞摄取量分别是顺铂的1.5和1.8倍;在乳腺癌MDA-MB-231细胞中,细胞摄取量分别是顺铂的2.2和2.7倍;而在正常乳腺上皮细胞MCF-10A/vector 中的细胞摄取量仅为顺铂的2/5和1/2。在72h 的细胞毒性实验中,化合物21对乳腺癌细胞的IC50(MCF-7:10μmol · L-1;MDA-MB-231:12μmol·L-1)与顺铂相当(MCF-7:9μmol · L-1)或更低(MDA-MB-231:40μmol · L-1);但对正常乳腺上皮细胞MCF-10A/vector 的IC50(30 μmol · L-1)则明显高于顺铂(7μmol · L-1)。
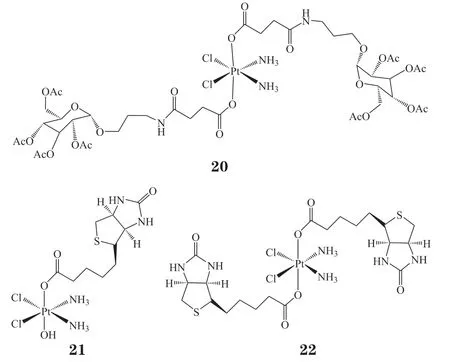
2.2 以临床药物为配体的铂(Ⅳ)配合物
阿司匹林是一种应用广泛的非甾体类药物,通过抑制环氧化酶1(COX-1)和环氧化酶2(COX-2)的活性发挥退热、镇痛以及抗炎的作用。尽管目前阿司匹林的抗癌机制并不明确,但已有研究提出其能够调节抗凋亡基因Cox-2和Bcl-2的表达并参与抑制血小板的激活[73]。此外,阿司匹林还能够减少顺铂所产生的副作用,例如耳毒性和肾毒性[74]。笔者课题组在2012年设计合成了阿司匹林铂(23),之后与其他课题组相继报道了相关研究结果[75-76]。结果显示,在HeLa 细胞中,化合物23的细胞摄取量分别是顺铂的3.2倍和oxoplatin(24)的8.4 倍,DNA 铂化量是顺铂的2.2倍和oxoplatin 的8.3倍(见图1);诱导细胞凋亡的比例(43.76%)为顺铂(13.7%)的3.2 倍和oxoplatin(8.03%)的5.4 倍。此外,在HeLa 细胞中,化合物23的IC50仅为顺铂的1/10(0.45μmol · L-1/4.51μmol · L-1);在MCF-7、HepG2、A549细胞和A549顺铂耐药细胞中该比例分别为1/3.26、1/5.56、1/1.13和1/5.48,可见其优越的抗肿瘤活性。荷瘤小鼠实验结果显示,在0.5和2mg · kg-1剂量下,化合物23实验组小鼠肿瘤体积和肿瘤质量均小于顺铂实验组,相对体质量(治疗后与治疗前体质量之比)则高于顺铂实验组,表明与顺铂相比,化合物23对肿瘤生长的抑制效果更好,且毒副作用更低(见图2)。免疫组化结果显示,化合物23能够有效诱导肿瘤组织的细胞凋亡,但避免了顺铂所导致的肾脏的损伤。进一步的机制研究显示,由于非甾体抗炎药具有与肿瘤相关的作用靶点,可以通过铂类药物与非甾体抗炎药物的偶联获得协同作用,因此该研究为设计新型铂(Ⅳ)配合物提供了新的思路。
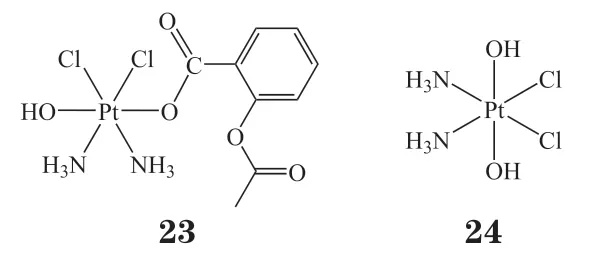
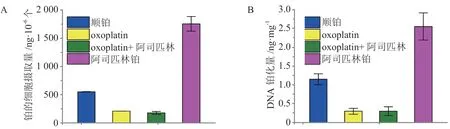
图1 阿司匹林铂、顺铂和oxoplatin的细胞摄取量(A)和DNA 铂化量(B)比较[75]Figure 1 Comparison of cellular uptake (A)and DNA platination(B) of asplatin, cisplatin and oxoplatin[75]

图2 阿司匹林铂和顺铂的抗肿瘤治疗效果比较[75]Figure2 Comparison of the anti-tumor effects of asplatin and cisplatin[75]
克服肿瘤细胞对顺铂及其类似物的耐药性是铂类药物研究的巨大挑战,其中谷胱甘肽S-转移酶(GST)是产生耐药的关键因素之一[77]。研究发现GST-π 同工酶在多种顺铂耐药细胞中过表达,抑制相关酶的活性有望逆转铂类药物的耐药[78]。利尿酸(EA)是临床常用的利尿剂,对GST 有抑制作用[79]。以EA 为配体的铂(Ⅳ)配合物(25)[80],对MCF-7细胞的毒性(IC50=32μmol · L-1)明显高于顺铂(IC50> 80μmol · L-1);其在A549细胞中的摄取量是顺铂的10倍,细胞毒性结果同样高于顺铂。丙基戊酸(VA)是临床上用于抗癫痫和抗痉挛的药物[81],是组蛋白去乙酰化酶(HADC)抑制剂[82]。组蛋白乙酰化的失衡与癌症发生密切相关,因此将VA 作为配体设计的铂(Ⅳ)配合物(26)具有良好的抗肿瘤活性;研究表明,在5mmol · L-1维生素C存在条件下,2.5mmol · L-1化合物26对HADC的抑制率达70.2%;将化合物26和oxoplatin 分别处理BCap-37细胞24h,结果显示化合物26的细胞摄取量达到126.1ng · 10-7个,是oxoplatin(4.7 ng · 10-7个)的27倍;此外,其在A549、BCap-37、SKOV-3和HepG2细胞中都表现出优越的细胞毒性(IC50分别为0.15、0.2、0.17 和0.14μmol · L-1)[83]。氯尼达明(LND)是一种抗肿瘤药物,通过抑制己糖磷酸激酶的活性杀伤肿瘤细胞[84]。有文献报道,LND能够有效提高顺铂的化疗效果[85]。利用LND作为轴向配体所设计合成的化合物27[86]对MCF、A549、U87细胞的毒性低于顺铂[IC50(μmol · L-1):9.86vs4.94、16.67vs6.48、6.07vs4.96];而对于LNCaP、HCT-116细胞,比顺铂的效果更好[IC50(μmol · L-1):6.80vs12.42、3.14vs4.13]。吲哚美辛是临床常用的抗炎药物,能够抑制COX-2 的表达。利用吲哚美辛作为轴向配体,设计合成的化合物28在HCT-116、HepG-2、PC-3和SGC7901 顺铂耐药细胞中表现出比顺铂更高的细胞毒性[87]。
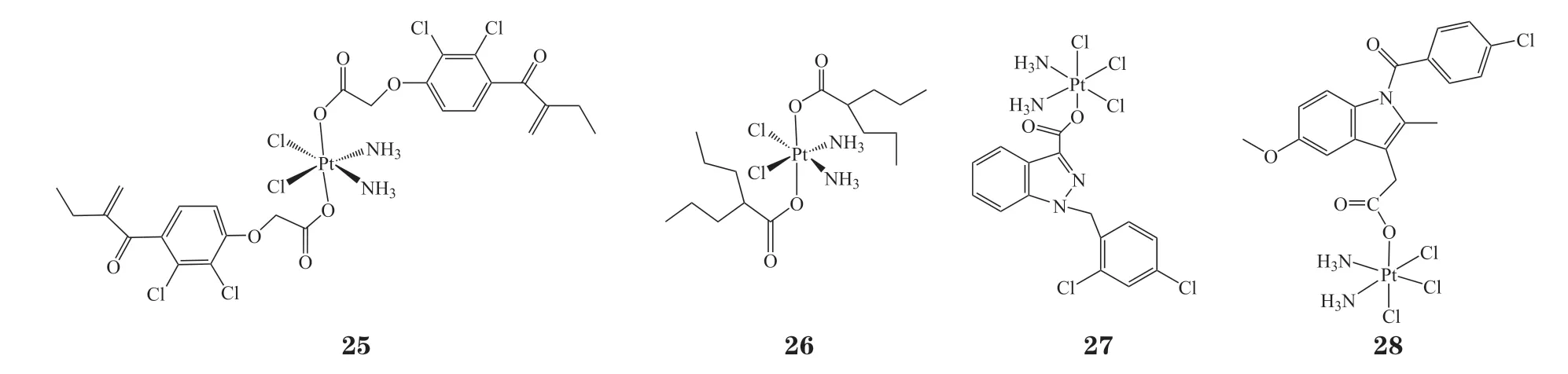
2.3 其他生物活性配体的铂(Ⅳ)化合物
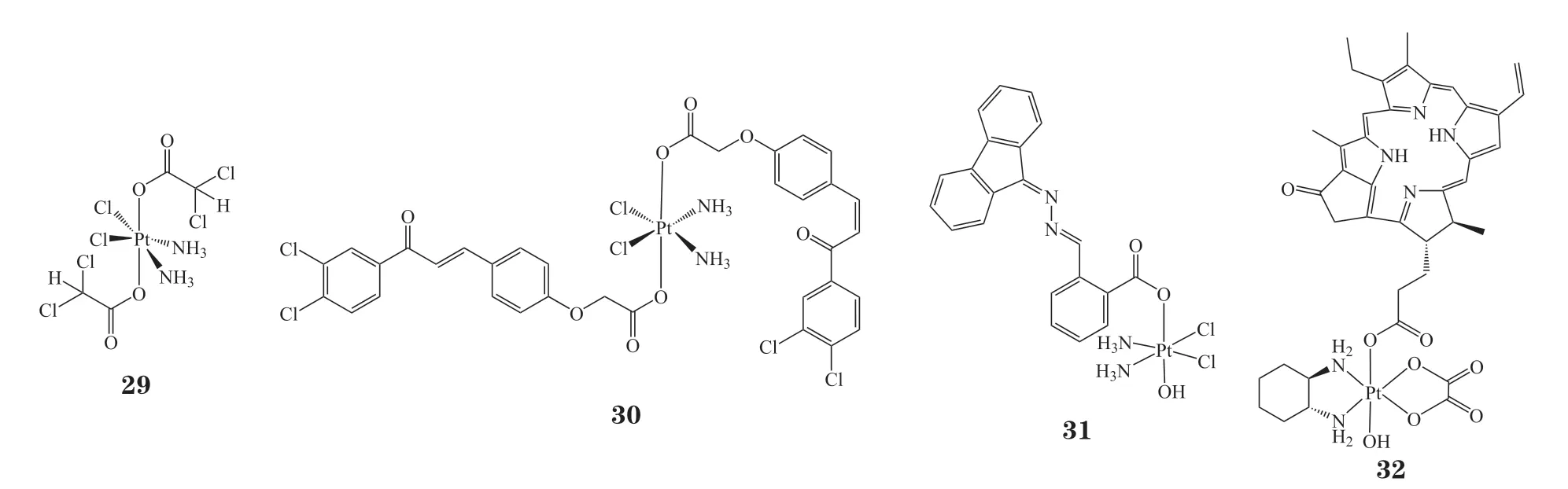
二氯乙酸盐(DCA)能够将肿瘤细胞的代谢过程从糖酵解向氧化磷酸化转化[88],同时降低线粒体膜电位,增加线粒体膜的通透性,促进肿瘤细胞的程序性坏死[89]。作用机制研究表明:DCA 结合的铂(Ⅳ)配合物(29)具有双模态杀死癌细胞的能力,既通过Pt 结合DNA 抑制转录,又通过DCA使线粒体发生紊乱释放细胞色素C[90]。P53是具有肿瘤抑制作用的重要蛋白,查尔酮能够抑制P53与其负调节蛋白(MDM2)的相互作用。以查尔酮为配体的铂(Ⅳ)配合物(30)在细胞内被还原活化后,既能够结合DNA 诱导细胞凋亡,又可以促进P53通路,增强抗肿瘤活性[91]。研究显示,化合物30 处理后的细胞,p53的表达量远高于顺铂对照组。同时,对于p53野生型HCT-116细胞,化合物30的细胞毒性(IC50=0.8μmol · L-1)是顺铂(IC50=8.3 μmol · L-1)的10 倍;而对于p53突变型HL-60 细胞,其细胞毒性仅为顺铂的1.1倍。核苷酸剪切修复(NER)是细胞中普遍存在的DNA 损伤修复模式,铂类药物对于NER 缺失的肿瘤细胞具有更高的敏感性[92]。将NER 抑制剂作为配体设计的铂(Ⅳ)配合物(31)[93]对A2780和A549细胞的毒性是顺铂的6和34 倍;而对于顺铂耐药的A2780R 和A549R 细胞,该化合物的细胞毒性是顺铂的17 和88 倍。这充分表明化合物31 能够有效克服肿瘤细胞对铂类化合物的耐药性。
2.4 其他功能配体铂(Ⅳ)配合物
与铂(Ⅱ)配合物类似,铂(Ⅳ)也能够与光敏剂结合,以实现化疗与PDT联合治疗的目的。焦脱镁叶绿素(PPA)是由叶绿素分子脱去镁离子后进一步水解而形成的化合物,因其毒性低、光敏活性强而被用于肿瘤的荧光定位和光敏治疗。PPA 与四价奥沙利铂结合的化合物32[45],在650nm 激光照射下能够高效产生单线态氧,对癌细胞的光毒性是奥沙利铂的186倍,在体内也具有显著的抗肿瘤作用。
3 结语
目前,铂类配合物虽然因毒副作用和耐药性在应用和发展上受到一定的限制,但仍是临床上使用的一线抗癌药物。因此,不断寻找和设计具有更高抗癌活性、毒副作用小、无交叉耐药性的新型铂类配合物,始终是这一领域的研究热点。作为新一代的铂类抗肿瘤药物,铂(Ⅳ)配合物近年来引起国内外研究者的广泛关注。铂(Ⅳ)配合物具有八面体的空间配位结构,既增强了配合物的惰性,降低其在体内输送过程中的毒副作用,又为结构修饰提供了便利。最近的研究表明,与单一药物治疗相比,联合疗法有望发挥协同作用,增强肿瘤的治疗效果。这一思路有望指导铂(Ⅳ)配合物取得长足的进步。此外,随着纳米生物医学的飞速发展,纳米药物的研发和临床转化取得巨大进展。Regulon 公司的顺铂脂质体项目(Lipoplatin)也已进入Ⅲ期临床研究。纳米制剂,尤其具有联合治疗或诊疗功能的纳米制剂,有望为下一代铂类药物的开发提供新的动力。
