7株米曲霉与沪酿3.042发酵制备郫县豆瓣用甜瓣子的对比研究
2020-05-29李洁芝邓维琴张其圣杨国华陈功范智义陈相杰周志帅李恒
李洁芝,邓维琴,张其圣,3,杨国华,陈功,3,范智义, 陈相杰,周志帅,李恒
(1.四川省食品发酵工业研究设计院,成都 611130;2.四川省丹丹郫县豆瓣集团股份有限公司, 成都 611732;3.四川东坡中国泡菜产业技术研究院,四川 眉山 620030; 4.成都市丹丹川菜调味品产业研究院有限公司,成都 611730)
郫县豆瓣拥有300多年的制作历史,其酱香浓郁醇厚、色泽红润油亮、瓣粒酥脆、辣而不燥,被誉为“川菜之魂”[1]。按照GB/T 20560-2006《地理标志产品 郫县豆瓣》的要求[2],蚕豆接种米曲霉后,经制曲工艺制成甜瓣子,再将甜瓣子与辣椒醅混合发酵,得到郫县豆瓣产品。由此可见,由米曲霉主导的甜瓣子发酵是郫县豆瓣生产的关键工序,米曲霉的发酵性能在很大程度上决定了郫县豆瓣产品的质量品质、生产成本和市场竞争力。目前,制曲菌种主要是沪酿3.042米曲霉,但单一使用该菌株发酵存在产生酶系不全等问题[3],现阶段国内关于米曲霉发酵郫县豆瓣的研究多集中于高酶活力米曲霉的选育鉴定、酶学特性及混菌制曲等方面[4,5],对米曲霉发酵甜瓣子的理化指标、感官指标的研究报道较少。本文对比研究了7株高产蛋白酶、α-淀粉酶的米曲霉试验菌株与沪酿3.042米曲霉制备甜瓣子的发酵性能差异,以期得到产酶能力强、理化指标及感官指标优良的具有生产应用潜能的郫县豆瓣酿造专用米曲霉菌株。
1 材料与仪器
1.1 材料与试剂
干蚕豆瓣、面粉、麸皮、食用盐、黄豆粉等:均为市售。
实验菌株:由本实验室分离筛选的高产蛋白酶、α-淀粉酶米曲霉菌株(采用黄豆汁固体培养基保藏),菌株编号分别为24M-1、21M-2、BM-2、19M-2、25M-1、18M-1、DM1;沪酿 3.042米曲霉:中国普通微生物菌种保藏管理中心(CGMCC)。
黄豆汁固体培养基:将除杂后的黄豆浸泡4 h以上,煮沸5 h,用纱布过滤后取黄豆汁1 L(调整滤液至5 °Bé),20 g可溶性淀粉,1 g磷酸二氢钾,0.5 g硫酸镁,0.5 g硫酸铵,20 g琼脂,于121 ℃灭菌20 min。
麸皮培养基:分别称量80 g麸皮、20 g黄豆粉、80 g 水,混合,浸润后分装。
甲醛、二硝基水杨酸试剂(DNS)、福林-酚试剂、氢氧化钠、浓硫酸、盐酸、硫酸铜、硫酸钾等化学试剂:均为分析纯,购自成都市科龙化学试剂厂,由本实验室配制。
1.2 主要仪器
GCMS-TQ8040(配有Agilent J & W 高分离度气相色谱柱,柱长30 m,直径 0.320 mm,膜0.25 μm)气质联用仪 日本岛津公司;SWDB204SD-01型分离机 北京中船绿洲机器有限公司;YP20002型电子天平 上海越平科学仪器制造有限公司;752G型紫外可见分光光度计 上海仪电分析仪器股份有限公司;BG-160型电热恒温培养箱 上海博讯实业有限公司;PHSJ-4F型pH计 梅特勒-托利多国际贸易(上海)有限公司;SW-CJ-2F型超净工作台 苏州安泰空气技术有限公司;LDZF-75L-H型高压蒸汽灭菌锅 上海申安医疗器械厂。
2 工艺与方法
2.1 种曲制备
2.1.1 工艺流程
麸皮→加水润湿→装入三角瓶→灭菌→接种→培养→种曲。
2.1.2 工艺说明
2.1.2.1 接种、培养
用接种环刮取黄豆汁固体斜面培养基上的米曲霉孢子接种于麸皮培养基中,在30 ℃、湿度80%的条件下培养72 h,得到种曲。
2.1.2.2 种曲酶活测定
在接种时间达到24 h后,每间隔12 h取样,进行酸性蛋白酶、中性蛋白酶和α-淀粉酶活测定,至72 h结束制曲。
2.2 成曲制备
2.2.1 工艺流程

2.2.2 工艺说明
2.2.2.1 漂烫
脱掉壳的干蚕豆瓣,去除杂质,放入适量沸水漂烫3 min,用冷水冷却,过滤,备用。
2.2.2.2 接种制曲
加入 17%的面粉(根据干蚕豆质量计算),接种一定量的种曲以满足蚕豆混合物中米曲霉量达到 106CFU/g的标准,在湿度90%、30 ℃条件下培养48 h,每12 h翻曲一次。
2.3 甜瓣子的制备
2.3.1 工艺流程
成曲→加入适量盐水→摇匀→培养→发酵→甜瓣子。
2.3.2 工艺说明
将成曲称重装入三角瓶中,备用;将水加热至80~90 ℃时加入食盐,配成盐水,冷却备用;按成曲与水的质量比为1∶1,将冷却至40 ℃的盐水(食盐水的浓度以最终混合物的食盐浓度为 15%确定)加入到装有成曲的三角瓶中,拌和混匀,以纱布和牛皮纸封口,放入37 ℃培养箱中培养30 d。每3 d用无菌玻璃棒搅拌1次,测定其氨基酸态氮、总酸、挥发性风味物质的含量,并对制作成熟的甜瓣子进行感官评价。
2.4 指标测定
2.4.1 蛋白酶和α-淀粉酶
蛋白酶的测定方法:参照SB/T 10317—1999《蛋白酶活力测定法》[6],进行蛋白酶的测定。
α-淀粉酶的测定方法:参照GB/T 5521—2008《粮油检验 谷物及其制品中α-淀粉酶活性的测定 比色法》[7],进行α-淀粉酶活性的测定。
2.4.2 氨基酸态氮
氨基酸态氮的测定方法:参照GB 5009.235—2016 《食品安全国家标准 食品中氨基酸态氮的测定》[8],进行氨基酸态氮的测定。
2.4.3 总酸
总酸的测定方法:参照GB/T 12456—2008《食品中总酸的测定》[9],进行总酸的测定。
2.4.4 挥发性风味物质
挥发性风味物质的测定方法:采用气相色谱-质谱法(GC-MS),测定甜瓣子中挥发性风味物质[10],相对含量采用内标法进行定量分析,采用3-甲基丁醇为内标物。
2.4.5 感官评定
对甜瓣子进行感官评定,由10名人员组成感官评定小组,取其平均值。拟定的参考评定方法见表 1。
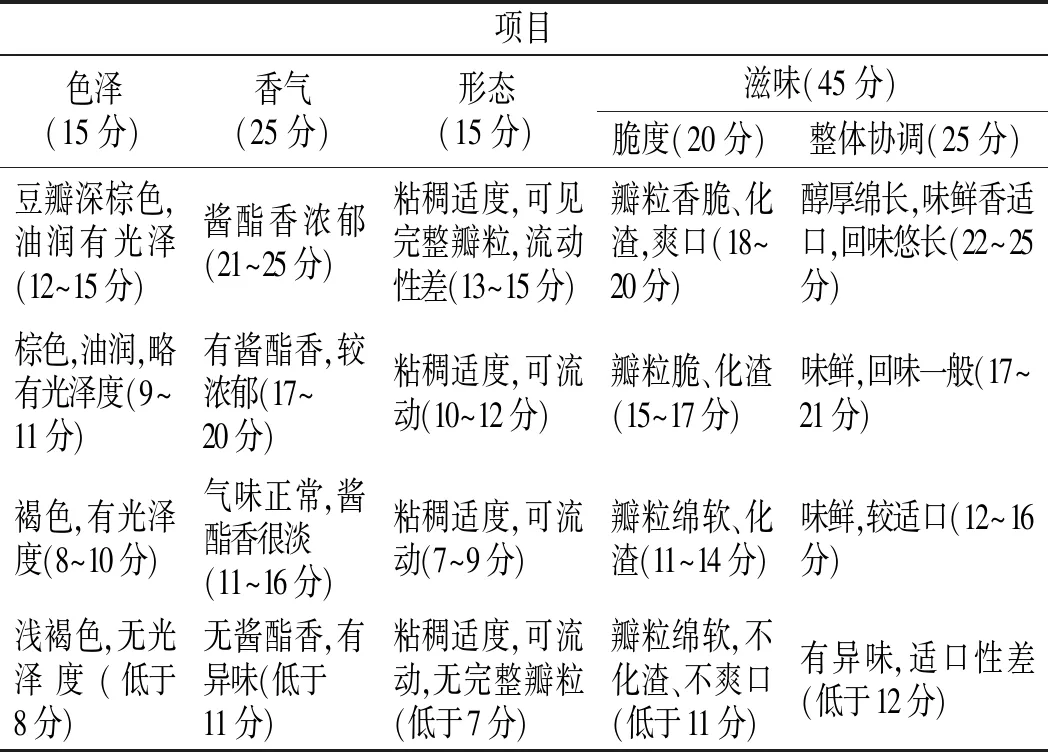
表1 甜瓣子发酵过程中的感官品质Table 1 Sensory quality of sweet beans in the process of fermentation
3 结果与讨论
3.1 种曲酸性蛋白酶、中性蛋白酶及α-淀粉酶酶活力测定结果分析
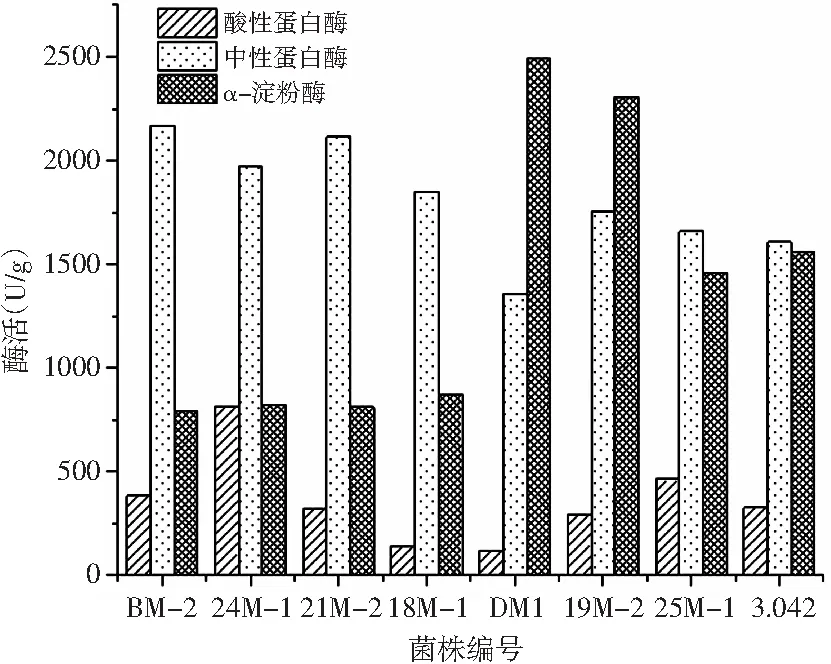
图1 菌株产酶能力比较Fig.1 Comparison of enzyme production activity of strains
蛋白酶是米曲霉所产酶系中最重要的酶之一,直接影响原料的蛋白质利用率和最终产品的风味[11]。制曲过程中米曲霉产生的淀粉酶系,可将原料中的淀粉质水解成糊精、麦芽糖和葡萄糖,与豆瓣酱的色泽和风味形成有很大关系[12]。由图1可知,24M-1、BM-2、DM1 3株试验菌株分别在产酸性蛋白酶、中性蛋白酶和α-淀粉酶方面表现突出,酶活分别为816.809,2168.570,2490.18 U/g,高于3.042的产酶水平。其中,BM-2、24M-1种曲的中性蛋白酶、酸性蛋白酶活力最高,说明菌株产蛋白酶的能力较强,原料利用率更高,发酵周期更短;DM1种曲的α-淀粉酶酶活力最高,说明菌株分解原料中淀粉的能力较强,生成的果糖、葡萄糖等成分为其他微生物的生长提供了物质基础,对后期发酵过程中风味物质的形成起到关键作用。由此,BM-2、24M-1、DM1可作为备选菌株。
3.2 甜瓣子氨基酸态氮测定结果分析
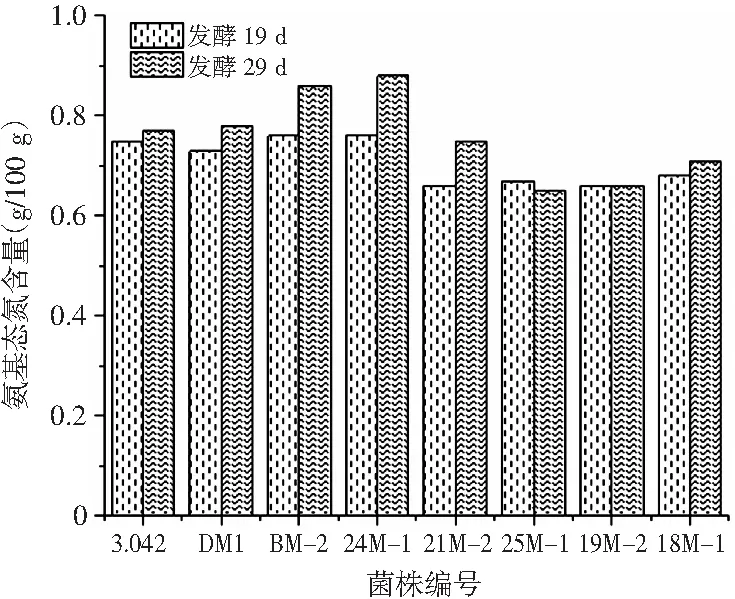
图2 甜瓣子氨基酸态氮含量对比Fig.2 Comparison of amino acid nitrogen content in sweet beans
甜瓣子制备过程中,依靠米曲霉等微生物在原料上生长繁殖所分泌的蛋白酶,将蛋白质水解为氨基酸类物质,通常以氨基酸态氮表示,是郫县豆瓣鲜味的主要来源及部分色素(瓣子呈色)的生成基础,其含量直接影响产品的风味[13],亦可作为衡量菌株发酵性能的重要指标[14]。由图2可知,发酵第19天和第29天,BM-2和24M-1的甜瓣子氨基酸态氮含量最高,其次为3.042和DM1。综合分析,7株试验菌株中,24M-1、BM-2、DM1发酵甜瓣子的氨基酸态氮含量较高,原料全氮利用率较高,鲜味较足,可作为备选菌株。
3.3 甜瓣子总酸含量测定结果分析
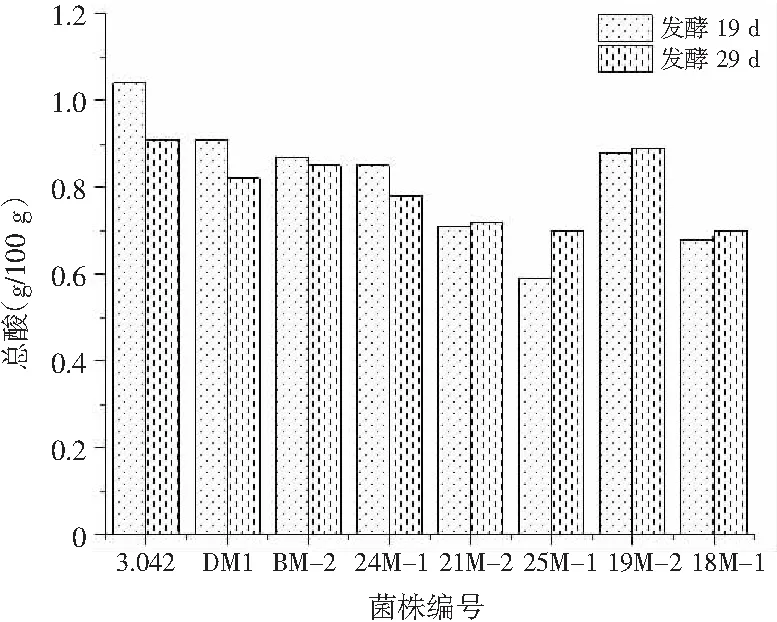
图3 甜瓣子第19天和第29天总酸含量对比Fig.3 Comparison of total acids content in sweet beans on the 19th and 29th days
甜瓣子发酵过程中,乳酸菌等微生物代谢产生乳酸、乙酸,导致有机酸逐渐积累,酸度逐渐增加。甜瓣子中含有适当的有机酸可增加风味和香气,但含量过高则会影响蛋白酶、淀粉酶的分解,导致豆瓣呈酸味而影响最终产品品质[15]。由图3可知,全部菌株发酵甜瓣子中总酸的含量均低于2 g/100 g。综合分析,7株米曲霉试验菌株及对照菌株发酵甜瓣子的总酸均较为适宜,对产品品质没有不良影响。
3.4 甜瓣子中挥发性风味物质测定结果分析
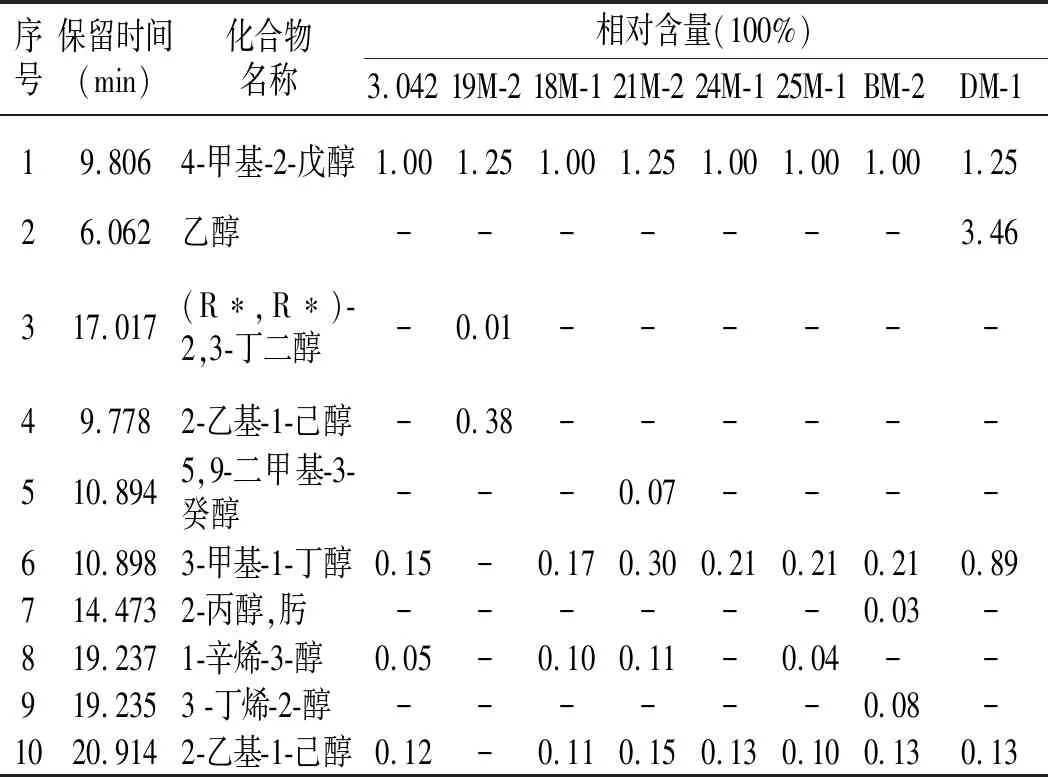
表2 甜瓣子中挥发性成分GC-MS分析结果Table 2 Analysis results of volatile components in sweet beans by GC-MS
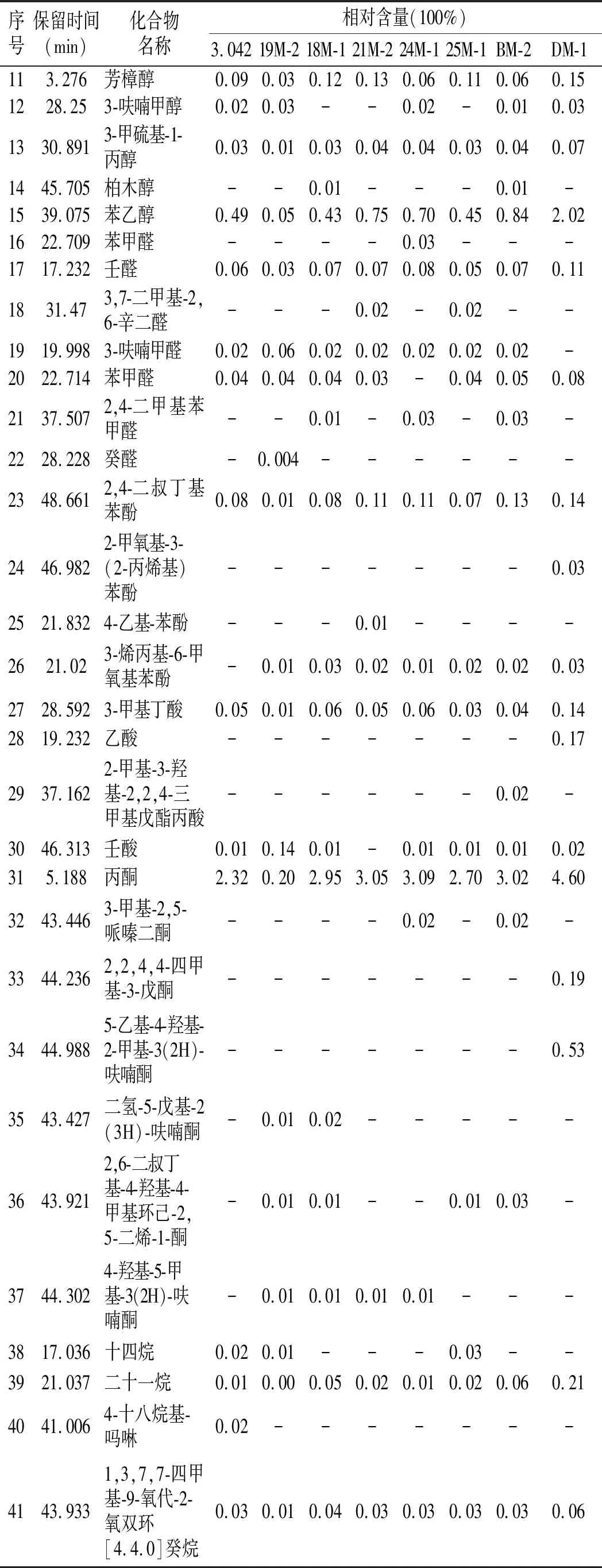
续 表
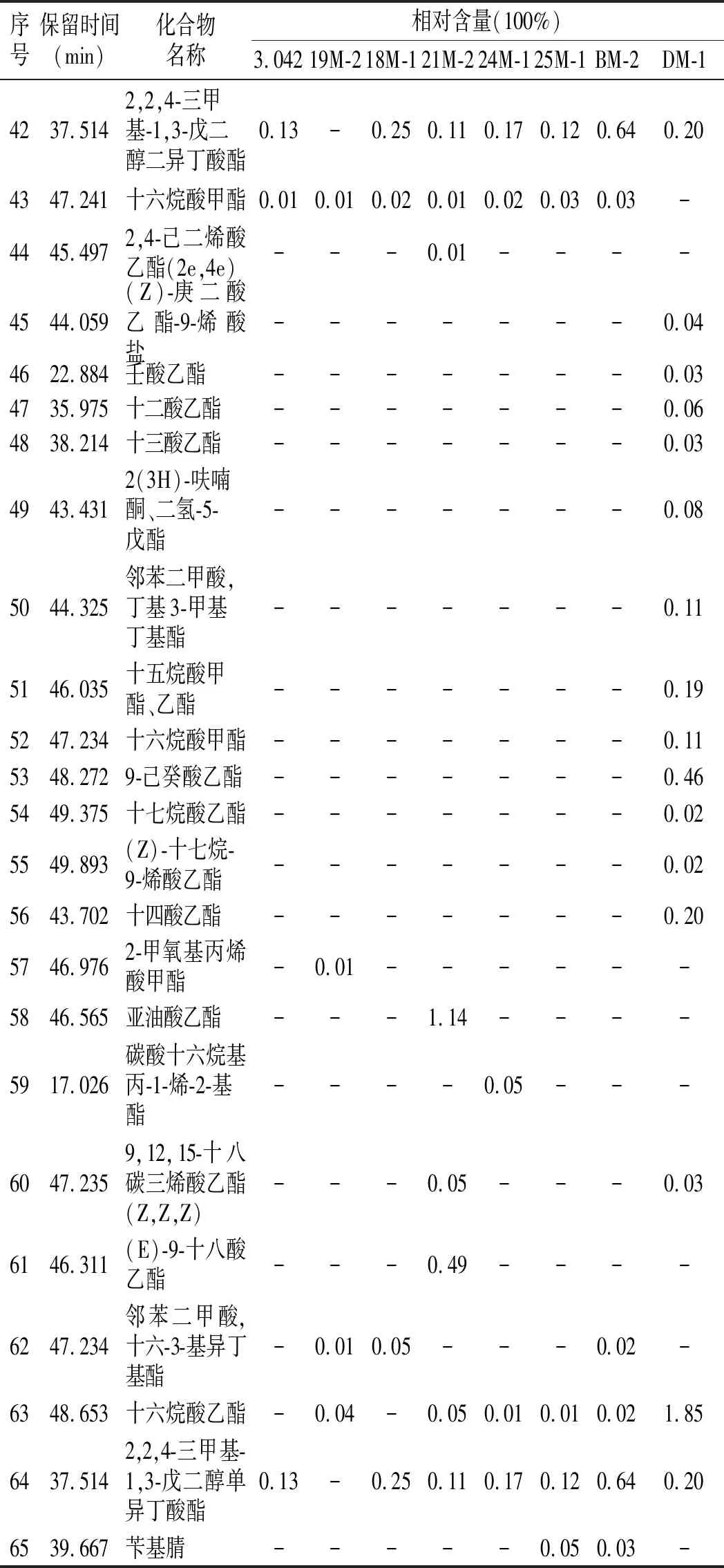
续 表
注:“—”表示未检出,下同。
由表2可知,8株菌株发酵制备的甜瓣子中共测出65种相对含量较高的挥发性风味物质,其中有醇类15种,酯类23种,酮类7种,醛类7种,酚类4种,酸类4种,烷烃类4种,腈类1种,与已有的研究结果一致[16]。
8个甜瓣子样品中挥发性风味物质种类对比情况见图4。
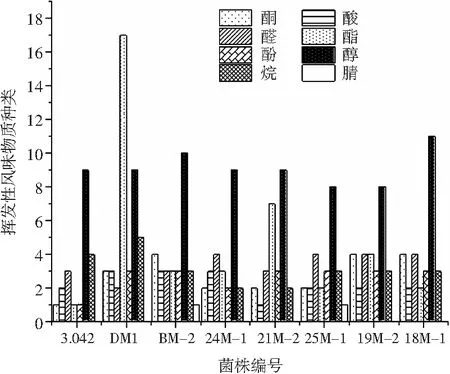
图4 各甜瓣子中挥发性风味物质种类对比Fig.4 Comparison of types of volatile flavor components in sweet beans
酯类主要由醇类与酸类的酯化反应生成,通常呈现出令人愉悦的甜香及果香,除此之外,酯类还可掩盖游离脂肪酸带来的不愉快气味[17]。由图4可知,7株米曲霉菌株发酵甜瓣子中的挥发性风味物质种类均高于对照菌株3.042,表现最突出的为DM1,共测出42类挥发性风味物质,其中酯类物质就含有17种,其次为BM-2、24M-1、21M-2。
8个甜瓣子样品中挥发性风味物质含量对比情况见表3。
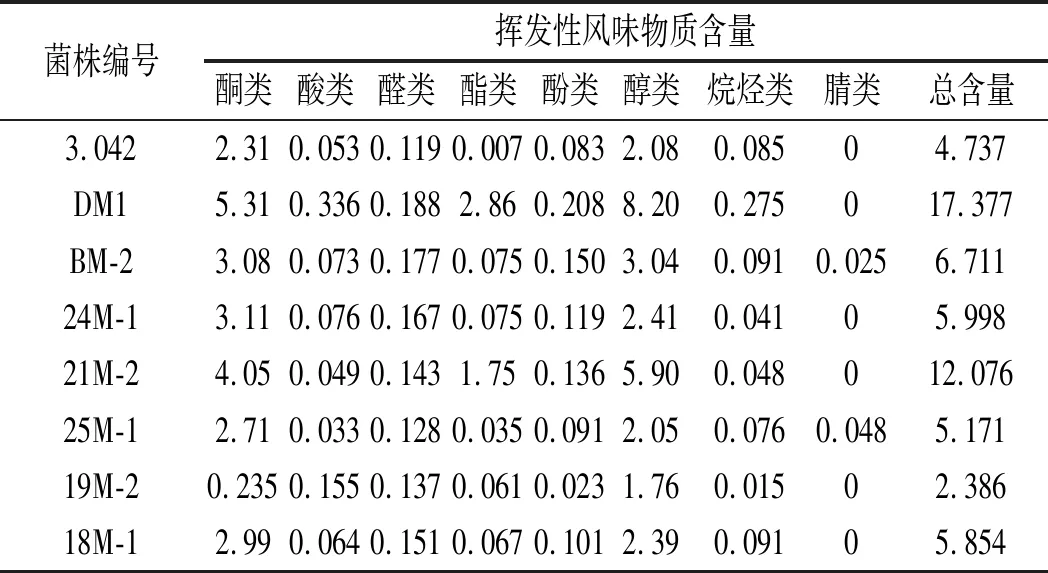
表3 甜瓣子主要挥发性风味物质含量对比Table 3 Comparison of content of main volatile flavor components in sweet beans ng/g
醇类是构成郫县豆瓣特征风味的一类重要化合物,可以被氧化成醛类、酸类等,还是酯化反应的重要前体物质[18,19]。醛类酮类物质通常呈现出令人满意的甜香及花果香,被认为可以增强食品的风味品质[20]。由表3可知,各甜瓣子中,酮类、酚类的含量相对较高,其中,DM1甜瓣子中这两类物质含量均为最高,分别为5.31,8.20 ng/g,其次为21M-2甜瓣子,酮类、醇类含量分别达到4.05,5.90 ng/g;挥发性风味物质含量最高的为DM1,达到17.377 ng/g,其次为21M-2,为12.076 ng/g;7株米曲霉试验菌株中,除19M-2外,其余菌株发酵甜瓣子的挥发性风味物质含量均高于对照菌株3.042。综合来看,DM1和21M-2在挥发性风味物质方面较为突出,可作为备选菌株。
3.5 感官评定结果分析
对甜瓣子感官品质进行评定,结果见表4。
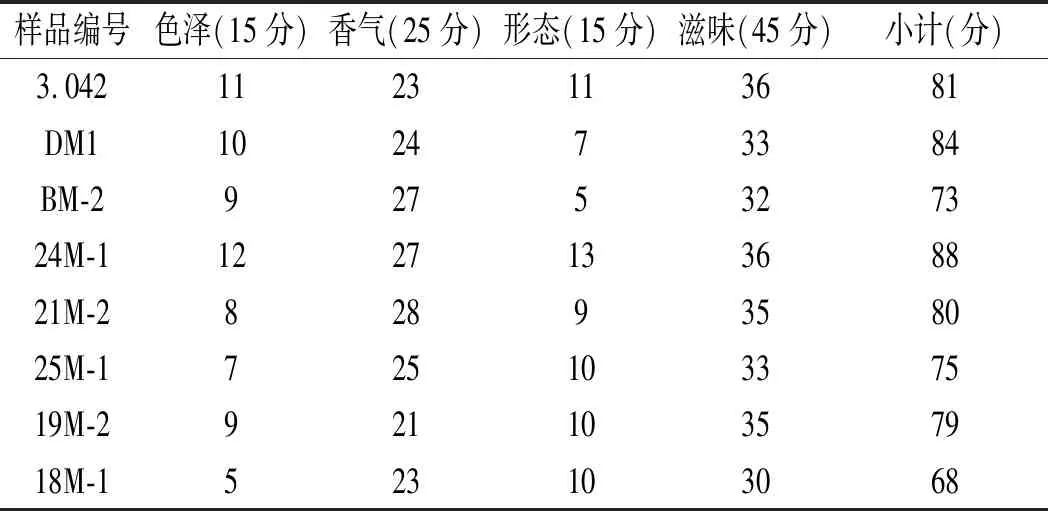
表4 发酵29 d的8个甜瓣子的感官评定表Table 4 Sensory evaluation of 8 sweet beans fermented for 29 days
由表4可知,8个甜瓣子中,最高分是24M-1样品88分,其次是DM1、3.042。可知试验菌株24M-1、DM1发酵制备的甜瓣子感官评价较高,优于对比菌株3.042,可作为备选菌株。
4 结论
本研究以本实验室分离鉴定得到的7株高产中性蛋白酶、酸性蛋白酶、α-淀粉酶的米曲霉菌株为试验菌株,以市售3.042米曲霉为对照菌株,分别制备种曲、成曲、甜瓣子,考察了不同菌株发酵的种曲中的中性蛋白酶、酸性蛋白酶、α-淀粉酶的酶活力差别,进一步评价了由上述8株菌株制作的种曲发酵的甜瓣子的氨基酸态氮、总酸、挥发性风味物质、感官评价等发酵特性指标。通过对比分析发现,24M-1、BM-2、DM1 3株菌株分别在产酸性蛋白酶、中性蛋白酶和α-淀粉酶等方面表现突出,甜瓣子中氨基酸态氮含量较高;全部菌株发酵甜瓣子中总酸的含量均较为适宜,对产品品质没有不良影响;挥发性香味物质方面,通过GC-MS方法共分离鉴定出65种主要的挥发性化合物,酮类、醇类的含量相对较高,表现最突出的为DM1,共测出42类挥发性风味物质,酯类达17种;感官评价方面,24M-1、DM1的感官评价最高,优于对比菌株3.042。总体来看,编号为24M-1、DM1的两株菌在种曲酶活力和甜瓣子的氨基酸态氮、总酸、挥发性风味物质及感官评价等方面表现优异,在提高原料利用率、加快发酵周期、提升豆瓣酱品质方面有较好的应用前景,可进一步优化培养条件和发酵工艺参数,并尽快应用于郫县豆瓣加工,改变目前产业专用生产菌株缺乏的局面。
