高频超声诊断乳腺佩吉特病的价值
2020-05-29刘菊梅梁振威陈路增
陈 蕾,刘菊梅,梁振威,陈路增*
(1.北京大学第一医院超声医学科,2.病理科,北京 100034)
乳腺佩吉特病(Paget disease of breast, PDB)最早于1874年由James Paget首先报道[1],定义为Paget肿瘤细胞散布在乳头表皮的角质细胞之间[2],是一种发生于乳头-乳晕区域的罕见疾病,超过90%病例伴有潜在乳腺原位癌或浸润性乳腺癌[2-4],约占所有乳腺癌的0.5%~5.0%[5]。本病初期表现不典型,首诊误诊率高。超声是检查乳腺疾病的重要影像学方法,但目前国内外关于PDB超声表现的研究较少。本研究初步观察PDB的高频超声表现,以期提高临床诊断准确率,减少漏诊及误诊。
1 资料与方法
1.1 一般资料 回顾性分析2013年1月—2018年9月30例于北京大学第一医院经手术病理证实的PDB患者术前半年内超声检查资料,均为女性,年龄38~85岁,平均(56.013.2)岁,其中30~40岁1例、>40~50岁6例、>50~60岁8例、>60~70岁9例、>70岁6例;病变位于左侧乳腺15例,右侧乳腺15例;病理证实单纯性乳头乳晕佩吉特病2例,合并导管内原位癌(ductal carcinoma in situ, DCIS)15例,合并浸润性导管癌(invasive ductal carcinoma, IDC)3例,同时合并DCIS及IDC者10例(图1),6例合并腋窝淋巴结转移。
1.2 仪器与方法 采用GE Logiq E9、Philips EPIQ7及Siemens S2000超声诊断仪,高频线阵探头,频率 6~15 MHz。嘱患者仰卧,扫查双侧乳腺及腋窝,观察并记录病变部位、乳头回声、乳晕皮肤厚度、乳腺内结节情况及是否有钙化、导管扩张和腋窝淋巴结肿大。以乳晕皮肤厚度>5 mm或较对侧同部位皮肤增厚为标准判断乳晕皮肤增厚[6];乳腺内结节情况包括数量、大小、形态、边界、结节内血流以及乳腺影像报告和数据系统(breast imaging reporting and data system, BI-RADS)分类[7-8]。
1.3 统计学分析 采用SPSS 24.0统计分析软件。以±s表示符合正态分布的计量资料,以百分比描述计数资料,组间比较采用Fisher精确检验。P<0.05为差异有统计学意义。
2 结果
30例中,16例超声探及乳头内低回声,其中5例于乳头低回声内探及血流;乳晕皮肤增厚19例,3例于增厚皮肤内探及血流。10例乳腺内无明确结节。12例见单发、8例见多发结节,为0.60 cm×0.40 cm~5.30 cm×3.20 cm低回声;形态多不规则(18/20,90.00%)、边界多不清晰(17/20,85.00%)。16例合并钙化,其中10例钙化位于结节内、3例位于导管、3例位于乳头;7例合并乳腺导管扩张;9例合并同侧腋窝淋巴结肿大。见表1。
根据是否合并IDC将患者分为2组,Fisher检验结果显示,组间合并结节数量差异有统计学意义(P=0.001)。合并IDC组所有患者超声均见腺体内结节,其中6例(6/13, 46.15%)为多发结节;未合并IDC组41.18%(7/17)超声可探及结节,其中仅2例(2/7,28.57%)为多发结节。合并IDC组69.23%(9/13)结节为BI-RADS 5类,无BI-RADS 3类结节;未合并IDC组多见BI-RADS 4类结节(42.86%,3/7),2例为BI-RADS 3类结节;但2组结节BI-RADS分类差异无统计学意义(P=0.07)。合并IDC组超声显示腋窝淋巴结肿大比例高于未合并IDC组(P=0.002);合并IDC组腋窝淋巴结转移率为46.15(6/13),未合并IDC组未见腋窝淋巴结转移(P=0.003)。
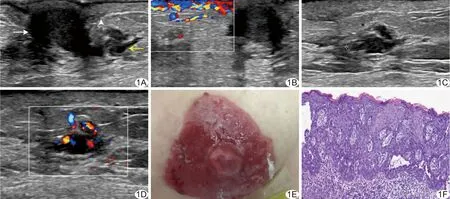
图1 患者女,60岁,PDB合并DCIS及IDC A.超声声像图显示右侧乳头内低回声(白箭),乳晕皮肤增厚(白箭头),乳晕深方不规则低回声结节(黄箭); B.CDFI示乳晕增厚皮肤内血流信号丰富; C、D.右侧乳腺内下象限探及另一个不规则低回声结节(C),结节内可探及较丰富血流信号(D); E.乳头-乳晕区皮肤呈湿疹样改变; F.病理图(HE,×10),诊断为PDB合并DCIS及IDC
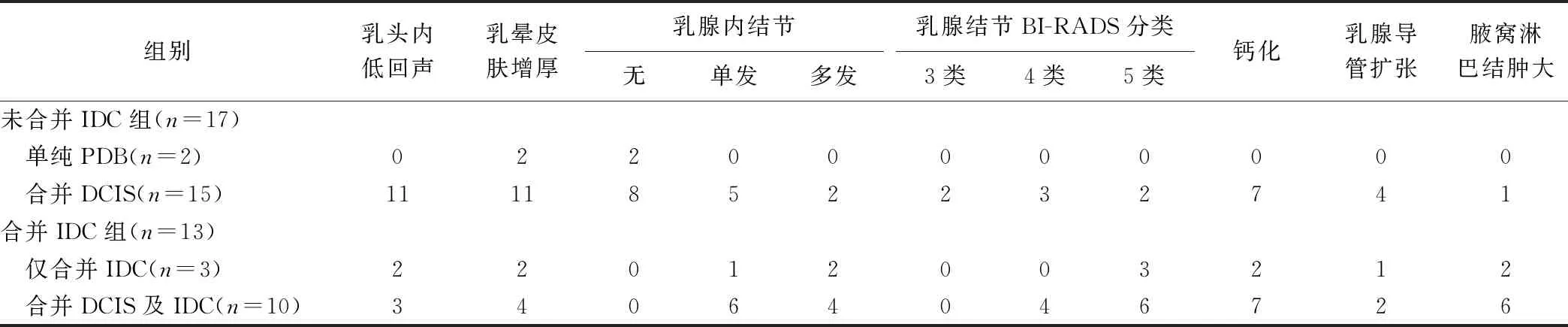
表1 PDB超声特征(例)
2组超声显示乳头内低回声(P=0.15)、乳晕皮肤增厚(P=0.13)、钙化(P=0.13)及乳腺导管扩张 (P>0.99)比例差异均无统计学意义。
3 讨论
本组患者均为女性,50~70岁者占56.67%(17/30),与既往研究[3]结果基本一致。PDB临床常表现为乳头-乳晕区瘙痒、湿疹样改变、糜烂或溃疡、乳头溢液及乳头变形等[9-11],约50%患者可触及乳腺肿物[12]。目前诊断PDB主要依靠临床表现,首诊误诊率高。
本组约93.33%(28/30)PDB患者合并乳腺癌,其中多数为DCIS,其次为IDC,并有20.00%(6/30)患者合并腋窝淋巴结转移。PDB的病理特征为乳头表皮内佩吉特细胞浸润[1,13],病理类型主要包括单纯乳头佩吉特病、合并DCIS或IDC或二者同时存在以及合并其他类型乳腺癌(较少见,如浸润性小叶癌)[6,9]。既往研究[4]发现PDB合并乳腺癌较单纯乳腺癌恶性程度更高,患者预后更差。关于PDB的起源,目前主要有2种理论[3]:①表皮(导管)理论,假设佩吉特细胞起源于导管癌细胞,沿导管基膜迁移至乳头表皮,与DCIS和IDC相关;②现有细胞恶变或退化,将佩吉特细胞视为原位出现的恶性角质形成细胞,认为PDB是独立于其他类型乳腺癌的一种原位癌。本组绝大多数(28/30,93.33%)患者乳头病变均与DCIS或IDC同时出现,更倾向于支持表皮(导管)理论。
本组30例PDB主要超声表现包括乳头内低回声、乳晕皮肤增厚、乳腺内结节、钙化、导管扩张及腋窝淋巴结肿大,上述超声表现可同时出现,也可出现其中1个或数个。多数患者超声显示乳头内低回声,主要表现为乳头回声减低或乳头内低回声结节,部分伴有局部血流丰富,此征象在既往研究[3]中曾有报道,可能提示乳头内肿瘤细胞浸润。本组约2/3患者超声显示乳晕皮肤增厚,部分伴有局部血流增加。高频超声的软组织分辨率高,能够清晰区分皮肤层次并进行测量[6],显示乳头、乳晕皮肤病变较乳腺钼靶更具优势[12],故对诊断PDB和评估病情具有重要临床价值。
本研究中合并IDC组PDB超声显示乳腺结节率显著高于未合并IDC组,提示当超声发现疑诊PDB患者存在乳腺内肿块时,应首先考虑PDB合并IDC。此外,超声显示乳腺结节均为低回声,多数结节形态不规则,边界不清;合并IDC者结节多为BI-RADS 5类,合并DCIS者结节多数为BI-RADS 4类,也有BI-RADS 3类,提示单纯PDB或PDB合并DCIS可能更易因超声检查未显示明确结节或结节BI-RADS评分较低而导致漏诊和/或误诊。
PDB钙化发生率较高[14],本组PDB钙化发生率为53.33%(16/30)。既往研究[6]报道,PDB的钙化特点是发生在乳头内、乳晕内和乳晕附近,沿导管分布,可一直追踪到乳头部。本研究发现钙化可发生于乳头内、沿导管分布或出现在结节内,并不一定局限于乳头、乳晕内或乳晕附近。此外,高频超声还可显示乳腺导管扩张及评估腋窝淋巴结情况。有无淋巴结转移对PDB患者预后至关重要,合并同侧腋窝淋巴结转移者5年生存率低于无转移者[6]。本研究结果显示,PDB合并IDC组腋窝淋巴结转移率及超声显示腋窝淋巴结肿大比例均高于未合并IDC组,提示PDB合并IDC患者预后可能较未合并IDC者差。高频超声除可较全面评估乳头、乳晕皮肤、乳腺结节及钙化等之外,对评价腋窝淋巴结也具有重要作用,可用于术前判断有无腋窝淋巴结转移。
PDB患者出现乳头、乳晕湿疹样病变时,临床可能采用糖皮质激素进行治疗,因此造成延误诊断[12]。PDB的首选治疗方法是手术(伴或不伴前哨淋巴结活检),由于病变常累及乳头-乳晕区,故需要完整切除乳头-乳晕区及腺体内恶性肿物[1,15]。高频超声有助于对PDB患者进行术前全面评估(包括乳头-乳晕区病变范围,腺体内肿物数量、大小、位置、性质及腋窝淋巴结情况等)。
PDB的超声表现具有一定特征,高频超声对PDB诊断及疾病评估具有重要价值。然而实际工作中超声检查PDB亦可能存在漏诊、误诊,可能原因如下:①对扫查乳头-乳晕区重视不足;②部分PDB超声不显示或难以显示乳腺内结节,造成漏诊;③PDB合并DCIS时,腺体内结节可能BI-RADS评分较低,造成误诊。因此,乳腺超声检查应常规扫查乳头、乳晕区域;对疑诊PDB患者进行超声检查时,除关注乳头-乳晕区外,还应注意腺体内有无结节、腋窝淋巴结有无肿大,以进行全面评估。
本组为回顾性研究,超声检查部分患者时,存在乳头-乳晕区扫查不全面的情况;样本量较小,尚需增加样本量,进行长时间多中心研究,以进一步完善。
总之,PDB的超声表现具有一定特征性,高频超声有助于诊断及评估病情。
