兔出血症病毒2型的分离鉴定与序列分析
2020-05-27魏后军胡波范志宇宋艳华仇汝龙陈萌萌薛家宾王芳
魏后军 胡波 范志宇 宋艳华 仇汝龙 陈萌萌 薛家宾 王芳

摘要:兔出血症(Rabbit hemorrhagic disease, RHD)是由兔出血症病毒(Rabbit hemorrhagic disease virus, RHDV)引起的一种具有高度传染性、急性致死性兔病。兔出血症病毒2型(RHDV2)引起的RHD主要在欧洲流行,病兔的死亡率高达90%,而用经典RHDV毒株制备的疫苗几乎不能预防家兔感染RHDV2,从而给世界养兔业造成了巨大的经济损失。2020年4月,中国四川省某兔场首次发生由疑似RHDV2引起的RHD,笔者所在实验室通过红细胞凝集试验(Hemagglutination, HA)、逆转录-聚合酶链式反应(Reverse transcription-polymerase chain reaction, RT-PCR)扩增、vp60基因序列分析和病毒复制试验,对采集的病死家兔肝脏样本进行病原鉴定。HA结果显示,部分病死家兔的肝脏样本不能引起血凝现象;RT-PCR结果显示,样品中出现了RHDV2的特异性条带。對新发现毒株cDNA的RT-PCR产物进一步分析发现,所扩增vp60基因核苷酸序列与经典RHDV vp60基因核苷酸序列的一致性为77.5%~80.1%,与RHDV2 vp60基因核苷酸序列的一致性为93.6%~96.1%,并且与RHDV2处于同一个进化分支。病毒复制试验结果显示,用病死家兔肝脏组织与磷酸缓冲盐溶液(Phosphate buffer saline, PBS)按1 g∶10 ml混合后制成的悬液分别人工感染5只非免疫25日龄未断奶仔兔和5只2月龄兔,在24~48 h全部死亡。基于以上试验结果,确定本研究新发现的RHDV毒株为RHDV2,并将其命名为SC2020,这是在中国首次发现RHDV2毒株,应引起高度重视。
关键词:兔出血症;兔出血症病毒2型(RHDV2);vp60基因;鉴定;序列分析
中图分类号:S855.3文献标识码:A文章编号:1000-4440(2020)02-0404-06
Abstract:Rabbit hemorrhagic disease (RHD) is a highly contagious and acute fatal disease caused by rabbit hemorrhagic disease virus (RHDV). RHL caused by rabbit hemorrhagic disease virus type 2 (RHDV2) is mainly prevalent in Europe, and the mortality rate is as high as 90%. Rabbits can hardly be protected from infecting RHDV2 by classical RHDV vaccine, resulting in huge economic loss to world rabbit-raising industry. In April 2020, suspected RHDV2-induced RHD cases were found in a rabbitry of Sichuan province, China. Hemagglutination(HA) test, reverse transcription-polymerase chain reaction (RT-PCR), vp60 gene sequence analysis and virus replication experiment were conducted to identify the pathogen in the collected livers of dead rabbits in our lab. The results of HA showed that the liver samples of some dead rabbits could not induce hemagglutination. In addition, specific bands of RHDV2 were detected by RT-PCR in the samples. Further analysis on RT-PCR product of newly discovered strain indicated that the nucleotide sequence of amplified vp60 gene shared 77.5%-80.1% and 93.6%-96.1% nucleotide sequence consistency with classic RHDV vp60 gene and RHDV2 vp60 gene, respectively. The amplified segment and RHDV2 were on the same branch of the evolutionary tree. The results of virus replication showed that five unweaned rabbits (25-day-old) and five rabbits (two-month-old) died in 24 h to 48 h after being infected with suspension of 10 ml phosphate buffer saline (PBS) versus 1 g liver tissues from dead rabbits. These results indicated that the newly discovered RHDV strain was RHDV2, and it was named as SC2020. This is the first RHDV2 strain detected in China, and it should be carefully monitored.
Key words:rabbit hemorrhagic disease;rabbit hemorrhagic disease virus type 2(RHDV2);vp60 gene;identification;sequence analysis
兔出血症(Rabbit hemorrhagic disease,RHD)是由兔出血症病毒(Rabbit hemorrhagic disease virus,RHDV)引起的一种急性、高传染性、高致死性疾病。经典的RHDV只感染家兔,且易感染2月龄以上的家兔,染病后家兔的病死率达90%,常于感染后48~72 h死亡,死亡家兔具有呼吸系统和肝、脾、肾、心等实质脏器瘀血、肿大和出血等特征[1];未断奶仔兔不易感。该病于1984年首先在中国被报道,随后迅速在全球大部分地区流行,同时RHDV也发生了遗传变异。从系统发育关系上看,RHDV可以分为G1~G6这6个基因型(GI.1),中国的流行毒株主要为G2、G6型[2-3]。2010年,在法国首次发现了RHDV的新毒株,研究者将其命名为RHDV2[4]。目前的研究发现,RHDV2对不同日龄的家兔均易感,家兔感染后的病死率可达90%。RHDV2与经典RHDV毒株G1~G6型感染家兔致死的典型症状相似,但在遗传特性及抗原性上有很大差异,并且用经典毒株制备的疫苗不能有效避免家兔感染RHDV2[5]。目前,RHDV2已在欧洲扩散,在亚速尔群岛和澳大利亚也有相关报道[6-7]。中国肉兔配套系100%依赖进口,主要进口国为法国,中国同时是世界上最大的兔肉出口国,与欧洲之间在兔行业上的贸易往来密切。因此可见,RHDV2对中国养兔业的潜在威胁极大。
2020年4月1日,四川某兔场出现患病家兔的急性死亡病例,死亡家兔的临床症状和病理变化与兔出血症十分相似。2020年4月2日至4月5日,患病家兔的死亡数量明显增多,且各日龄阶段的家兔包括未断奶的仔兔都有死亡发生。据了解,该兔场共有约300只母兔、1 500只商品兔,发病前已对家兔注射兔病毒性出血症、多杀性巴氏杆菌病二联灭活疫苗,发病后第5 d紧急注射上述二联灭活疫苗,但效果不明显,兔死亡率约为73.3%,且病死家兔均出现RHD的典型临床症状。根据RHDV2可引起低龄幼兔死亡,且经典RHDV组织灭活疫苗不能有效抵抗RHDV2感染的特征,初步推测该兔病的病原为RHDV2。经红细胞凝集(Hemagglutination, HA)试验、逆转录-聚合酶链式反应(Reverse transcription-polymerase chain reaction, RT-PCR)分析、序列测定及病毒复制试验,确定该病原为RHDV2,这是在中国首次发现的RHDV2毒株。
1材料与方法
1.1主要试验材料
病料样品来源为四川省某兔场的3只病死家兔(编号为样品1、样品2、样品3);RHDV皖阜株、RHDV2 vp60基因构建的重组质粒pMD19-T-vp60-2由笔者所在实验室保存;阴性无特定病原体(Specific pathogen free, SPF)兔肝脏由邳州市东方养殖有限公司提供。
1.2红细胞凝集试验
参照中华人民共和国农业行业标准(NY/T 572—2016《兔病毒性出血病血凝和血凝抑制试验方法》),分别取3只病死家兔的少许肝脏组织,置于载玻片上剪碎后滴加用磷酸缓冲盐溶液(Phosphate buffer saline, PBS)配制的体积分数为1%的人“O”型红细胞,同时设SPF兔肝脏组织为阴性对照,设RHDV皖阜株肝脏组织为阳性对照,于4 ℃放置5 min。若肝脏组织中有兔出血症病毒,肉眼可观察到血凝现象。
1.3病毒RNA的提取及反转录
将家兔肝脏组织样品与焦碳酸二乙酯(Diethyl pyrocarbonate, DEPC)水溶液按1∶10(质量体积比)混合后研磨成悬液,10 000 r/min离心15 min,取上清液按照TRIzol法提取RNA;利用反转录试剂盒获得病毒cDNA,于-20 ℃保存备用。
1.4病毒cDNA的PCR鉴定
参照笔者所在实验室建立的检测经典RHDV[8]和鉴别经典RHDV与RHDV2的RT-PCR方法,以及世界动物卫生组织(Office International Des Epizooties,OIE)推荐的用于检测RHDV2[9]的RT-PCR方法中的引物(由南京擎科生物科技有限公司合成),以cDNA为模板,采用高保真的Golden Star T6 Super PCR MIX进行家兔出血症病毒vp60基因片段的扩增。用笔者所在实验室建立的方法进行检测时,经典RHDV的扩增产物大小为591 bp;用鉴别经典RHDV与RHDV2 RT-PCR方法时,經典RHDV的扩增产物大小为193 bp,RHDV2扩增产物大小为829 bp;用OIE推荐的方法检测时,RHDV2扩增产物大小为481 bp。
1.5病毒基因序列的同源性分析
将PCR扩增产物送至南京擎科生物科技有限公司测序。用DNAStar中的MegAlign软件对新分离毒株vp60基因序列的测序结果进行同源性分析,并将基因序列上传至GenBank数据库。
1.6病毒的遗传进化分析
vp60基因是RHDV结构蛋白基因,OIE以vp60基因作为RHDV分型的依据。从GenBank数据库中获得国内外经典RHDV毒株(登录号:AF231353、AF402614、DQ205345、FJ794180、JN165235、KU207100)、RHDV2毒株(登录号:FR819781、HE819400、JX133161、KP129397、KM115712)和兔杯状病毒(Rabbit calicivirus, RCV)(登录号:X96868)的vp60基因序列,对这些序列构建进化树并进行分析。
1.7病毒的复制分析
在严格的生物安全防控条件下,将疑似感染RHDV2的病死家兔肝脏组织样品与磷酸缓冲盐溶液按1 g∶10 ml混合后研磨成悬液,分别颈部皮下注射5只非免疫的25日龄未断奶仔兔和5只2月龄兔,注射量均为每只1 ml,随后观察家兔的发病、死亡情况。取死亡家兔的肝脏组织进行血凝试验和用于鉴定经典RHDV与RHDV2的RT-PCR试验,将扩增产物送至南京擎科生物科技有限公司测序。
2结果与分析
2.1红细胞凝集试验
红细胞凝集试验结果表明,3只病死家兔的肝脏样本中,样品2的肝脏出现血凝现象,样品1、样品3均未出现肉眼可见的血凝现象。
2.2病毒的PCR鉴定
以病毒cDNA为模板,用经典RHDV鉴定引物进行PCR扩增,图1A显示,3个样品在591 bp位置均未出现特异性条带;使用OIE推荐的RHDV2鉴定引物进行PCR扩增,图1B显示,3个样品在481 bp位置均出现特异性条带,其中样品2的扩增条带亮度较强;用经典RHDV与RHDV2鉴别引物进行PCR扩增,图1C显示,3个样品在829 bp位置均出现RHDV2的特异性条带,在193 bp位置未出现经典的RHDV特异性条带。
2.3vp60基因的序列分析
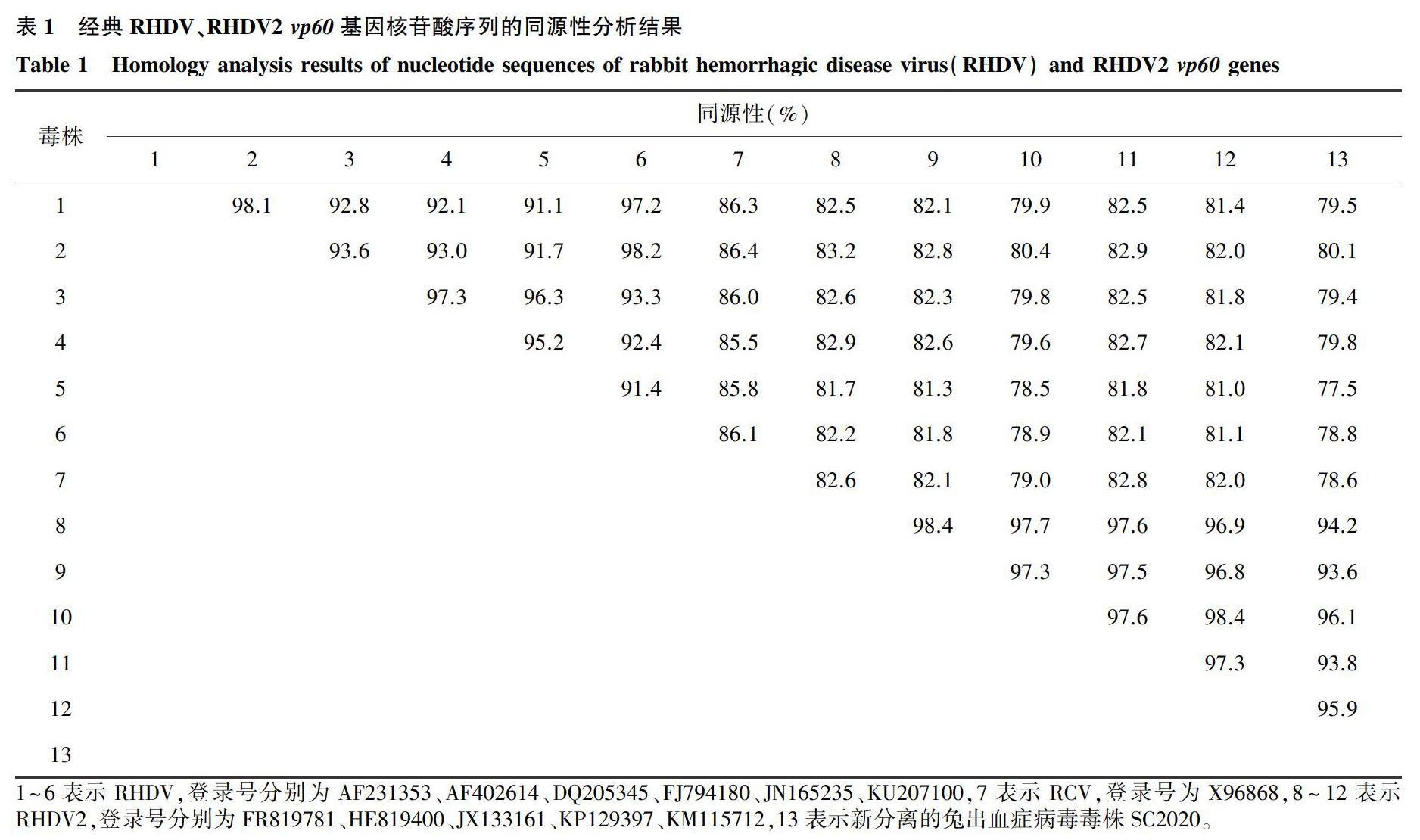
测定RHDV2扩增产物(大小为829 bp)的vp60基因序列并将其上传至GenBank数据库中(登录号:MT383748),将其命名为SC2020。表1的分析结果显示,本研究所扩增序列与GenBank上报道的经典RHDV(基因型为GI.1)的vp60基因(登录号:AF231353、AF402614、DQ205345、FJ794180、JN165235、KU207100)的核苷酸序列一致性为77.5%~80.1%,与RHDV2(基因型为GI.2)vp60基因(登录号:FR819781、HE819400、JX133161、KP129397、KM115712)的核苷酸序列一致性为93.6%~96.1%。
2.4vp60基因的遗传进化分析
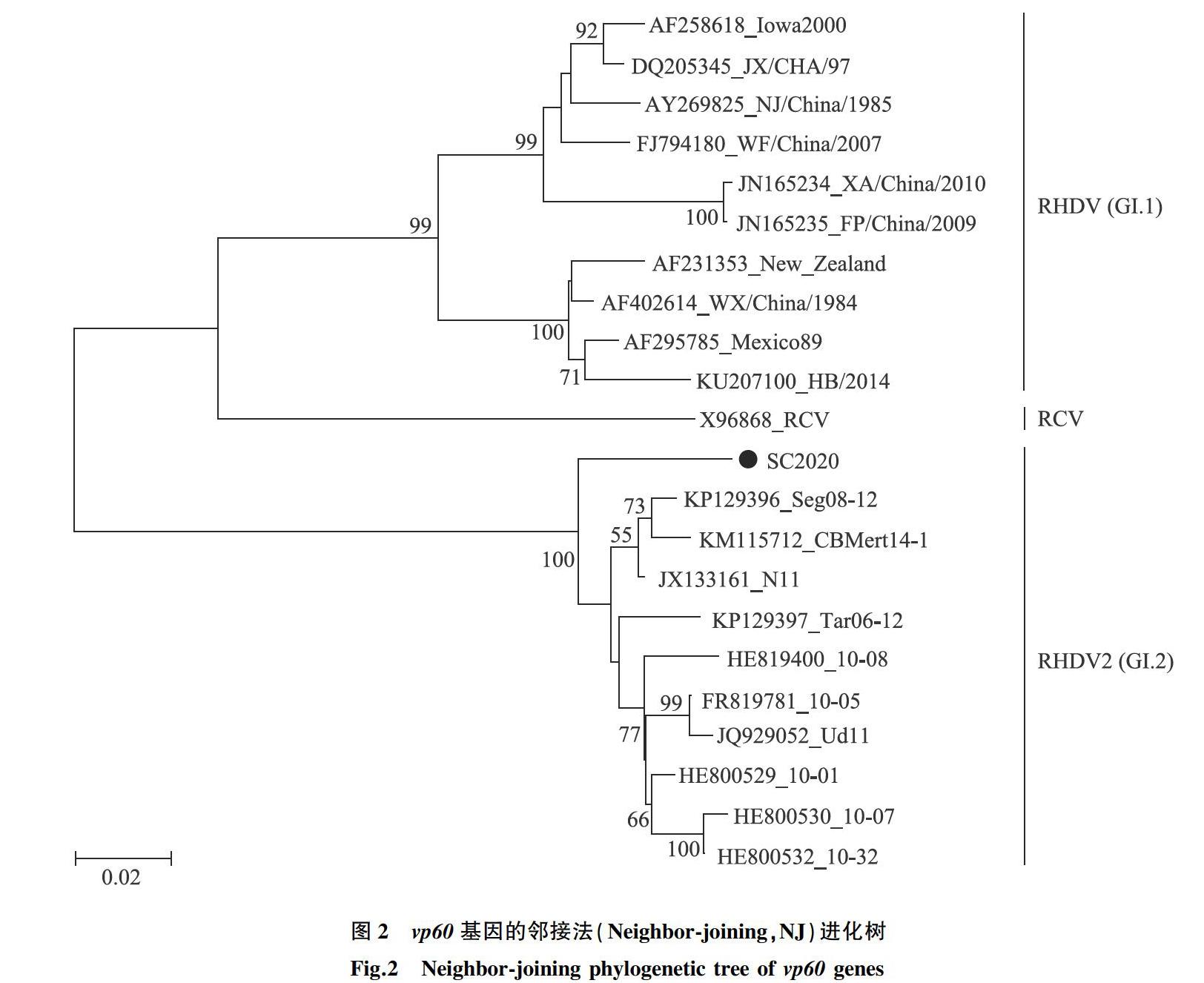
用MEGA 5.2对病毒的vp60基因核苷酸序列进行遗传进化分析,由图2可以看出,新分离的病毒毒株与RHDV2(基因型为GI.2)的亲缘关系较近,并位于同一个大的分支,与RHDV(基因型为GI.1)的亲缘关系较远。
2.5病毒的复制情况
分别用样品2的肝脏悬液注射5只25日龄非免疫的未断奶仔兔和5只2月龄兔,结果发现,10只家兔均在注射后24~48 h死亡。取死亡家兔的肝脏组织进行红细胞凝集试验,结果显示,2月龄兔中,有1只出现明显的血凝现象,有2只出现较弱的血凝现象,有2只未出现血凝现象;未断奶仔兔中,有2只出现明显的血凝现象,有3只出现较弱的血凝现象。对死亡家兔的肝脏组织进行经典RHDV与RHDV2鉴别RT-PCR试验,发现均出现了单一的RHDV2特异性条带。进一步对该条带进行测序,结果表明,PCR扩增产物的测序结果与攻毒毒株的序列一致。
3讨论
RHDV2自2010年首次在法国被报道以来,已逐步取代经典RHDV而在欧洲蔓延,并开始在世界范围内流行。中国在2017年以前的RHDV流行株主要是经典RHDV中的G2和G6型,并且存在G2/G6的重组毒株[2-3]。通过对RHDV新分离毒株SC2020的序列分析,其毒株与RHDV2毒株的核苷酸序列一致性达93%以上,与经典型RHDV毒株的核苷酸序列一致性约为80%。通过遗传进化分析可知,新分离毒株SC2020与RHDV2毒株位于同一个分支,表明本研究所分离的RHDV新毒株为RHDV2,这是在中国首次发现RHDV2毒株。
中国RHDV的临床样本检测主要使用行业标准推荐的人“O”型红细胞凝集试验方法,该方法易于操作,但存在假阴性和假阳性的可能。国内外均报道过低血凝和无血凝RHDV毒株的存在。由于在基层临床检测中较少使用RT-PCR方法和酶联免疫吸附法(Enzyme linked immune sorbent assay,ELISA)测定,因此,检验人员通过血凝试验进行检测时可能由于血凝试验呈阴性而判定为非RHD,导致漏诊、误诊。在本研究中,最初3只病死家兔中有2只的肝脏组织没有出现血凝现象,在后续病毒复制试验中,有2只死亡家兔的肝脏组织也没有出现肉眼可见的血凝现象,而病死家兔均出现RHD的典型症状,且其肝脏样品经RT-PCR方法检测和测序,其毒株均鉴定为RHDV2。中国已有的检测经典RHDV的实验室诊断方法可能并不适用于RHDV2的特异性检测,例如检测RHDV的RT-PCR方法[8]和检测RHDV的胶体金免疫层析试纸条法等[10]。国外已经建立了检测RHDV2的实时荧光定量PCR方法[11-12]和夹心ELISA方法[13],但是否能用于中国新发现毒株的检测还有待进一步确认。笔者所在实验室建立的鉴别经典RHDV与RHDV2的RT-PCR方法,可以有效鉴别经典RHDV和RHDV2,這为应对中国出现的RHDV2感染或经典RHDV/RHDV2混合感染病例的鉴定提供了有效方法,可用于中国RHDV毒株的检测及鉴别诊断。
本研究的3只死亡家兔此前已免疫接种由经典RHDV毒株制备的组织灭活疫苗,但是不能有效抵抗RHDV2的感染,这与国外相关报道[5]相符。因此可以推测,RHDV2一旦在中国流行,将对养兔业产生严重的危害甚至造成毁灭性的打击。鉴于中国可能出现由RHDV2引起的RHD暴发和流行,RHDV2的疫苗研制已刻不容缓。在加强RHD流行病学调查的基础上,应加快RHDV2组织灭活疫苗或基因工程疫苗的研制,从而保障中国养兔业的健康发展。
参考文献:
[1]ABRANTES J, VAN DER LOO W, LE PENDU J, et al. Rabbit haemorrhagic disease (RHD) and rabbit haemorrhagic disease virus (RHDV): a review[J]. Veterinary Research, 2012, 43(1): 12.
[2]HU B, WANG F, FAN Z, et al. Recombination between G2 and G6 strains of rabbit hemorrhagic disease virus (RHDV) in China[J]. Archives of Virology, 2017, 162(1): 269-272.
[3]HU B, FAN Z, WANG F, et al. A new variant of rabbit hemorrhagic disease virus G2-like strain isolated in China[J]. Veterinary Research, 2016, 215: 20-24.
[4]LE GALL-RECULE G, ZWINGELSTEIN F, BOUCHER S, et al. Detection of a new variant of rabbit haemorrhagic disease virus in France[J]. Veterinary Research, 2011, 168(5): 137-138.
[5]LE GALL-RECULE G, LAVAZZA A, MARCHANDEAU S, et al. Emergence of a new lagovirus related to Rabbit Haemorrhagic Disease Virus[J]. Veterinary Research, 2013, 44: 81.
[6]STRIVE T, PIPER M, HUANG N, et al. Retrospective serological analysis reveals presence of the emerging lagovirus RHDV2 in Australia in wild rabbits at least five months prior to its first detection[J]. Transboundary and Emerging Diseases, 2020, 67(2): 822-833.
[7]ROUCO C, ABRANTES J, SERRONHA A, et al. Epidemiology of RHDV2 (Lagovirus europaeus/GI.2) in free-living wild European rabbits in Portugal[J]. Transboundary and Emerging Diseases, 2018, 65(2): e373-e382.
[8]胡波,魏后军,王芳,等. 兔出血症病毒RT-PCR检测方法的建立及其临床应用[J]. 畜牧兽医学报,2010, 41(11): 1442-1446.
[9]VELARDE R, CAVADINI P, NEIMANIS A, et al. Spillover events of infection of brown hares (Lepus europaeus) with rabbit haemorrhagic disease type 2 virus (RHDV2) caused sporadic cases of an European brown hare syndrome-like disease in Italy and Spain[J]. Transboundary and Emerging Diseases, 2017, 64(6): 1750-1761.
[10]蔡少平,王芳,贾华敏,等. 兔出血症病毒胶体金免疫层析试纸条诊断方法的建立及初步应用[J]. 畜牧兽医学报,2012, 43(11): 1795-1801.
[11]DUARTE M D, CARVALHO C L, BARROS S C, et al. A real time Taqman RT-PCR for the detection of rabbit hemorrhagic disease virus 2 (RHDV2)[J]. Journal of Virological Methods, 2015, 219: 90-95.
[12]NEIMANIS A S, AHOLA H, ZOHARI S, et al. Arrival of rabbit haemorrhagic disease virus 2 to northern Europe: emergence and outbreaks in wild and domestic rabbits (Oryctolagus cuniculus) in Sweden[J]. Transboundary and Emerging Diseases, 2018, 65(1): 213-220.
[13]DALTON K P, PODADERA A, GRANDA V, et al. ELISA for detection of variant rabbit haemorrhagic disease virus RHDV2 antigen in liver extracts[J]. Journal of Virological Methods, 2018, 251: 38-42.
(責任编辑:徐艳)
