肝移植术后缺血型胆道病变发生危险因素分析*
2020-05-27罗羽鸥杨晓玲
罗羽鸥,杨晓玲,李 川
肝移植(liver transplantation, LT)是治疗终末期肝病的主要方法,缺血性胆道病变(ischemia-type biliary lesions,ITBL)为术后最重要的并发症之一,可造成移植物功能丧失和肝移植患者死亡,且发病率高、预后差。现今对于肝移植术后ITBL发病的认识不足,也缺乏很好的治疗手段[1-3]。当下,学界普遍认为移植物冷保存、缺血再灌注损伤、胆盐毒性和移植免疫反应等因素与肝移植术后ITBL的发生密切相关。相关研究仍较少,且不同时间和地域研究文献报道的肝移植术后ITBL发生的原因并不一致,严重影响其预防及治疗措施的施行[4,5]。本研究对我院收治的312例肝移植术患者的临床资料进行了分析,旨在探讨肝移植术后ITBL发生的危险因素,以期为肝移植术后ITBL的病因预防和诊疗提供依据,现将结果报道如下。
1 资料与方法
1.1 一般资料 2015年1月~2019年2月我院收治的终末期肝病患者312例,男性255例,女性57例;年龄11~72岁,平均年龄为(48.3±5.1)岁。原发疾病为失代偿期乙型肝炎肝硬化52例,失代偿期丙型肝炎肝硬化11例,慢加急性肝衰竭106例,原发性肝癌143例。A型血87例,B型血99例,AB型血39例,O型血87例。肝移植术后ITBL的诊断包括肝移植术后无明确病因出现的胆道狭窄、扭曲和扩张,发生胆道脓肿和胆道消失,诱发肝功能障碍,经胆道造影和影像学检查诊断[7]。排除标准:①合并心、脑、肾、肺等重要器官功能障碍者;②合并自身免疫性疾病或艾滋病等免疫功能障碍者;③供、受体间 ABO 血型不相容肝移植;④术后早期死亡或移植物失功能者;⑤慢性排斥反应者;⑥肝动脉出现血栓者。所有患者签署知情同意书,本研究已通过我院医学伦理委员会审核。
1.2 资料收集和指标检测 收集患者临床资料,包括性别、年龄、原发疾病类型、Child分级、血型、终末期肝病模型(model for end-stage liver disease, MELD)评分(以总胆红素、国际标准化比值、血清肌酐水平为基础评价肝脏疾病患者肝功能储备及预后)[8]、输注红细胞量、输注血浆量、巨细胞病毒(cytomegalovirus,CMV)感染、细菌和真菌感染(根据医院感染相关诊断标准进行诊断)、急性排斥反应(通过病理学检查结果及Banff标准判定肝组织汇管区淋巴细胞浸润、胆管损伤、肝细胞损伤和标志性血管内皮炎)、术后1周肝动脉阻力指数(resistive index, RI)值(经多普勒彩色超声检查诊断)、供体冷缺血时间、供体灌注及保存液[威斯康星大学器官灌注保存液(the University of Wisconsin solution, UW)、组氨酸-色氨酸-酮戊二酸器官灌注保存液(Histidine-tryptopha ketoglutarate, HTK)]。

2 结果
2.1 ITBL发生情况 术后3月,本组发生ITBL 37例(11.9%),其中14例为肝内胆管病变,19例为肝外胆管病变,4例为肝内外多发胆管病变(图1,图2)。
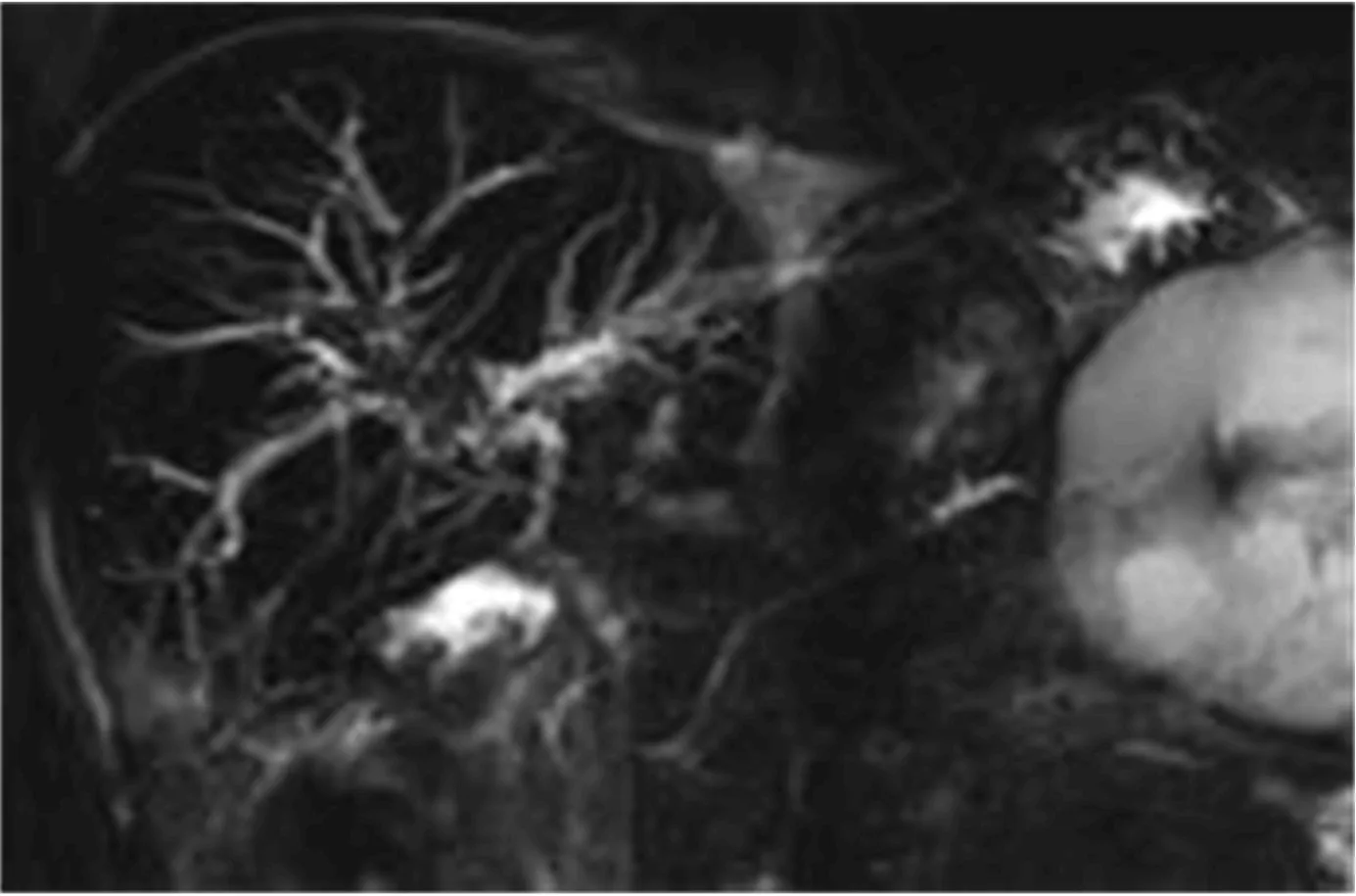
图1 肝移植术后患者MRCP表现 提示胆道缺血性病变

图2 肝移植术后患者MRCP表现 提示胆道缺血性病变
2.2 ITBL发生的单因素分析 经单因素分析,输入红细胞的量、急性排斥反应、术后1 周RI、输入血浆的量、冷缺血时间(≥11.5 h)为影响患者发生ITBL的影响因素,差异具有统计学意义(P<0.05,表1)。

表1 ITBL发生的单因素分析
2.3 ITBL发生的多因素分析 经Logistic回归分析,输入血浆的量、RI(术后1 w)、急性排斥反应和冷缺血时间(≥11.5 h)是ITBL发生的独立危险因素,差异具有统计学意义(P<0.05,表2)。
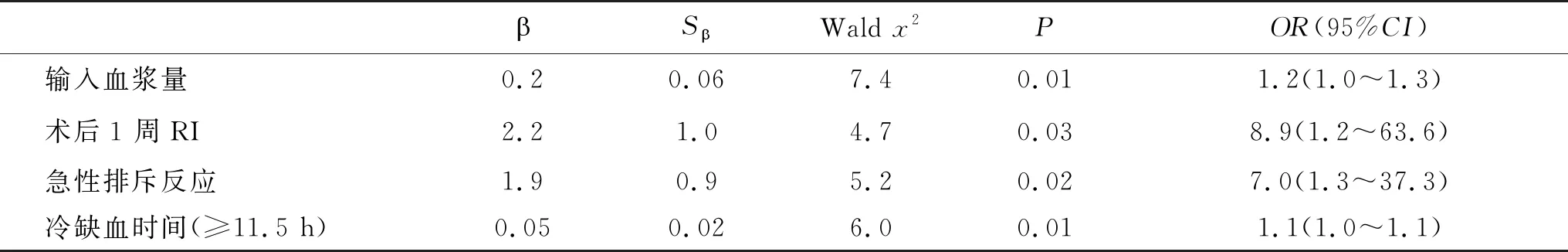
表2 ITBL发生的多因素分析
3 讨论
近年来,逝世者器官捐献工作快速发展,我国器官移植例数位居世界第二,肝移植占比也较高。随着免疫抑制药物、器官保存手段的更新以及肝移植外科手术技巧的提高,肝移植临床应用逐渐增多,肝移植患者已经可以得到相当理想的远期预后,5 a生存率达到60%~80%,术后并发症作为其预后的主要影响因素备受关注[9-11]。术后早期发生的胆漏、吻合口狭窄和T 形管错位等胆道相关并发症多为手术操作所致,手术技术的逐渐成熟可使其发生率呈下降趋势[12]。但ITBL为不明原因引起的肝移植术后肝内胆道病变,病理学机制尚在探索中,目前尚无特效的治疗方法,其损伤为不可逆性,患者预后极差,可能需要再次进行肝移植手术[13,14]。因此,对肝移植术后ITBL发生的危险因素进行分析和研究具有重要的意义,可帮助提高受者的生存时间,改善其生活质量。
文献报道肝移植术后ITBL发生率差异较大,为5%~20%[15],分析其可能原因之一为部分文献中ITBL定义并不明确,将供、受体间 ABO 血型不相容肝移植以及动脉出现血栓患者等非吻合相关但具有明确原因的肝内胆管狭窄也纳入ITBL范畴,而目前ITBL主要描述肝移植后原发胆管疾病。本研究结果显示312例肝移植受者术后发生ITBL者37例(11.9%),接受肝移植术的患者原发疾病以原发性肝癌为主,为143例(45.8%),14例ITBL病变部位位于肝内胆管,19例位于肝外胆管病变,4例为累及肝内外多发胆管病变。肝癌为乙型肝炎、丙型肝炎、非酒精性脂肪性肝炎相关肝纤维化发展的终末阶段,持续性慢性肝脏炎症反应、氧化应激及肝纤维化,可通过DNA修复、蛋白质降解、细胞周期及凋亡的相关信号通路介导不可逆的体细胞遗传/表观遗传改变,导致肝癌的发生[16]。据统计,2012年全世界约有78万新发肝癌病例,我国的新发病例数占其总病例的50%,且呈大幅上升趋势[17],肝移植为肝癌等终末期肝脏疾病有效的治疗方法,相对肝切除治疗,治疗后肿瘤复发率低、复发时间更长。肝癌发病率高且肝移植治疗肝癌效果明确,因此本研究中肝癌患者为肝移植的主要受者,与既往研究一致[18]。ITBL的主要临床诊断依据为胆道造影结果显示胆道内出现狭窄、扭曲和扩张,甚至发生胆道脓肿或胆道消失,可造成移植物丢失。本研究结果显示ITBL好发部位为肝内或肝外,与既往研究认为ITBL多为多发的累及肝内外胆管病变有一定的差异[19],可能原因为纳入研究的ITBL定义及患者个体存在差异。
单因素分析显示术后1 周肝动脉RI、输入红细胞的量、急性排斥反应、输入血浆的量和冷缺血时间为影响患者发生ITBL的影响因素。ITBL的临床表现多样化且不具备特征性,既可不表现出任何临床症状和体征,也可表现为黄疽、肝功能损害和胆管炎症等。RI值表示动脉收缩期与舒张期血流速度变化程度,可提示肝脏动脉阻塞情况,并间接反映胆管血供[20]。众所周知,胆管无肝门静脉分支,动脉系统为其单一血供来源,肝移植术中均进行胆总管横断及解剖分离处理,虽然同时进行动脉重建,通过吻合动脉增加血供,但仍会对胆管血供造成不良影响,而胆管对缺血性损伤十分敏感。研究显示肝移植术后1 d,RI最高,1周内逐渐降低并趋于平稳,术后1周可接近健康正常人群[21]。本研究中术后1 周RI为ITBL的影响因素,与术后1周RI所反映的患者肝脏动脉血流状况一致。肝脏血供极为丰富,进行肝移植手术往往伴随大量失血,在输入红细胞及血浆的量较多的患者,往往术中失血较多,患者术后恢复能力较弱,容易发生血供不足,导致胆道损伤,诱导ITBL的发生。冷缺血时间内肝脏供体被保存液包裹,并置于低温环境,可尽量维持肝脏供体活性,但肝脏内凝血物质底物仍可被激活,并导致环绕胆管的动脉血管网形成血栓,破坏胆管内皮细胞,最终导致移植术后发生ITBL。对951例原位肝移植患者进行随访调查,也发现平均胆道重建时间、手术时间和冷缺血时间较长的患者ITBL发生率较高[22]。急性排斥反应在肝移植术后患者较为常见,在急性排斥反应时,胆管上皮细胞表达细胞粘附分子和抗原,可被活化的T淋巴细胞和B淋巴细胞识别,T淋巴细胞可直接攻击胆管上皮细胞,并可浸润胆管基底膜,导致胆管壁断裂和动脉炎,发生ITBL。
Logistic回归分析结果显示输入血浆的量、术后1周RI、急性排斥反应、冷缺血时间为影响患者发生ITBL的独立影响因素。因此,本研究组成员认为,为降低肝移植术后出现ITBL,可采取以下措施:①应尽可能缩短冷缺血时间,尤其是供体年龄偏大或为长期住院的患者。当受体病情较为危急的情况下,应避免肝脏冷缺血时间长于11.5 h,以减少保存因素造成胆管微循环损伤[23],降低ITBL的发生率;②输入血浆的量为独立影响因素,提示手术过程与ITBL的发生密切相关,临床医生应注重提高肝移植术手术操作技术,做好充分的术前准备,对手术流程、患者病情和供体状况充分了解,缩短肝切除期、无肝期和移植肝血管重建期,减少肝脏出血[24],减少输入血浆量;③在对供肝修整时,应减少对胆管的分离,妥善修整从腹腔干开始向肝侧解剖的动脉分支,辨认细小分支并结扎。在受体接受供肝游离肝动脉时,尽量降低对胆道周围血管的破坏[25],加快肝内动脉血管吻合;④在选择匹配供体时,积极探索控制急性排斥反应的方法,根据患者年龄、感染情况、机体免疫功能,及时调整免疫抑制剂用药方案和用量,降低急性免疫损伤。
