基于多数据库分析肝细胞癌组织FAM49B基因水平及其临床意义
2020-05-27崔喆,徐兰
崔 喆,徐 兰
肝细胞癌(hepatocellular carcinoma,HCC)恶性程度高、进展快、易转移、发病隐匿、预后差[1-3]。49序列相似的家庭成员B (family with sequence similarity 49 member B,FAM49B)与FAM49A和FAM49C同属于FAM49基因家族,均包含典型的未知功能结构域1349(domain of unknown function,DUF1349)。FAM49B是定位在染色体8q24、编码324个氨基酸、分子量为37 kDa的高度保守蛋白,FAM49B在胰腺导管腺癌中呈低表达,且能抑制肿瘤细胞增殖和侵袭[4]。目前,国内外关于 FAM49B基因与HCC发病的相关报道还不多,其在HCC组织的功能还不清楚。本研究基于大数据库分析了HCC组织FAM49B表达的变化及其特征,旨在为HCC患者的病情监测和预后判断提供新依据。
1 资料与方法
1.1 HCC组织和正常肝组织FAM49B基因水平的比较 在Oncomine数据库[5]筛选FAM49B基因,设定条件为:“gene: FAM49B”、“cancer type: liver cancer”、“analysis type:cancer vs. normal analysis”。收集各HCC芯片FAM49B基因水平的差异结果,并行荟萃分析。在GEPIA[6]中设定条件为:“gene: FAM49B”、“expression diy:boxplot”、“cancer type:LIHC”,获得HCC组织和正常组织FAM49B基因水平的差异。
1.2 不同临床和病理学特征的HCC组织FAM49B基因水平比较 自TCGA数据库下载相关数据。根据HCC患者FAM49B基因水平,将患者划分为FAM49B高水平组和低水平组。应用SPSS 21.0软件行x2检验。
1.3 不同FAM49B基因水平的HCC患者预后比较 在Kaplan Meier Plotter数据库[7]“mRNA RNA-seq”中选择“liver cancer”,检索“FAM49B”目的基因,按照自动选择最佳截断点“auto select best cutoff”进行分组,将FAM49B分为高水平组和低水平组,绘制HCC患者的生存曲线。
1.4 FAM49B启动子区甲基化分析 MethHC数据库[6]系来源于TCGA数据库。利用MethHC[8]平台分析FAM49B启动子区甲基化水平在正常肝组织与HCC组织中的差异,并应用线性回归分析FAM49B甲基化程度与基因水平的关系。
1.5 FAM49B相互作用蛋白网络分析 在String数据库[9],根据文献报道、数据库收录数据和分子间共表达蛋白相关性等证据给出蛋白质间存在相互作用的可信度评分。该分数越接近1,提示分子间存在相互作用的可信度越大,而分数越接近0,说明目前的证据还不足,其可信度较低。在String中搜索蛋白质名称“FAM49B”,选择物种“homo sapiens”,获取FAM49B相互作用蛋白网络。
1.6 基因集富集分析 利用基因集富集分析(gene set enrichment analysis, GSEA)研究FAM49B 基因水平与京都基因和基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路基因集的相关性。设置随机组合次数为1000次,计算标准化的富集系数。
2 结果
2.1 HCC组织和正常肝组织FAM49B基因水平的比较 Oncomine数据库分析结果显示,在Chen Liver et al[10]、Guichard Liver et al[11]、Guichard Liver 2 et al[11]、Mas Liver et al[12]、Roessler Liver et al[13]、Roessler Liver 2 et al[13]、TCGA Liver、Wurmbach Liver et al[14]等8项研究中,HCC组织FAM49B基因较正常肝组织呈显著高水平(P1=5.68×10-12,P2=9.99×10-14,P3=1.08×10-14,P4=3.75×10-5,P5=2.36×10-5,P6=5.97×10-48,P7=6.61×10-14,P8=4.63×10-5)。荟萃分析这8项研究结果表明与正常肝组织相比,FAM49B在HCC组织中的基因水平显著升高(Median Rank=1063.5,P=1.18×10-5,图1)。利用GEPIA分析TCGA数据库中的529例样本,结果显示FAM49B在HCC组织(369例)中的基因水平显著高于正常肝组织(160例,P<0.01,图2),与Oncomine数据库结果一致。
2.2 不同临床和病理学特征的HCC患者FAM49B基因水平比较 从TCGA数据库中可获取FAM49B基因水平及361例HCC患者的临床和病理学特征数据。根据FAM49B基因水平中位数将HCC患者分为FAM49B高水平组(n=181例)和低水平组(n=180例)。经SPSS 21.0统计分析,结果显示,不同性别、有无肝硬化和不同肿瘤分化程度的HCC患者FAM49B基因水平不同,而不同年龄、肿瘤大小、病理学分期、甲胎蛋白(alpha-fetoprotein,AFP)水平和是否存在脉管侵犯的HCC患者FAM49B基因水平无显著差异(P>0.05,表1)。

图1 Oncomine数据库中HCC组织与正常肝组织FAM49B 基因水平的比较
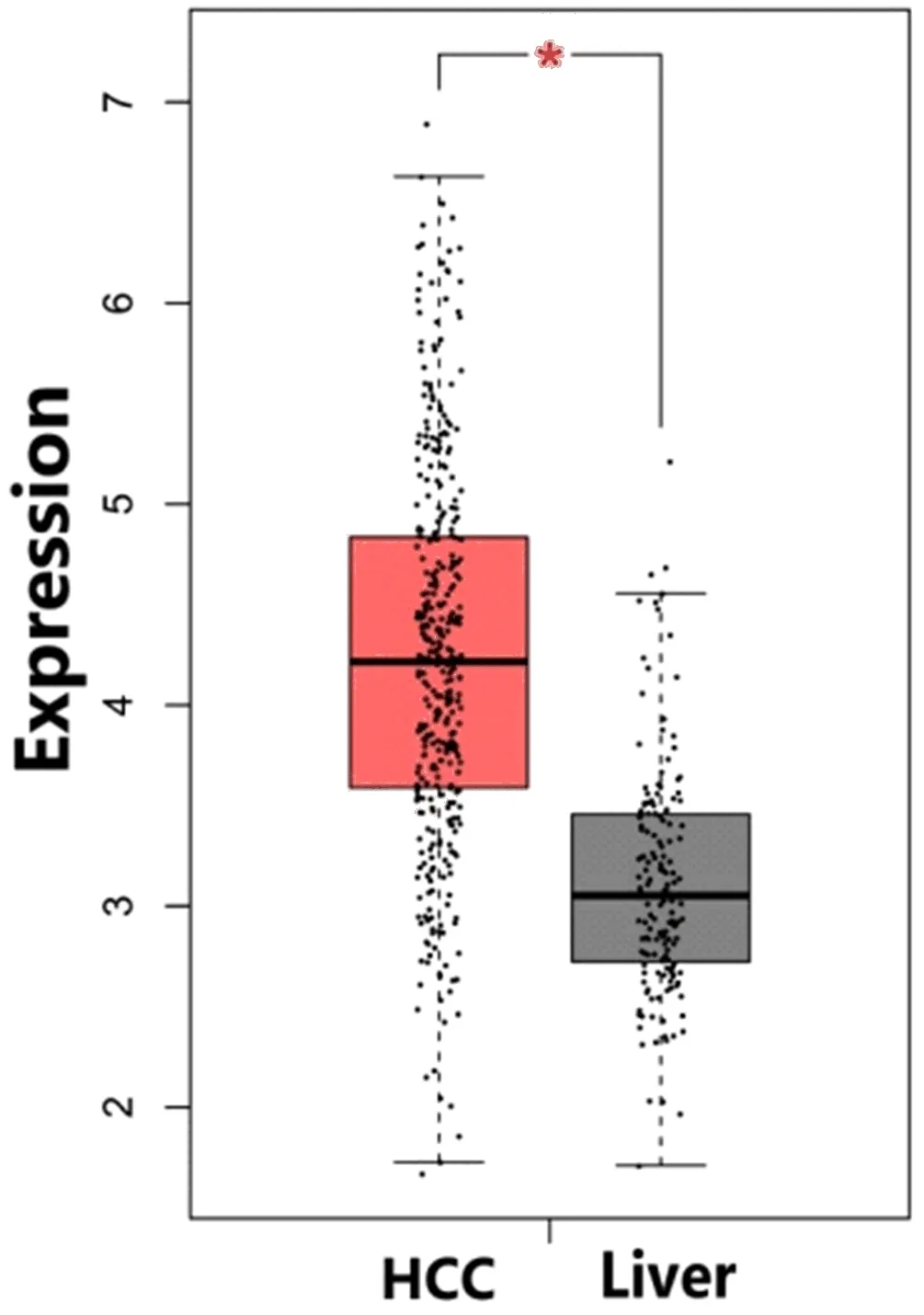
图2 TCGA数据库529个样本FAM49B水平 (红色为369例HCC,灰色为160例正常肝组织,*P<0.01)
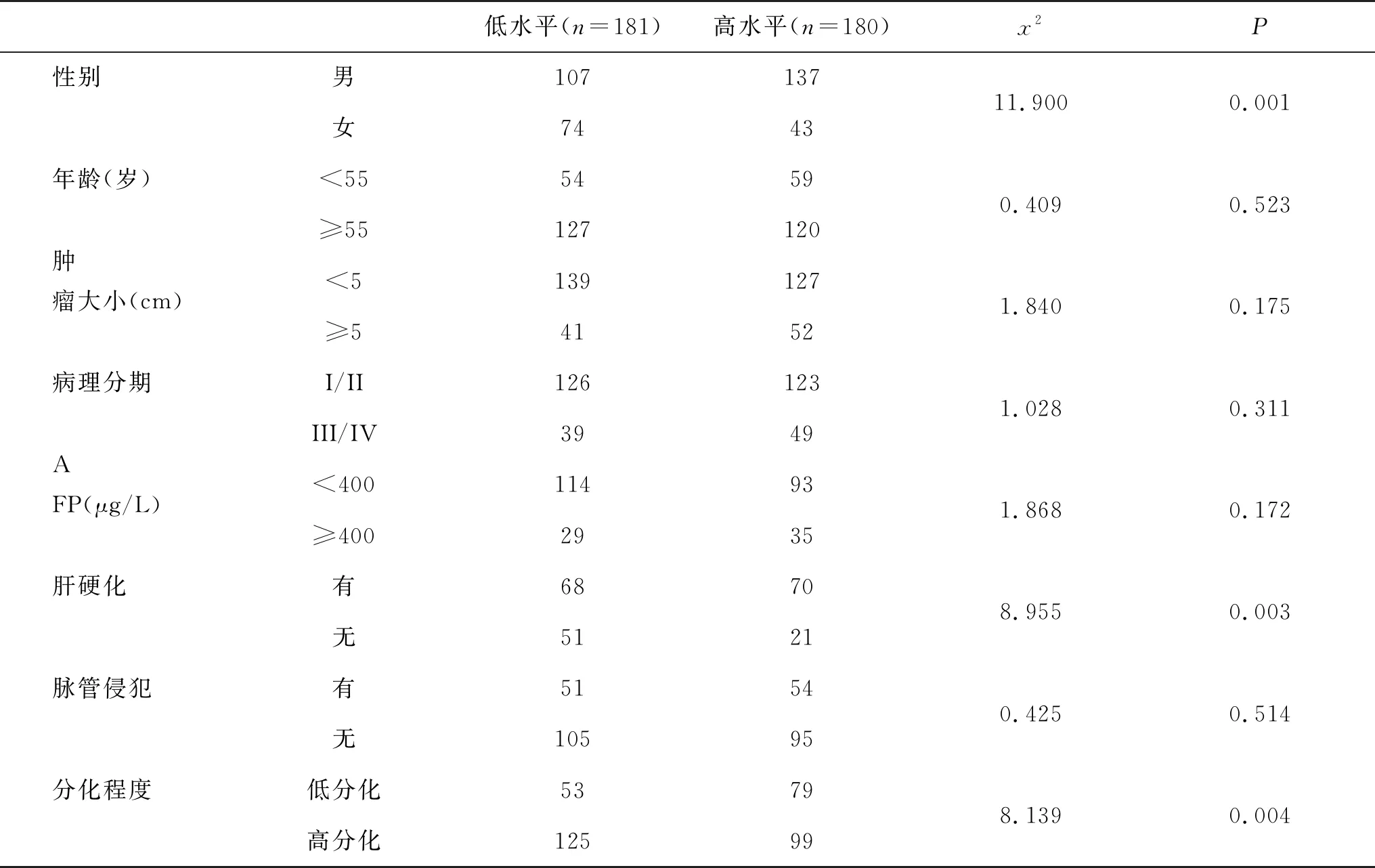
表1 不同临床和病理学特征的HCC患者FAM49B基因水平比较(TCGA数据库)
2.3 不同FAM49B基因水平的HCC患者预后比较 对Kaplan Meier Plotter数据库分析显示,105例高水平FAM49B患者中位生存时间为41个月,而259例低水平患者的中位生存时间为71个月,即FAM49B高水平组患者的总体生存期显著短于低水平组(HR=1.8,P=0.0012),表现为癌基因特性(图3)。
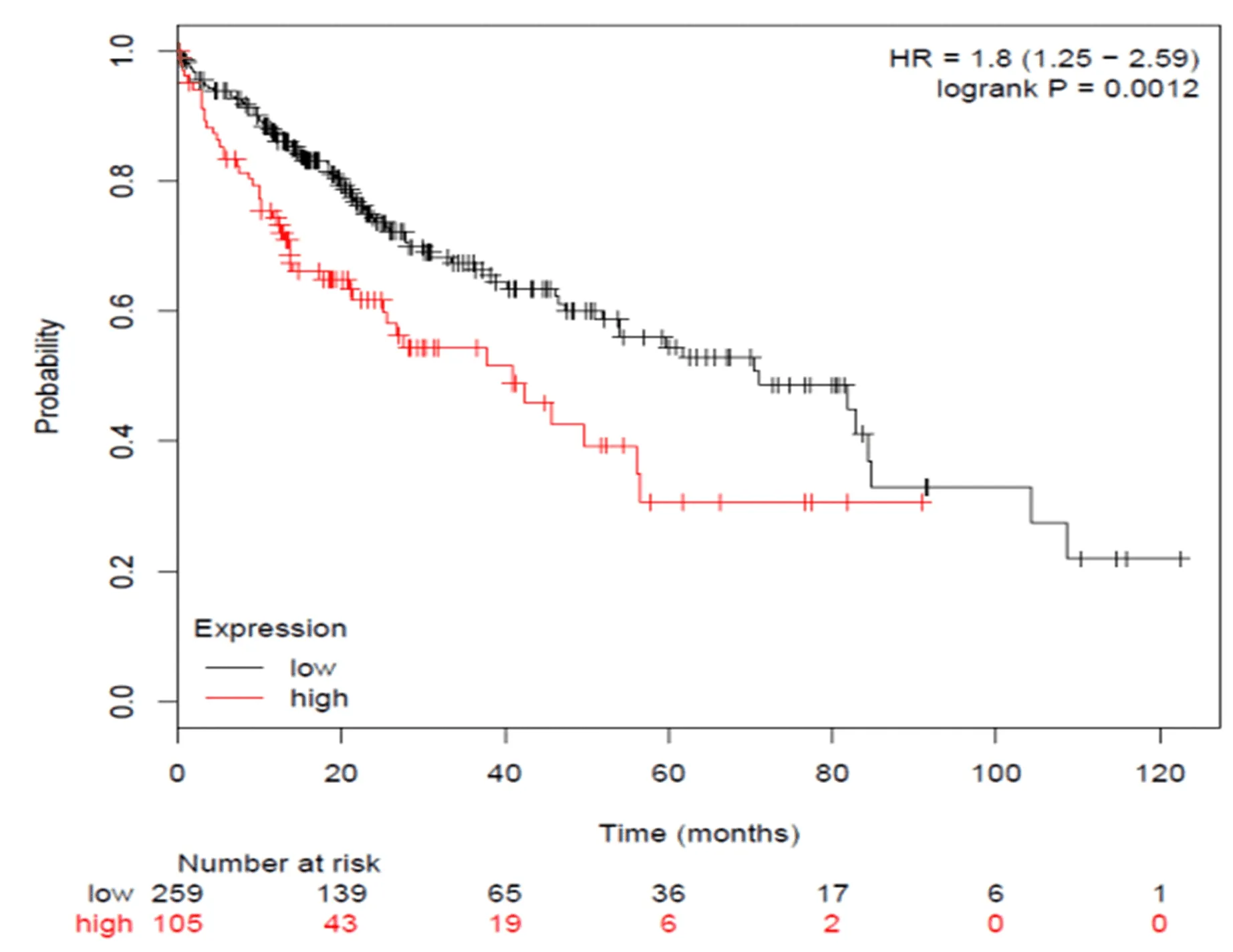
图3 不同FAM49B基因水平的HCC患者预后比较
2.4 FAM49B启动子区甲基化水平分析 利用MethHC分析TCGA数据库中的HCC病例,结果显示FAM49B的转录模板为NM_001256763,与正常肝组织相比,HCC组织FAM49B启动子区甲基化水平显著降低(P<0.005,图4A),其FAM49B启动子区甲基化程度与基因水平呈负相关(P=0,图4B)。

图4 FAM49B启动子区DNA甲基化水平分析 A: 正常肝组织与HCC组织FAM49B启动子区甲基化水平比较,**P<0.005;B:HCC组织FAM49B启动子区甲基化程度与基因水平的关系
2.5 FAM49B相互作用蛋白网络 利用String数据库分析FAM49B可能存在的蛋白质间相互作用,结果表明,与FAM49B相互作用的Score排名前10的蛋白分别为SERPINA1(Score=0.917)、ISLR(Score=0.905)、FERMT3(Score=0.905)、VEGFB(Score=0.903)、NHLRC2(Score=0.903)、ACTN4(Score=0.903)、A2M(Score=0.902)、SERPINE1(Score=0.902)、SRGN(Score=0.902)和SPARC(Score=0.902,图5)。

图5 FAM49B蛋白的相互作用
2.6 FAM49B功能富集分析 GSEA研究结果显示,FAM49B mRNA高水平组织富集到细胞凋亡(NES=1.616,P=0.022,FDR=0.040)、细胞周期(NES=1.846,P=0.002, FDR=0.023)、调节自噬(NES=1.800,P=0.002, FDR=0.023)、P53信号通路(NES=1.723,P=0, FDR=0.019)等相关基因集,且其mRNA水平与上述通路中的基因水平呈正相关(图6)。
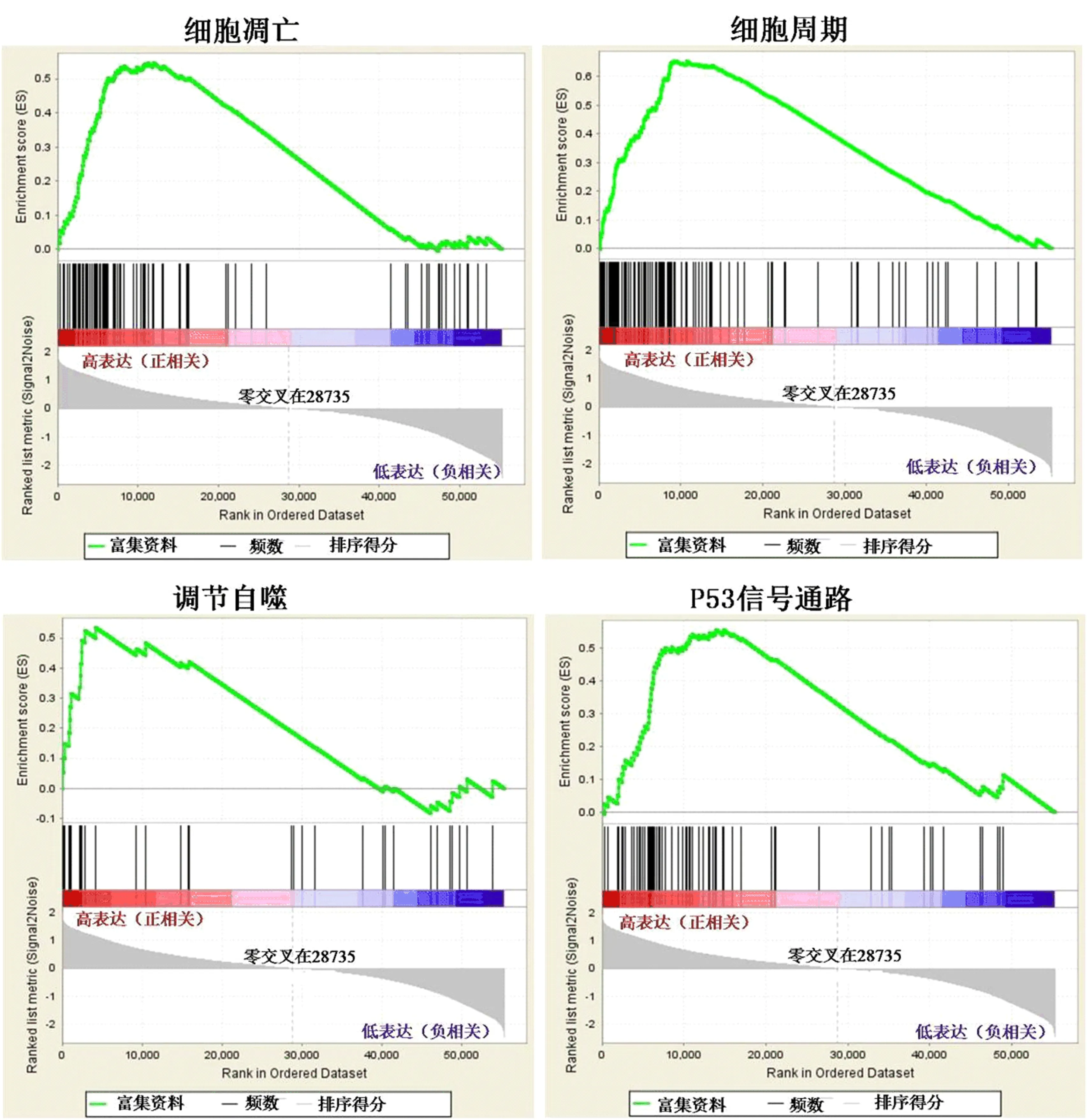
图6 FAM49B mRNA高水平相关基因集的富集
3 讨论
目前,国内外关于FAM49B的研究报道甚少。Chattaragada MS et al[4]报道FAM49B在胰腺导管腺癌呈低表达,且通过调节肿瘤线粒体氧化还原反应和代谢抑制胰腺导管腺癌细胞增殖和侵袭。但FAM49B在HCC发病过程中的功能尚不清楚。
本研究对Oncomine和GEPIA数据库分析均显示HCC组织FAM49B基因水平显著高于正常肝组织,有力地证实FAM49B在HCC组织中呈高水平状态。在2019年,马德里国家心脏病研究中心在JEM杂志上发表声明,认为男性罹患HCC的风险明显高于女性。据统计,该病的男女发病之比为7∶1~10∶1左右。主要原因归于脂肪分泌的一种激素,即脂联素在女性体内水平较高,可以阻止肝细胞癌变,而脂联素水平降低是男性发生HCC风险增加的原因[15]。研究表明肝硬化是中国肝癌患者发病的主要危险因素,80%~90%肝癌患者发生于乙型肝炎肝硬化[16]。细胞分化程度越低常提示肿瘤的恶性程度越高。研究表明在接受根治性切除的早期HCC患者,低分化组预后比高分化组差[17]。本研究结果表明不同性别、有无肝硬化和不同肿瘤分化程度的HCC患者肿瘤组织FAM49B基因水平显著不同。本研究结果显示FAM49B高水平组HCC患者总体生存期更短,预后更差,即FAM49B表现为癌基因特性,提示FAM49B有可能成为预测HCC患者预后的候选生物标志物。
本研究通过MethHC平台发现与正常肝组织相比,癌组织FAM49B启动子区甲基化水平降低,且FAM49B启动子区甲基化程度与基因水平呈负相关,提示FAM49B启动子区甲基化水平降低可能与HCC发生发展相关。王刚等[18]报道基因体DNA甲基化可能通过阻断启动子的启动来增加转录活性,可验证本研究发现的在HCC组织FAM49B启动子区甲基化水平降低的结论。
锌指RNA结合蛋白(ZFR)通过与FAM49B相互作用促进结肠癌和HCC细胞增殖[19]。研究[20]表明丝氨酸蛋白酶抑制剂A1(SERPINA1)在HCC患者体内表达水平增高,相反SERPINA1突变不会促进HCC的发生[20]。本研究结果提示FAM49B可能通过与SERPINA1蛋白相互作用在HCC发生发展过程中发挥功能,与文献报道基本一致。研究FAM49B相互作用蛋白可为FAM49B在HCC发病中的功能研究提供新线索。
为进一步探讨FAM49B在HCC发病过程中发挥作用的可能机制,本研究利用GSEA预测FAM49B在肿瘤发生调控中的可能信号通路是调节自噬、细胞凋亡、细胞周期和P53信号通路等。自噬是肝细胞在应激状态下维持细胞稳态和质量控制的重要反应。自噬在HCC发生过程中发挥双重机制,即自噬可以抑制HCC的发生,但也可以作为肿瘤启动子,促进HCC的发展[21]。研究[22]表明细胞周期调控是抗癌效应的主要标志,细胞周期失调可诱导癌基因激活及抑癌基因失活,进而促进肿瘤的发生发展。细胞凋亡可维持机体自身稳定,机体通过细胞凋亡消除衰老、损伤或突变的细胞。当细胞凋亡异常时,可诱导肿瘤的发生。P53是重要的抑癌基因,具有调控细胞周期、细胞凋亡及维持基因组稳定性等功能,对预防肿瘤的发生具有重要意义。P53发生突变或缺失可导致HCC的发生[23]。本研究发现FAM49B在HCC发病过程中发挥功能的信号通路可为HCC发生机制研究提供新的线索和思路。
综上所述,多数据库分析结果显示HCC患者癌组织FAM49B呈高水平,其基因水平与预后相关,表现出癌基因特性。它有望成为HCC防治研究的新靶点。本研究可为后续HCC相关基础及临床研究提供线索。
