稳定表达HBx的人肝细胞系7702的建立*
2020-05-27庞丽君郭向华乔录新时红林王珊珊
庞丽君,石 英,郭向华,乔录新,时红林,王珊珊,刘 凯
HBVX蛋白(hepatitis B virus X protein,HBx)是由HBV编码的蛋白之一,基因长度为465 bp,编码154个氨基酸,是一种潜在的多功能致癌蛋白,在慢性乙型肝炎进展为肝硬化和肝细胞癌(hepatocellular carcinoma, HCC)过程中发挥重要作用[1,2]。长期HBV感染、HBV大量复制、HBV不同的基因型、HBV DNA与宿主肝细胞基因组的整合、特定的HBV突变体和HBV编码的癌蛋白,如HBx和截短的pres2/s蛋白等,都是HBV促进HCC发展的危险因素[3]。虽然HBx基因是HBV基因组中最小的片段,但它是一种多功能的病毒调节因子, 通过调节细胞和病毒的转录活性、蛋白质降解、信号传导途径等,直接或间接地影响 HBV复制,并且能调控细胞周期和细胞凋亡,从而在慢性肝炎和肝硬化发展至肿瘤过程中发挥作用[4, 5]。HBx作为病毒反式激活因子,通过与肿瘤微环境中不同组分长期相互作用导致肿瘤的发生[6]。为了进一步探讨HBx基因在乙型肝炎相关HCC发生发展过程中的调控机制,我们构建了HBx表达质粒,选取肝病研究最常用的人正常肝细胞HL-7702(normal human liver cell 7702,HL-7702)系,在HL-7702细胞中转染HBx重组质粒并筛选出可稳定表达HBx的HL-7702细胞系,现报道如下。
1 材料与方法
1.1 细胞与试剂 表达HBV的人肝癌细胞系HepG2.2.15细胞、人肾上皮细胞系293细胞(HEK 293)和人正常肝细胞系7702(HL-7702)细胞由本实验室保存。pIRES载体购买于Clontech公司。 T4连接酶、限制性内切酶Nhe I和Xho I为Fermentas公司产品。Taq DNA聚合酶、大肠杆菌DH5α、反转录试剂盒、DNA胶回收试剂盒、质粒小提试剂盒、DNA marker、蛋白marker等购自北京博迈德基因技术有限公司。PBS缓冲液、Western blot电泳缓冲液、Western blot电转缓冲液、RIPA蛋白裂解液等购自北京索莱宝科技有限公司。氨苄青霉素、TRIZOL、G418和DMEM培养基为Sigma公司产品,胎牛血清为Gibco公司产品。转染试剂Lipofectamine3000购自Thermo fisher 公司。Western blot和免疫荧光检测所用抗HBx抗体购自Abcam公司。胰蛋白胨、酵母提取物和琼脂糖等化学试剂购自OXOID公司。
1.2 扩增目的基因 采用TRIZOL提取HepG2.2.15细胞总RNA,并逆转录为cDNA,应用以下引物扩增HBx基因片段。扩增引物序列如下,上游引物P1: 5’-CGGGCTAGCATGGCTGCTAGGGTG- 3’,下游引物P2:5’- CCGCTCGAGCTAGGCAGAGGTGAA- 3’,Nhe I内切酶识别序列为CGGCTAGCCG, Xho I内切酶识别序列为CCCTCGAGGG。PCR反应体系如下: 2×PCR mix取 25μl;上游引物P1取 1μl,下游引物P2 取1μl;cDNA模板取2μl,dH2O取 21μl,总体积为50μl。PCR扩增条件:95℃预变性5 min,95℃变性30 s,57℃复性30 s,72℃延伸30 s,共30个循环。72℃再延伸5 min。扩增产物经1.5% 琼脂糖凝胶电泳鉴定,利用胶回收试剂盒对符合预期大小的片段进行切胶回收。
1.3 构建pIRES-HBx表达载体 利用限制性内切酶Nhe I和XhoI,分别对上述PCR产物和载体pIRES (Clontech)进行双酶切,两者的酶切条件分别为37℃,30 min和37℃,2 h。将上述酶切产物进行琼脂糖凝胶电泳,然后利用切胶回收目的基因和载体片段。用T4 DNA连接酶将酶切后回收的目的基因片段连接到载体pIRES的Nhe I和Xho I酶切位点之间,反应体系和反应条件如下:T4 DNA连接酶1 μl,5×T4 DNA连接酶缓冲液2μl,载体pIRES 1μl,PCR产物4μl,dH2O 2 μl,总体积为10μl;室温孵育10 min。然后,取上述连接产物5μl加入DH5α大肠杆菌50μl中进行转化,用氨苄青霉素进行筛选,次日挑取多个单克隆,37℃过夜摇菌后进行小型质粒提取,将构建的重组质粒命名为pIRES-HBx。
1.4 重组质粒的鉴定 利用Nhe I和XhoI限制性内切酶对提取的多个重组质粒pIRES-HBx进行Nhe I和Xho I双酶切,酶切体系和条件如下: pIRES-HBx重组质粒1μg, Nhe I和XhoI限制性内切酶各1μl,10×酶切缓冲液 2μl, 补dH2O至总体积为20μl。将上述酶切混合物放入37℃水浴锅孵育30 min。然后,经1.5% 琼脂糖凝胶电泳鉴定插入片段的大小。取片段大小正确的多个重组质粒,送到博迈德公司进行测序和鉴定,最后选择测序结果与原序列一致的重组质粒。
1.5 细胞重组质粒表达检测 利用Lipofectamine 3000转染试剂,将空白载体pIRES和 pIRES-HBx质粒分别转染至HEK 293细胞和HL-7702细胞。细胞培养48 h后收集细胞,用TRIZOL和 RIPA裂解液提取mRNA和蛋白,分别采用Real-time PCR和Western blot法检测HBx基因mRNA水平和蛋白表达情况。
1.6 稳定转染细胞系的筛选和鉴定 将pIRES对照载体和pIRES-HBx重组质粒,分别转染至HL-7702细胞。待细胞培养48 h后,用1 mg/ml G418抗生素筛选细胞。筛选14 d后,继续用0.5 mg/ml G418 DMEM完全培养基维持培养两个细胞系1 w。然后,采用免疫荧光技术检测HBx蛋白表达,在荧光显微镜下拍照。
2 结果
2.1 HBx CDS片段扩增情况 首先,以HepG2.2.15细胞cDNA作为模板,用上述引物P1和P2扩增HBx基因,扩增产物经琼脂糖凝胶电泳鉴定,可见单一条带,其片段大小与预期的465 bp一致(图1)。
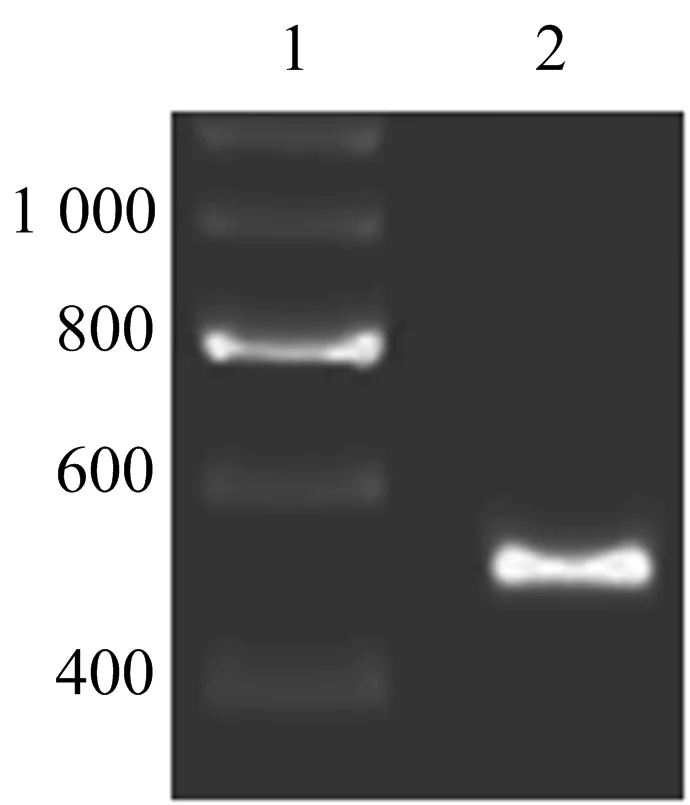
1:DNA marker;2:PCR产物图1 PCR扩增获得的HBx基因片段 利用HepG2.2.15细胞cDNA和特异性引物扩增HBx基因片段,可见单一明亮条带,大小与目的基因相符
2.2 HEK 293细胞和HL-7702细胞HBx mRNA水平检测情况 将上述扩增产物连接至pIRES载体,构建过表达HBx的重组质粒pIRES-HBx。经双酶切和测序鉴定,插入载体的DNA片段符合HBx CDS区大小,测序结果与HBx CDS序列完全一致。为了进一步探讨重组载体在细胞系是否能正常工作,我们选择了两个细胞系HEK 293细胞和HL-7702细胞,在这两个细胞系中分别转染pIRES载体和pIRES-HBx质粒。48 h后,收集细胞,提取RNA并逆转录成cDNA,经实时荧光定量PCR法检测两种细胞HBx mRNA水平,以GAPDH基因作为内参,结果发现转染pIRES-HBx质粒的两种细胞HBx mRNA水平均显著高于对照组细胞(图2)。
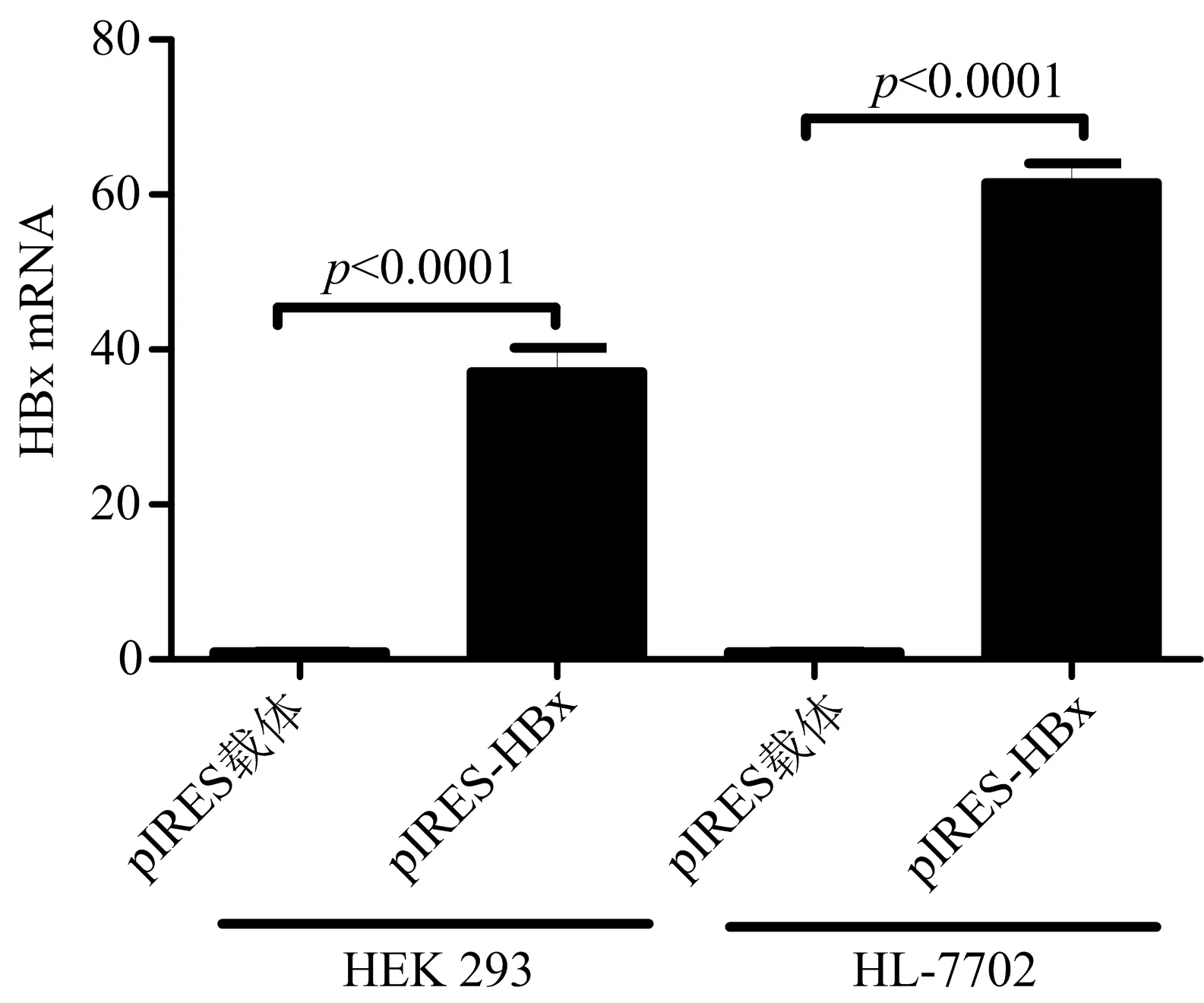
图2 荧光定量PCR法检测细胞HBx mRNA水平 在HEK 293和 HL-7702细胞系,分别转染pIRES载体和pIRES-HBx重组质粒,48 h后收集细胞提取RNA并通过荧光定量PCR法检测,结果在两个细胞系中,转染pIRES-HBx重组质粒细胞HBx mRNA水平显著高于对照细胞
2.3 HBx蛋白表达情况 我们在HEK 293细胞和HL-7702细胞,分别转染pIRES载体和pIRES-HBx质粒。 48 h后收集细胞,加RIPA裂解液,提取总蛋白,行蛋白定量后,采用Western blot法检测HBx蛋白表达,以β-actin作为蛋白对照。结果发现,无论在HEK 293细胞还是HL-7702细胞,与转染pIRES载体对照组比,转染pIRES-HBx质粒细胞HBx蛋白表达显著增强(图3)。我们从mRNA水平和蛋白表达两个方面验证了pIRES-HBx质粒能够在转染细胞过量表达HBx,可以用于下一步稳定筛选细胞系。
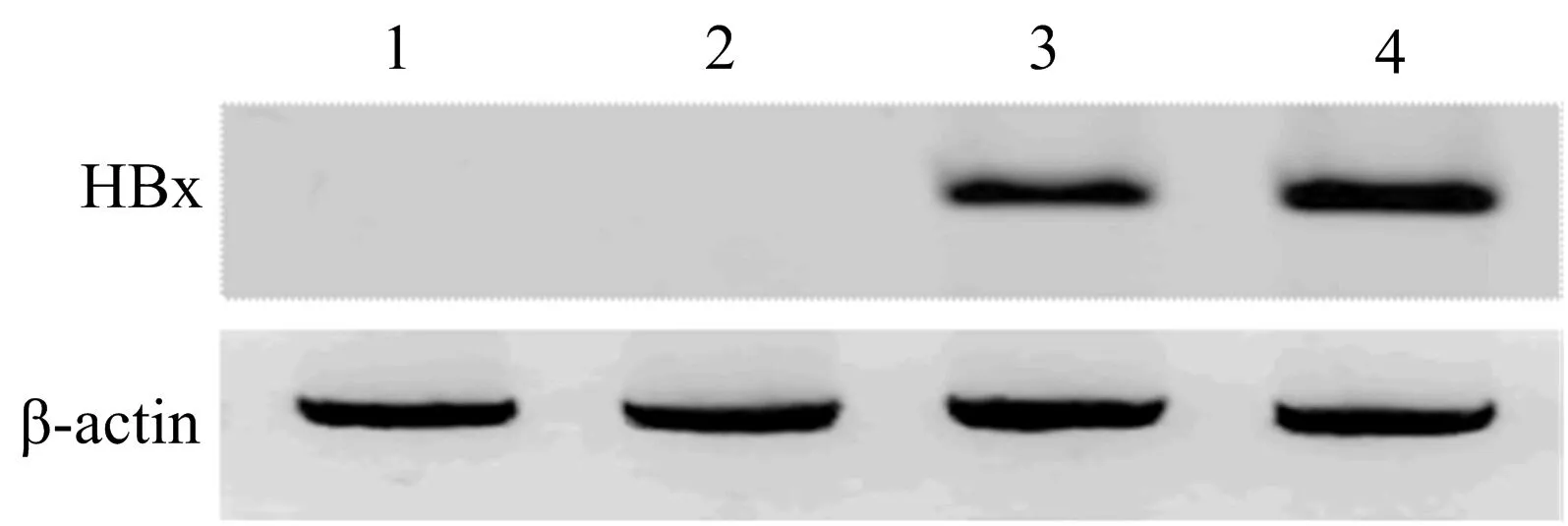
1:HEK 293细胞转染pIRES; 2:HL-7702 细胞转染 pIRES; 3:HEK 293细胞转染pIRES-HBx; 4:HL-7702细胞转染pIRES-HBx图3 免疫印迹法检测细胞HBx蛋白表达 在HEK 293和 HL-7702细胞,分别转染pIRES载体和pIRES-HBx重组质粒,48 h后收取细胞,裂解,采用Western blot法检测,结果显示转染pIRES-HBx重组质粒细胞HBx蛋白大量表达
2.4 可稳定表达HBx的人7702细胞的构建与鉴定 首先,在HL-7702细胞,转染pIRES载体和pIRES-HBx质粒,转染48 h后在培养基里加入高浓度的G418,筛选细胞,最后用0.5 mg/ml G418 DMEM完全培养基维持培养,筛选稳定转染HBx的HL-7702细胞系。为了验证稳定筛选是否成功,用兔抗人HBx单克隆抗体和免疫荧光技术检测HBx蛋白表达。在转染pIRES-HBx质粒的细胞,可见HBx大量表达(图4),由此证明我们成功构建了稳定表达HBx的HL-7702细胞系,大量扩增细胞后将细胞冻存于液氮中保存,为后续对HBx的调控机制及其功能研究提供了细胞基础。
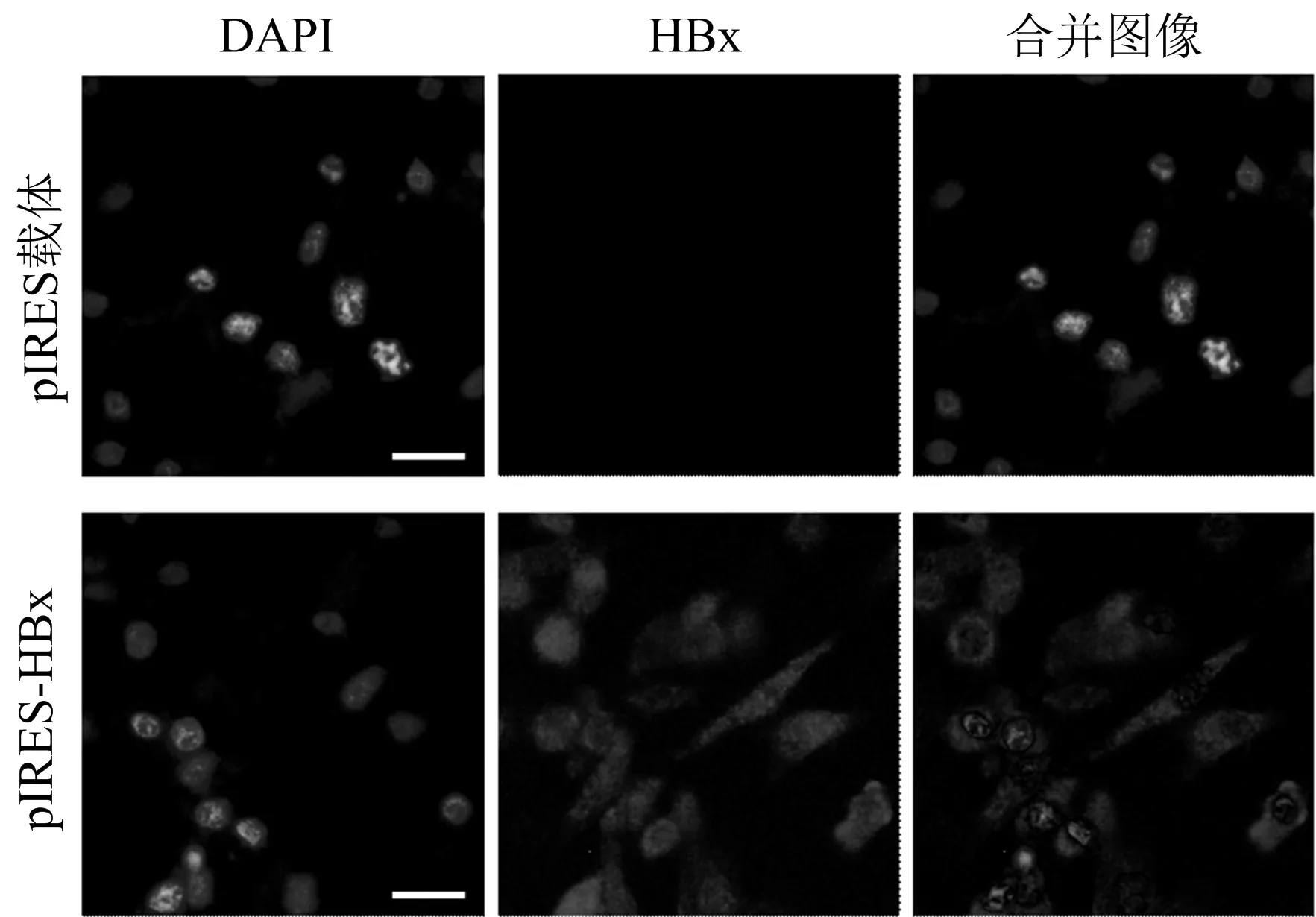
DAPI: 细胞核荧光染料;HBx:抗HBx抗体;合并图像:将DAPI和HBx荧光图合并图4 免疫荧光法检测稳定转染的HL-7702细胞HBx表达 在HL-7702细胞,转染pIRES载体和pIRES-HBx重组质粒,筛选,采用细胞免疫荧光技术检测,发现转染pIRES-HBx重组质粒细胞HBx大量表达
3 讨论
HBV感染可导致一系列肝脏疾病,是人类健康的重大问题之一,每年引起全世界有超过一百万人死亡[7]。已有研究证明HBx蛋白对HBV的复制是非常必要的,在细胞核中HBx与HBV cccDNA和基本转录机制相互作用并激活转录。在细胞质中,HBx通过刺激信号转导通路从而促进病毒复制,包括影响细胞存活、代谢、增殖和转录途径[6]。HBx可以与宿主胞内多种蛋白相互作用进而促进HBV的复制[8,9]。HBx是HBV基因转录所必需的作用因子,在乙型肝炎病毒致病过程中起重要作用,HBx可直接或间接改变肝脏细胞的结构和功能,进而引发肝细胞的凋亡[10]。HBx还能通过与miRNA的相互作用影响许多肿瘤过程,如增殖、凋亡、侵袭、转移、分化和脂肪形成等[11,12]。
HCC是一种具有高致死性的常见恶性肿瘤,大部分HCC的发生都与慢性HBV感染密切相关。HBV可以通过多种机制加速HCC的形成。首先,HBV诱导相应的免疫应答,诱导肝脏出现反复的炎症反应直至纤维化;随后,HBV可通过DNA整合修饰插入附近的宿主基因,从而导致宿主细胞基因组不稳定并产生致癌融合蛋白[9]。HBV感染后会通过干扰细胞信号传导途径和表观遗传学的调节,实现HBV介导的细胞凋亡。关于细胞凋亡的HBV干扰存在相互矛盾的报道,其中大部分报道显示其抑制凋亡效应,但部分研究报道HBV会诱导细胞凋亡[13-15]。HBV可表达多种活性蛋白,尤其是HBx和HBs,它们具有一系列反式激活功能,HBV感染会干扰细胞凋亡信号传导,从而促进HCC的发展进程和病毒增殖,其中HBx蛋白在细胞凋亡的干扰中起主要作用。HBx还可以干扰细胞氧化应激和DNA修复反应、信号转导和细胞周期进展。HBx在HBV相关的HCC组织经常呈高表达,并通过多种机制,如调节细胞存活、增殖相关基因与细胞内蛋白的相互作用和调节不同的信号通路等,促进HCC的发生[16-18]。
HBV感染已被公认是HCC的主要危险因素,进一步的研究也表明HBx是HBV感染后肝癌发生的关键环节之一。HBx通过调节转录、信号转导、凋亡、蛋白质降解和DNA修复参与并影响肝癌的发生[14, 19]。全面了解HBV感染如何诱导和影响HCC的发生发展对于开发更有效的抗病毒治疗药物和预防肝硬化和HCC的发生非常重要[20]。因此,为了进一步探讨HBx在HBV感染和HCC发生发展进程中的作用机制,我们构建了HBx过表达质粒,并成功筛选出稳定表达HBx的HL-7702细胞系,为后续HBV相关肝病发病机制研究和改进临床疗法提供了基础科研工具。
