饲料酵母培养物提高异育银鲫的抗氧化、免疫能力及CyHV-2病毒攻毒保护能力
2020-05-26叶元土蔡春芳石瑶瑶周文豪李永娟
孙 飞 吕 昊 郁 浓 叶元土 蔡春芳 吴 萍 石瑶瑶 周文豪 李永娟
(苏州大学基础医学与生物科学学院1,苏州 215123)
(北京英惠尔生物科技有限公司2,北京 100081)
异育银鲫(Carassiusauratusgibelio)是以原产于黑龙江方正县双凤水库的方正银鲫为母本(♀),江西兴国县的兴国红鲤为父本(♂),采用人工受精的方式,刺激方正银鲫的卵雌核发育而成[1],是我国淡水养殖主要种类。
在异育银鲫养殖过程中面临着诸多问题,其中由饲料油脂氧化带来的营养性疾病和鲫鱼“鳃出血”病给鲫鱼养殖业带来严重的经济损失。油脂是鱼类重要的营养素,不仅可为动物体提供能量、必需脂肪酸等,还是组织细胞的重要组成成分,并且可作为脂溶性营养物质的载体,从而提高它们的吸收和利用效率。然而,在储存过程中,其含有的不饱和脂肪酸在高温、高湿、光照、金属离子等环境条件下极易氧化,产生多种初级和次级氧化物,如过氧化物、醇类、醛类、酮类、烃类、酯类及多聚体等物质[2]。这些氧化物被动物摄食后,可破坏其正常生理生化功能,危及健康、影响正常生长发育,诱发营养性疾病的发生[3]。2009年江苏射阳部分养殖场出现患“鳃出血病”的异育银鲫,死亡率极高[4],经研究确诊,此病为鲤疱疹Ⅱ型病毒(CprinidHerpesvirus 2, CyHV-2)所引起的[5]。患病鲫鱼前期出现体色发黑、离群独游等症状,后期头、鳃、腹部、鱼鳍基部等遍布出血点,解剖发现内脏严重出血,有腹水,大侧肌成血红色,鱼鳔出血点明显,最典型特征为鱼鳃流血不止,此病蔓延迅速,危害巨大。
酵母培养物(Yeast culture,YC)是一类由酵母菌在特定培养基中经发酵、干燥得到的产品,包含了酵母菌体、次级代谢物、残余的培养基等成分。有报道显示,酵母类产品可以增强动物生长性能[6, 7],增强动物机体免疫[8],提高动物抗病力[9, 10],并且对动物肠道健康具有正面作用[11]。据报道酵母源产品可作为饲料原料,并在草鱼等鱼体上做了相关实验,结果显示酵母源产品可以替代水产饲料中少量鱼粉[12]。
本实验以异育银鲫为实验对象,在含有正常豆油、氧化豆油的日粮中,以酵母培养物等质量替代鱼粉,经过池塘网箱的养殖实验,探讨对异育银鲫生长性能、鱼体健康的影响;同时,以患CyHV-2病异育银鲫病鱼内脏组织为致病源进行攻毒实验。综合评价饲料酵母培养物在替代鱼粉、在维护鱼体健康、在氧化油脂损伤情况下的修复作用,以及在CyHV-2病毒攻毒保护的效果。
1 材料与方法
1.1 实验材料
实验所用酵母培养物由企业提供,实测常规成分为水分4.98%,粗蛋白质57.79%,粗脂肪1.40%,粗灰分8.57%。
1.2 实验饲料
基础饲料原料由企业提供。实验用豆油为一级大豆油。氧化豆油制作过程:在正常豆油中添加七水合硫酸亚铁30 mg/L、五水硫酸铜15 mg/L、30%的过氧化氢600 mg/L 和0.3%的水,混合后,放在(80±2)℃的水浴锅中,每30 min 充氧气1 min(循环),氧化14 d。在异育银鲫基础饲料中,豆油作为正对照组(S)、氧化豆油的为负对照组(O)。在含有正常豆油、氧化豆油的基础饲料中分别添加0%、1%、2%、3%的酵母培养物等质量替代鱼粉,共8个实验组,分别命名为S、O、SC1、SC2、SC3、OC1、OC2以及OC3。各组饲料配方见表1。
饲料原料经粉碎过60目筛,混合好的原料用小型环膜制粒机(温度 65 ℃)制成直径1.5 mm,长2~3 mm的颗粒状饲料,水分风干至13%左右,置于-20 ℃冰箱保存备用,使用前按需要量取出饲料自然解冻后投喂。
1.3 实验鱼与养殖管理
养殖实验在池塘网箱中进行,池塘面积为40 m×60 m,设置实验网箱32个(规格为1.5 m×1.8 m×1.8 m)。实验网箱底部设置微孔增氧机增氧,池塘中间设置1台叶轮式增氧机。
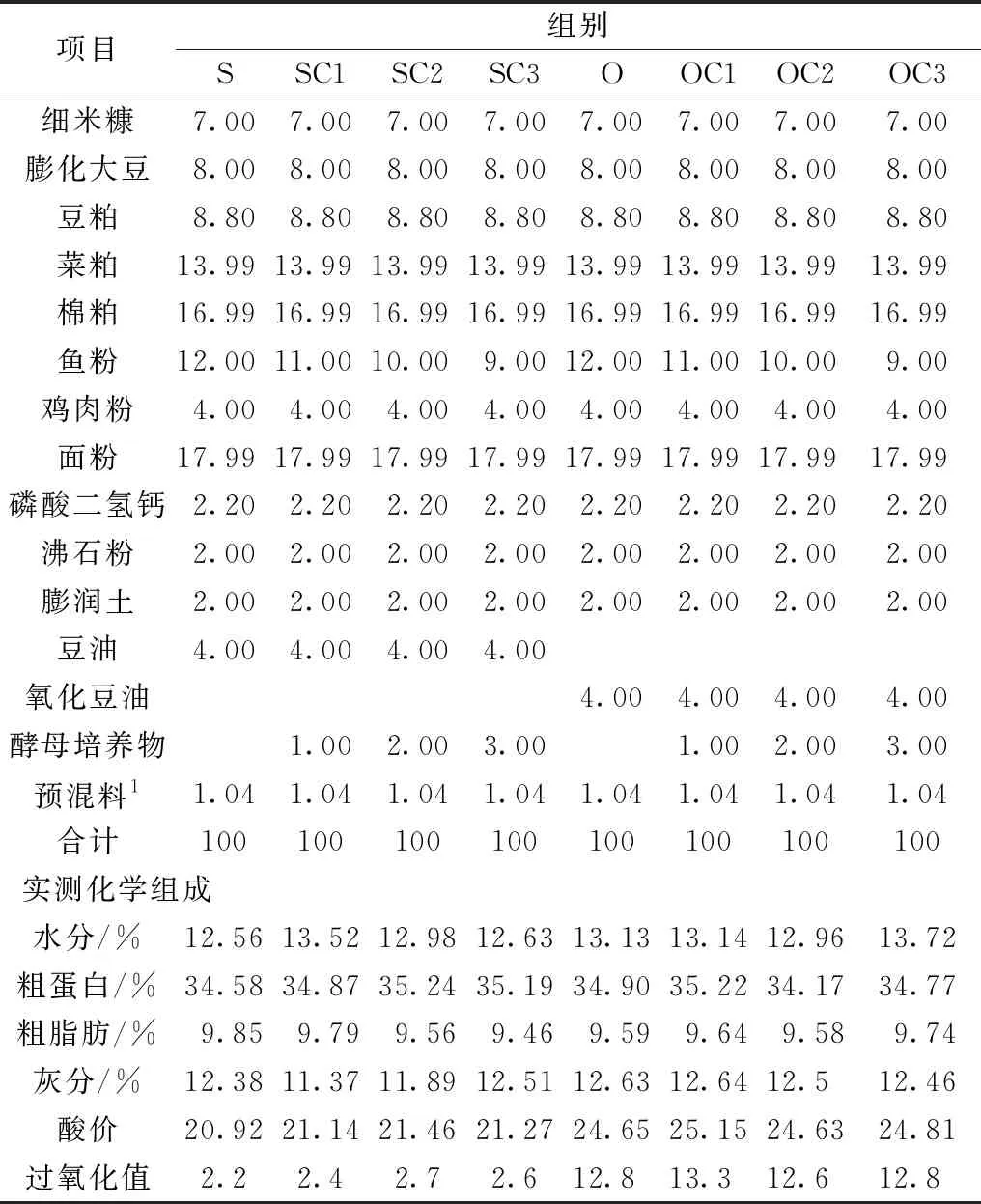
表1 实验饲料组成及营养水平(风干基础)
注:1预混料(mg/kg 饲料):铜5,铁180,锰35,锌120,碘0.65,硒0.57,钾80,维生素A 10,维生素B1 8,维生素B2 8,维生素B6 20,维生素B12 0.1,维生素C 250,维生素D3 4,维生素K3 6,泛酸钙20,烟酸25,叶酸5,肌醇100。
实验用异育银鲫鱼种购自企业选取规格整齐的异育银鲫鱼种1 440尾,平均质量为(7.08±0.01)g。食盐消毒后,随机分成8组,每组设4个重复,共记32个网箱,每个网箱45尾鱼。实验鱼用对照组基础饲料驯化适应,每天早晚各投喂2次,驯化两周后开始正式投喂。日投喂2次(7:00—9:00,16:30—18:30),日投喂量为鱼种体重的3%~5%,每15 d估算1次鱼体增重量,调整投喂量,正式投喂65 d。每天11:00测试、记录水温。每5 d测定水下30 cm处水质。整个实验期间水温22~34 ℃,溶解氧浓度>5.0 mg/L,pH 8.2 ~ 8.6,氨氮浓度<0.2 mg/L,亚硝酸盐浓度<0.01 mg/L,硫化物浓度<0.05 mg/L。
1.4 样品采集
正式养殖实验结束后,最后一次饲料投喂24 h后,进行实验鱼采样工作。养殖实验结束,最后一次投喂饲料24 h后,对每个网箱的鱼称重,统计实验鱼数量、实验饲料投喂量,计算成活率、特定生长率和饲料系数。
血清采集用1 mL无菌注射器尾柄静脉采血,置于2 mL Eppenddorf管中自然凝固4 h,离心(4 ℃,3 500 r/min)10 min后,取上层血清,将同一个网箱中采集的血清混匀后,分装(每管200 μL)于0.5 mL Eppenddorf管中(每个网箱至少分装12管血清),液氮速冻之后置于-80 ℃超低温冰箱保存,用于分析血清生理生化指标以及酶学指标。
全血采集每个网箱随机选取2尾鱼,用2 mL无菌注射器尾柄静脉采血,置于2 mL带EDTA抗凝剂的真空采血管中,小心上下颠倒数次混匀,每个网箱采集2管,当日送迏苏州市九龙医院,挑选1管用于血液常规指标测定。
组织切片样品采集每个网箱随机选取2尾鱼,解剖、分离内脏团,分别取大小为4 mm×4 mm的肝胰脏和长度为1 cm左右的中肠,于灭菌的0.75%生理盐水中洗净后,置于10%甲醛固定,用于制作组织切片。
1.5 样品分析
常规样品分析饲料样品用冷冻干燥机干燥至恒重测其水分,之后用于其它指标测定;粗蛋白、粗脂肪、灰分、酸价和过氧化值采用国标规定的方法测定。
酶学指标分析超氧化物歧化酶活力(U/mL)、过氧化氢酶活力(U/mL)、丙二醛含量(mmol/mL)、溶菌酶(μg/mL)、二胺氧化酶(U/L)采用南京建成生产的试剂盒测定。
全血指标分析血细胞分类计数(淋巴细胞数量、单核细胞数量、粒细胞数量)采用五分类血细胞分析仪测定。
血清指标分析血清的血清免疫球蛋白含量、血清天门冬氨酸氨基转移酶和丙氨酸氨基转移酶含量采用雅培C800全自动生化分析仪测定。
组织切片甲醛固定的组织经洗涤、酒精梯度脱水、透明、透蜡、石蜡包埋后切片,切片厚5 μm,组织切片经酒精梯度复水后,HE染色,酒精梯度脱水,二甲苯透明,中性树胶封片,置于光学显微镜下观察肝、肠组织结构;并采用Nikon COOL-PIX4500型相机进行拍照,Smart-4500软件进行数据量化处理,测量黏膜下层厚度、皱襞间质以及绒毛长度。
1.6 攻毒实验
养殖实验结束后,在每个实验组的3个重复中随机选取12尾鱼用于CyHV-2病毒攻毒实验。CyHV-2病毒是在大丰华晨水产养殖公司提供的“鳃出血”症状明显的病鱼中,取其肝脏、脾脏、体肾和头肾制成组织混样,按1∶9灭菌0.75%生理盐水制作组织匀浆,反复冻融3次(使细胞破裂、释放出病毒),2 880× g离心10 min,上清液过0.45 μm(带荚膜的CyHV-2病毒大小在110~200 nm)滤膜除菌,所得的组织液即为病毒液,-80 ℃保存待用。通过预实验,确定异育银鲫的半致死剂量为0.25 mL,攻毒时通过异育银鲫腹腔注射0.25mLCyHV-2病毒液,统计各组异育银鲫第8 d的累积死亡尾数并计算累积死亡率和攻毒保护率。
1.7 计算方法与统计分析
存活率(Survival rate, SR, %)=100×终末鱼尾数/初始鱼尾数;
饲料系数(Feed conversion ratio, FCR)=尾均摄食量/(终末均重-初始均重);
特定生长率(Specific growth rate, SGR)=100%×(ln终末尾均重-ln初始尾均重)/饲养天数;
累积死亡率(Cumulative mortality rate, CMR)=100%×7 d时累积死亡数量/初始鱼尾数;
攻毒保护率(Attack protection rate, %)=100×(1-实验组累积死亡率/对照组累计死亡率);
实验数据以平均值±标准差表示。采用SPSS 22.0软件对实验数据进行处理和统计学分析,组间若有显著差异,则进行Duncan 氏多重比较,显著性水平为P<0.05。
2 结果与分析
2.1 对异育银鲫生长性能的影响
经过65 d的池塘养殖实验,各实验组的存活率、特定生长率以及饲料系数见表3。可以得到以下结果:1)各实验组存活率无差异。2)与S组比较,SC1、SC2、SC3的特定生长率SGR下降0.28%~1.42%(P>0.05);氧化豆油O组较S组下降6.53%(P<0.05);与O组比较,OC1、OC2、OC3组SGR分别提高4.24%、3.94%、4.24%(P<0.05)。3)饲料系数,SC1、SC2、SC3组的FCR与S组结果比较差异不显著(P>0.05); O组较S组上升16.27%(P<0.05);与O组比较,OC1、OC2、OC3组FCR分别下降7.77%、6.74%、8.29%(P<0.05)。
结果表明,饲料中氧化豆油替换正常豆油后,造成异育银鲫生长性能显著下降,饲料系数显著上升; YC代替饲料中等质量1%~3%的鱼粉后,异育银鲫SGR有下降的趋势,饲料系数有增加的趋势,但差异不显著;在氧化豆油日粮中,在含有12%鱼粉的情况下,用1%~3%的酵母培养物等质量替代鱼粉后,异育银鲫的生长速度、饲料效率有较好的恢复效果。
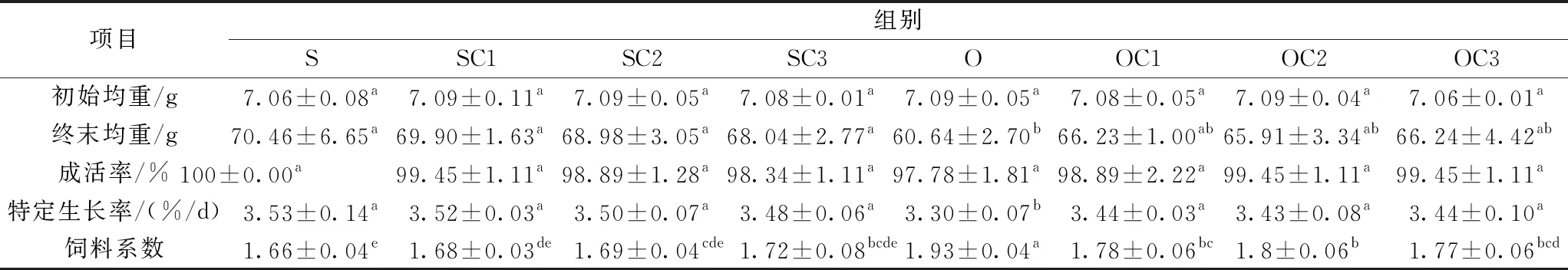
表2 酵母培养物对异育银鲫生长性能的影响(n=4)
注:表中同行数据肩标不同字母表示差异显著(P<0.05),下表同。
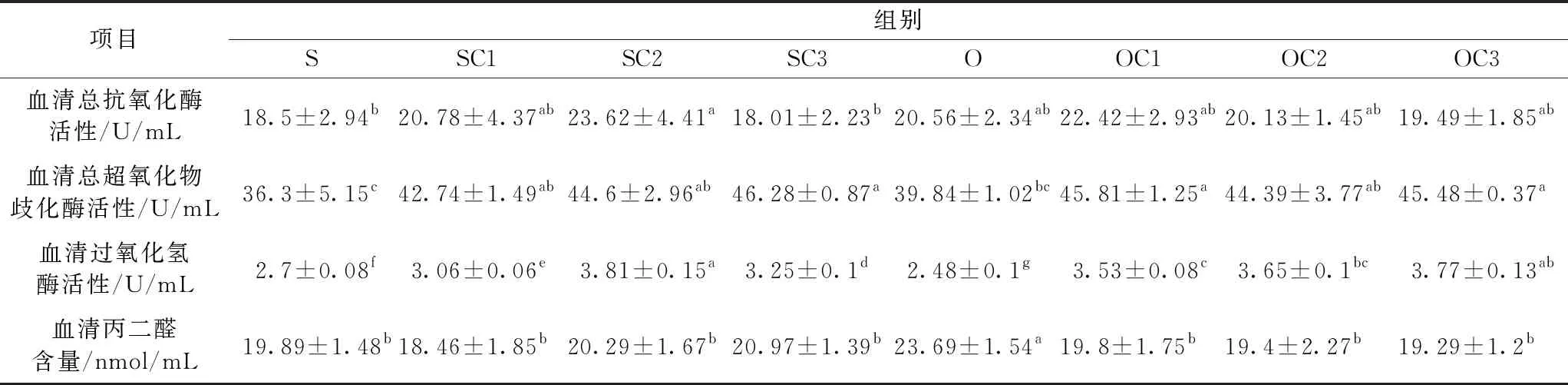
表3 酵母培养物对异育银鲫机体抗氧化能力的影响(n=3)
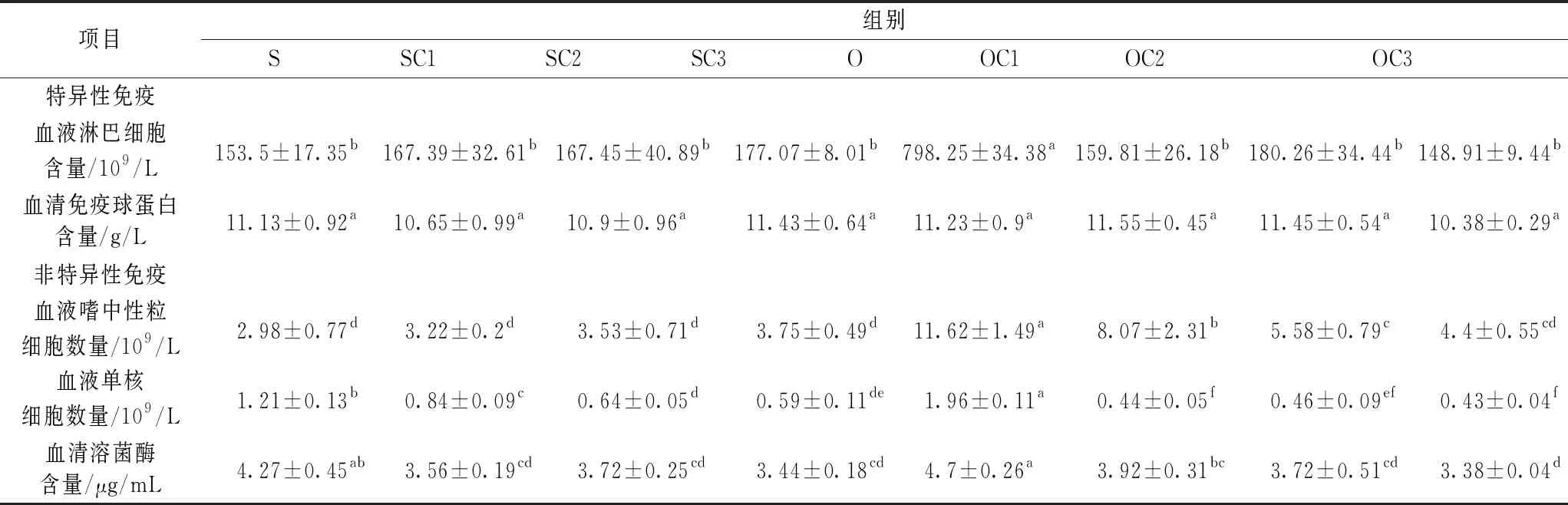
表4 酵母培养物对异育银鲫机体免疫能力的影响(n=4)
2.2 对异育银鲫抗氧化能力的影响
由表3可知:1)血清总抗氧化能力(T-AOC),与S组结果比较,SC1和SC2组T-AOC上升,其中SC2组差异显著(P<0.05),SC3组T-AOC下降(P>0.05); O组上升(P>0.05);与O组比较,OC1组T-AOC上升,OC2和OC3组下降(P>0.05)。2)总超氧化物歧化酶(T-SOD),与S组结果比较,SC1、SC2、SC3的T-SOD均上升(P<0.05);O组上升(P>0.05);与O组结果比较,OC1、OC2、OC3组T-SOD上升,其中,OC1和OC3差异显著(P<0.05)。3)血清过氧化氢酶(CAT),与S组结果比较,SC1、SC2、SC3的CAT均上升(P<0.05);O组下降(P<0.05);与O组结果比较,OC1、OC2、OC3组CAT均上升(P<0.05)。4)血清丙二醛(MDA),与S组结果比较,SC1组下降,SC2、SC3组上升(P>0.05);O组上升(P<0.05);与O组结果比较,OC1、OC2、OC3组MDA均下降(P<0.05)。
结果显示,饲料氧化豆油使异育银鲫抗氧化系统遭到损伤; 1%~3%YC替代等质量的鱼粉提高了异育银鲫抗氧化能力;在氧化豆油日粮中, YC使异育银鲫抗氧化系统恢复正常。
2.3 对异育银鲫机体免疫能力的影响
由表4可知:1)血液淋巴细胞含量,与S组结果比较,SC1、SC2、SC3组的血液淋巴细胞含量无差异;O组与S组结果比较上升420.03%(P<0.05);与O组结果比较,OC1、OC2、OC3组的血液淋巴细胞均下降(P<0.05);2)血液嗜中性粒细胞,SC1、SC2、SC3组与S组结果比较无差异;O组与S组结果比较上升了289.93%(P<0.05);与O组结果比较,OC1、OC2、OC3组均下降(P<0.05)。3)血液单核细胞含量,SC1、SC2、SC3组与S组结果比较均下降(P<0.05); O组与S组结果比较上升61.98%(P<0.05);与O组结果比较,OC1、OC2、OC3组均下降(P<0.05)。4)血清溶菌酶,SC1、SC2、SC3组与S组结果比较均下降(P<0.05);O组与S组结果比较上升(P>0.05);与O组结果比较,OC1、OC2、OC3组均下降(P<0.05)。
结果显示:饲料氧化豆油激发了异育银鲫的免疫系统;酵母培养物代替饲料中等质量鱼粉没有对异育银鲫免疫系统造成负面影响;酵母培养物可以使异育银鲫因饲料氧化豆油引起的机体免疫系统应激得到缓解。
2.4 对异育银鲫肝脏转氨酶的影响
由图1可知:①血清天门冬氨酸氨基转移酶(AST),SC1、SC2、SC3组AST与S组结果比较均上升,其中SC2、SC3组差异显著(P<0.05); O组与S组结果比较上升15.21%(P<0.05);与O组结果比较,OC1、OC2、OC3组AST均下降,其中OC2、OC3组差异显著(P<0.05)。
由肝脏切片结果(图2)可知:豆油S组肝细胞排列整齐,细胞界限明显“→”,细胞核位于细胞中间位置“↑”;添加YC后,SC1、SC2、SC3组与S组差异不显著; O组肝细胞排列无序,细胞界线不明显,细胞结构受损“→”,细胞核发生聚集“↖”“↙”;与O组结果比较,添加YC后,OC1、OC2、OC3组肝细胞排列整齐,细胞界限明显“→”,细胞核位于细胞中间位置“↑”。

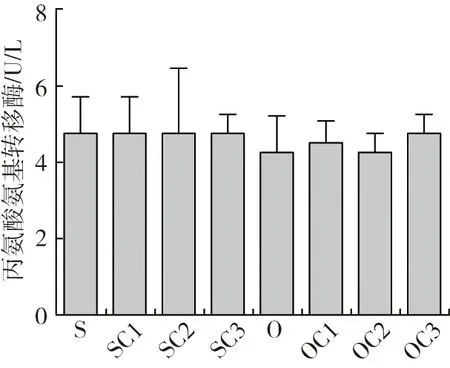
图1 酵母培养物对异育银鲫肝脏转氨酶的影响
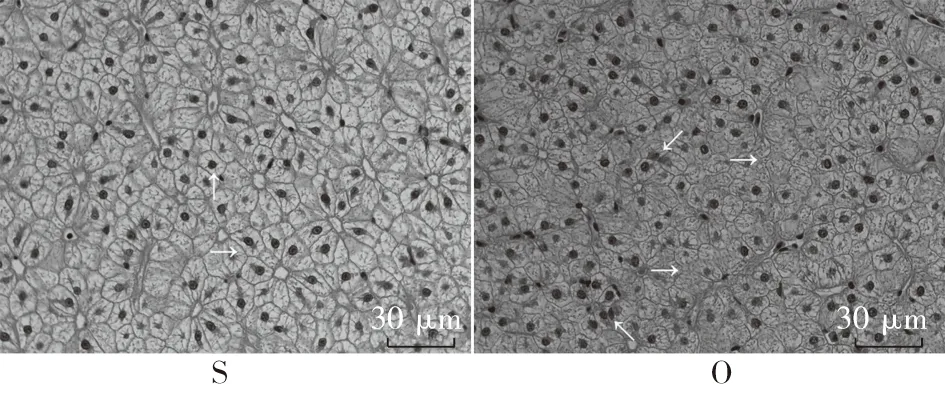



注:异育银鲫养殖65d后,取肝脏做组织切片,进行光学显微镜观察,400倍(图版Ⅰ)。发现S组肝细胞排列整齐,细胞界限明显“→”,细胞核位于细胞中间位置“↑”;添加YC后,SC1、SC2以及SC3组与S组差异不显著;O组肝细胞排列无序,细胞界线不明显,细胞结构受损“→”,细胞核发生聚集“↖”“↙”;与O组结果比较,添加YC后,OC1、OC2以及OC3组肝细胞排列整齐,细胞界限明显“→”,细胞核位于细胞中间位置“↑”,YC对氧化豆油引起的肝细胞损伤有很好修复效果。图2 酵母培养物对异育银鲫肝脏组织结构的影响
结果显示:饲料氧化豆油可能引起了异育银鲫肝脏炎症; YC代替等质量鱼粉后,异育银鲫的AST有少许程度的上升,可能是因为机体肝脏出现轻微炎症;在氧化豆油日粮中, YC代替等质量鱼粉后,可以修复饲料氧化油脂对机体肝脏的损伤。
2.5 对异育银鲫血清二胺氧化酶的影响
由图3可知:血清二胺氧化酶活力(DOA),与S组结果比较,SC3组下降(P>0.05);O组上升(P<0.05);与O组结果比较,OC1、OC2、OC3组均下降,其中OC2、OC3组差异显著(P<0.05)。
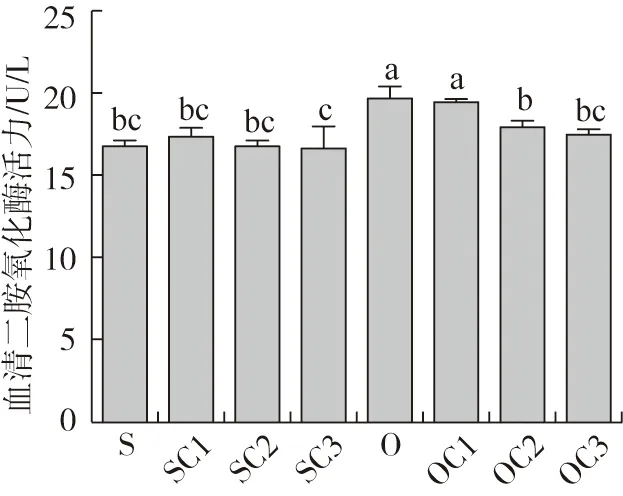
图3 酵母培养物对异育银鲫血清二胺氧化酶的影响
各组肠道黏膜下层厚度和皱襞间质的量化数据见图4,结合肠道切片结果(图5):①黏膜下层厚度,与S组比较,SC2、SC3组上升,其中SC2组差异显著(P<0.05);O组较S组下降(P>0.05);OC1、OC3组较O组均上升(P>0.05)。②SC2、SC3组的皱襞间质与S组比较均下降(P>0.05);O组与S组结果比较上升了100.86%(P<0.05),OC1、OC2、OC3组与O组结果比较均下降(P<0.05)。
结果显示:饲料氧化豆油使异育银鲫肠道组织结构受损;1%~3%YC代替等质量鱼粉后,在一定程度上可以改善异育银鲫的肠道结构;在氧化豆油日粮中,在1%~3%YC代替等质量鱼粉后,可以修复由饲料氧化豆油引起的异育银鲫肠道炎症与损伤。
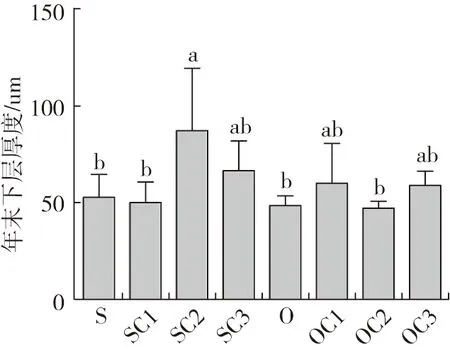
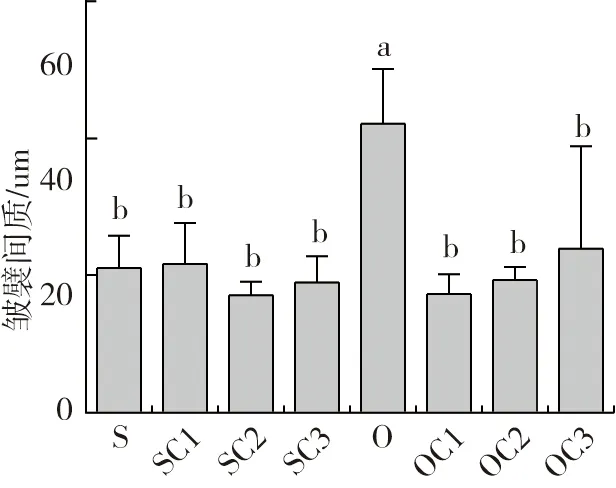
图4 酵母培养物对异育银鲫中肠组织结构的影响
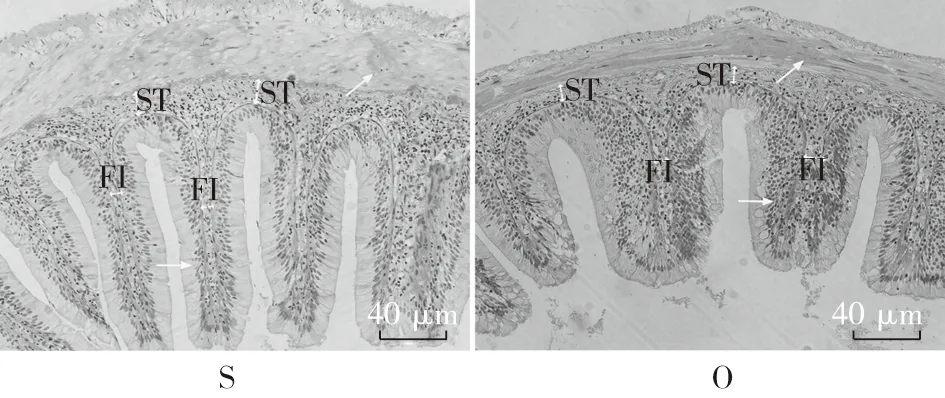
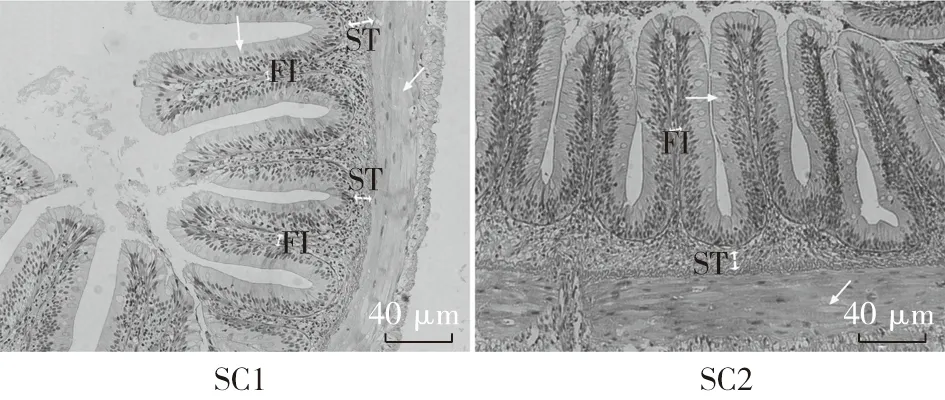
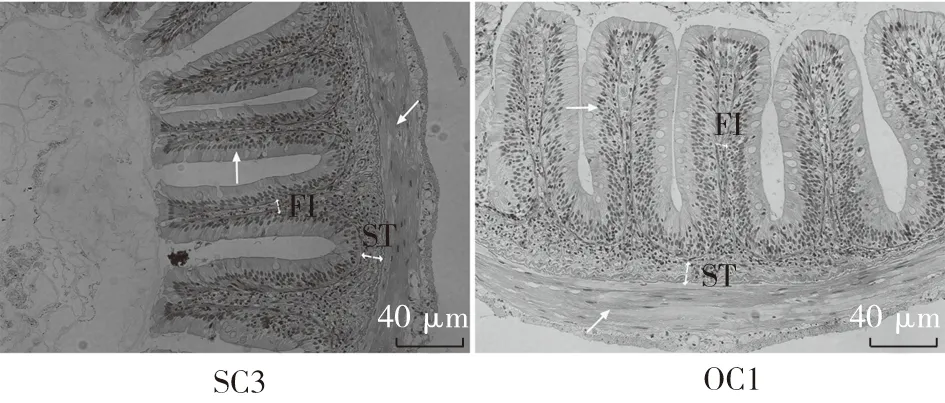
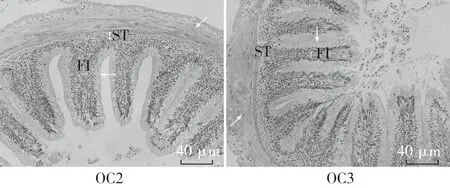
注:异育银鲫养殖65d后,取中肠做组织切片,进行光学显微镜观察,200倍(图版:Ⅱ)。与S组中肠组织切片结果比较,O组肠绒毛短而粗“→”,绒毛间距大,肠壁变薄“↗”,黏膜下层厚度差异不显著,但皱襞间质增大,差异显著(“ST”表示“黏膜下层厚度”,“FI” 表示“皱襞间质”)。与S组结果比较,添加YC后,SC1、SC2以及SC3组的绒毛长度、绒毛排列稀疏程度、肠壁厚度以及皱襞间质差异均不显著,SC2组的肠道黏膜下层厚度差异显著;与O组结果比较,添加YC后,OC1、OC2以及OC3组中肠绒毛长度增长且变细,绒毛排列紧密,肠壁增厚,皱襞间质显著降低,OC1以及OC3组黏膜下层厚度增大,差异显著(P<0.05),OC2组与O组差异不显著。图5 酵母培养物对异育银鲫中肠组织结构的影响
表5酵母培养物对异育银鲫攻毒后累积死亡率和攻毒保护率的影响
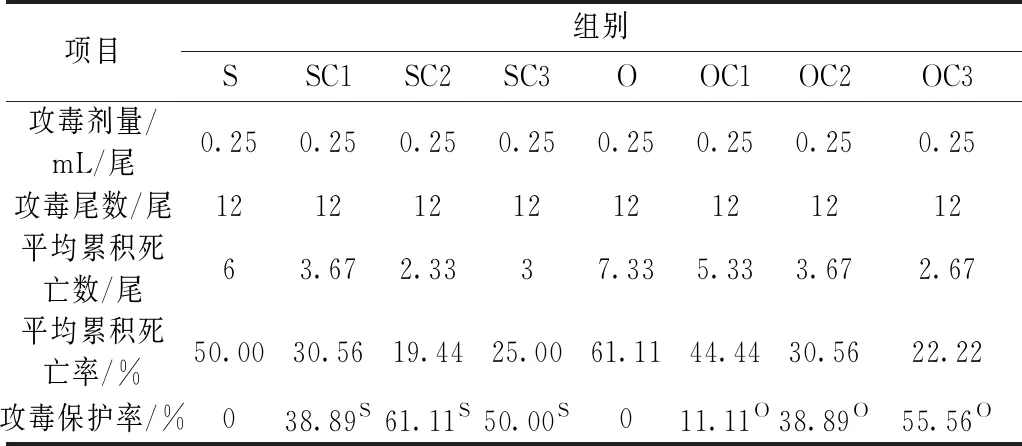
项目组别SSC1SC2SC3OOC1OC2OC3攻毒剂量/mL/尾0.250.250.250.250.250.250.250.25攻毒尾数/尾1212121212121212平均累积死亡数/尾63.672.3337.335.333.672.67平均累积死亡率/%50.0030.5619.4425.0061.1144.4430.5622.22攻毒保护率/%038.89S61.11S50.00S011.11O38.89O55.56O
注:“S”和“O”表示该攻毒保护率分别以S组和O组为基准。
2.6 对异育银鲫累积死亡率和攻毒保护率的影响
各实验组累积死亡率和攻毒保护率统计见表5。与S组结果比较,SC1、SC2、SC3组累积死亡率降低,攻毒保护率分别为38.89%、61.11%、50%;与O组结果比较,OC1、OC2、OC3组相对死亡率降低,攻毒保护率分别为11.11%、38.89%、55.56%。结果显示:酵母培养物体现了较好的CYHV-2病毒免疫保护作用。
3 讨论
本实验条件下,酵母培养物替代等质量鱼粉后,异育银鲫的生长性能与全鱼粉组无显著差异,表明在含有12%鱼粉的异育银鲫饲料中,用酵母培养物等质量替代1%~3%鱼粉具有一定的可行性;饲料氧化油脂显著影响了异育银鲫的生长性能;在氧化油脂组中以酵母培养物替代等质量鱼粉后,异育银鲫生长性能得到改善。
肠道是鲤科鱼类消化吸收利用营养物质的主要场所,异育银鲫肠道形态结构的健康可以在一定程度维护其生长性能。DOA是肠道黏膜上层绒毛细胞中具有高度活性的细胞内酶,当肠道细胞受损,细胞膜通透性发生变化时就会大量释放到血液中,引起DOA增高[13]。饲料中油脂氧化对水产动物的生长性能以及肠道健康造成损害;饲料氧化豆油使异育银鲫肠道黏膜结构损伤。本实验结果显示:酵母培养物在一定程度上改善了异育银鲫的肠道形态结构。饲料中的氧化油脂会导致适口性下降,降低摄食量[14],氧化油脂所含有的初级和次级氧化产物,如过氧化物、丙二醛等能打破机体自由基代谢平衡,使自由基异常增加,破坏抗氧化酶活性,导致鱼类产生氧化应激损伤[15],氧化油脂会导致胃肠无食物,出现积水[16],肠道紧密连接结构打开,肠道通透性变大[17]。在氧化豆油日粮中,1%~3%YC代替等质量鱼粉后,修复了由饲料氧化豆油引起的异育银鲫肠道形态结构损伤。此结果可能由于酵母培养物为肠道微生物提供丰富的营养物质,酵母菌从培养基中吸收营养物质转化为自身所需的初级代谢产物,包括小肽、氨基酸、络合微量元素、维生素等,以及酵母细胞生长产生的次级代谢产物,如有机酸、核苷酸、低聚糖等物质,可以促进水产动物肠道微生物生长,增加有益菌数量,调节肠道菌群种类和数量平衡,改善肠道形态结构和功能的完整性,从而提高水产动物的生产性能。
鱼类是较低等的脊椎动物,非特异性免疫是鱼类主要的免疫系统。T-SOD与动物的免疫水平密切相关,能够催化氧自由基对分子氧和过氧化氢的歧化反应,并且增强吞噬细胞防御能力,它是机体抗氧化防御系统的重要组成部分[18]。本实验中各实验组T-SOD活力与对照组比较均上升。酵母培养物能够提高异育银鲫T-SOD活性与其含有丰富β-葡聚糖和甘露寡糖密切相关,其中β-葡聚糖能够增强血细胞SOD活性,提高抗氧化能力,甘露寡糖本身具有一定的免疫原性,能够刺激机体的免疫应答,增强SOD活性,提高其非特异性免疫力[19-22]。LZM是一种水解 N-乙酰胞壁酸和 N-乙酰葡糖胺酶,它是生物体内重要的非特异性免疫因子之一[23]。本实验中各实验组LZM与对照组结果比较均下降。LZM可清除抗菌因子作用后所残余的细菌细胞壁,增强其他免疫因子的抗菌敏感性,协同其他免疫因子共同抵制外来病原的入侵,LZM活力提高,其免疫能力也相应提高[24]。MDA作为有毒有害的脂质过氧化产物,其含量升高表明氧自由基产生过多,氧自由基具有很强的氧化性,造成脂质过氧化,导致细胞膜流动性降低[25]。本实验中各实验组MDA含量均有不同程度下降。结果表明酵母培养物可以降低异育银鲫MDA的含量,并且能够缓解由饲料氧化油脂造成异育银鲫MDA的上升。
肝脏是动物机体在物质能量代谢过程中具有重要而特殊功能的脏器。AST存在于肝细胞线粒体内,肝细胞严重受损时AST就会进入血液中[26],因此血清AST常作为判断肝脏损伤的敏感指标。本实验结果显示:正对照各实验组AST较S组上升,但差异不显著;结果提示酵母培养物替代饲料中等质量鱼粉后可能导致AST少许程度上升;但从异育银鲫肝脏组织切片结果来看,SC1、SC2、SC3组与S组无显著性差异。已有研究表明,饲料添加适量酵母培养物可以有效改善机体肝脏结构[27, 28],这与本实验结果不同,这可能与酵母培养物的添加量有关。O组与S组结果比较AST上升,O组切片肝细胞排列无序,细胞界线不明显,细胞结构受损,细胞核发生聚集,表明氧化油脂造成异育银鲫肝脏结构损伤。与O组结果比较,各负对照实验组AST下降,肝脏结构有所恢复,切片肝细胞排列较整齐,细胞界限明显,细胞核也位于细胞中间位置,表明本实验条件下酵母培养物修复了氧化油脂造成的机体肝脏损伤,这与肠道结果相似。
酵母培养物对水产动物抗病力也有一定的改善作用[9, 10, 29]。本实验结果表明酵母培养物体现了较好的CyHV-2病毒免疫保护作用。酵母培养物是如何对CyHV-2病毒起到免疫保护作用的呢?原因可能是酵母培养物提高了异育银鲫的抗氧化能力和免疫能力。CyHV-2病毒从多种途径对异育银鲫产生负面作用。首先,CyHV-2病毒感染的异育银鲫血清总抗氧化能力显著降低,丙二醛与总抗氧化能力的比值升高,使机体抗氧化系统遭到破坏[30];其次CyHV-2病毒感染后,对异育银鲫免疫组织器官结构,免疫细胞数量和活力均有显著影响[5, 31, 32]。本实验所用酵母培养物含有丰富的 β-葡聚糖和甘露寡糖,可以维护异育银鲫的抗氧化系统和免疫系统[19, 22],这可能是提高异育银鲫抗CyHV-2病毒的主要原因。
4 结论
饲料氧化豆油使异育银鲫机体抗氧化系统、免疫系统处于应激状态,肝脏和肠道结构受损。饲料YC提升了异育银鲫免疫防御能力、抗氧化损伤的能力,可修复由氧化豆油引起的负面作用,对CYHV-2病毒攻毒保护具有较好的效果,1%~3%YC替代等质量鱼粉具有一定可行性。
