四物饮抑制食管癌细胞侵袭及迁移的研究
2020-05-26史会娟孔令玉吴忠冰石冬璇
史会娟,孔令玉,吴忠冰,赵 杨,石冬璇,李 晶,3*
(1.河北医科大学第四医院,河北省肿瘤医院,石家庄 050011;2.河北医科大学研究生学院,石家庄 050011;3.河北医科大学中西医结合学院,石家庄 050011)
食管癌是一种常见的恶性消化道肿瘤,我国是世界上食管癌发病率和死亡率最高的国家[1]。转移的发生是导致食管癌治疗失败和患者死亡的主要原因[2],我国食管癌患者的5年生存率仅为20.9%[3]。因此,寻求抑制食管癌转移的有效方法是摆在我们面前的重要课题。
食管癌在症状上归属中医“噎膈”范畴,前期实验证实应用“甘润濡养”之法能够明显抑制食管癌细胞的迁移及侵袭[4-8]。四物饮以“甘润濡养”立法,由四物汤合五汁安中饮化裁而成。
四物汤记载于唐代《仙授理伤续断秘方》,是中医补血、养血的经典方药,《医学正传》《景岳全书》《脉因证治》等中医论著中多次提到四物汤对噎膈的治疗作用。五汁安中饮出自《新增汤头歌诀》引张任候方,主治噎膈,胸膈痞满隐痛。
因为体外实验更快速,可重复性更好,所以近年来体外实验被越来越多地用于中药制剂的毒理及药物机制研究[9-10]。
1 材料和方法
1.1 实验材料
高分化人食管癌细胞Eca109购自上海科学院细胞生物学研究所,待稳定传代后用于实验。
1.2 主要试剂与仪器
RPMI 1640培养基(货号∶C11875500BT)购于美国Gibco公司;新生牛血清(货号∶04-102-1B)购自美国Biological公司;荧光标记鬼笔环肽(Phalloidin-FITC货号∶A12379,批号∶1456973)购于美国Molecular Probes公司;单道可整支消毒移液器购自德国Eppendorf公司;IncuCyte S3活细胞动态成像与分析系统购于美国Essen BioScience公司;激光共聚焦显微镜(型号∶OLS4500)购于日本Olympus公司;Transwell小室(货号∶3422)购于美国Corning公司。药材购自河北省石家庄市乐仁堂,批号为190701,经河北医科大学第四医院药剂科陈欣然副教授鉴定为正品,韭、姜、白梨、藕购于石家庄北国超市,牛乳购于内蒙古蒙牛乳业(集团)股份有限公司,产品标准号GB25109;竹沥购于江西民济药业有限公司,批号为Z36021948。
1.3 实验方法
1.3.1 细胞培养
人食管癌细胞株Eca109用含10%胎牛血清的RPMI 1640培养基,在37℃、CO2体积分数为5%的饱和湿度恒温培养箱中培养。每3 d换液1次,倒置显微镜下观察待细胞贴壁生长至融合度达90%时,用0.25%胰蛋白酶消化并传代,2~6代细胞进行实验。
1.3.2 四物饮提取物制备
四物饮组成:当归10 g、白芍10 g、熟地20 g、川芎10 g、韭汁10 mL、姜汁10 mL、竹沥10 mL、威灵仙10 g、牛乳60 mL、梨汁10 mL、藕汁10 mL。
当归、白芍、熟地、川芎、威灵仙加1000 mL蒸馏水浸泡30 min,加热煮沸后,转小火煮1 h,趁热过滤,药渣再加1000 mL蒸馏水加热,沸后转小火煮1 h,趁热过滤,合并2次煎出液,韭、姜、白梨、藕榨汁,加入药汁中,将牛乳及鲜竹沥加入药汁,离心,取上清。45℃旋蒸,至药物浓稠,-80℃冰箱冻24 h,冻干机冻干,取冻干粉。冻干粉分装并储存于-80℃冰箱,应用时用完全培养基配置1 mg/mL储存液,并用滤器过滤,保存于无菌离心管中,用封口膜封口,储存于4℃冰箱备用。依据各组加药浓度不同再用完全培基(含10%胎牛血清的RPMI 1640)倍比稀释。
1.3.3 细胞分组
培养细胞,依据前期实验经验确定细胞浓度及药物浓度[4-8],待细胞贴壁生长至融合度达60%时,采用600μg/mL、300μg/mL、150μg/mL、70μg/mL和30μg/mL浓度的四物饮分别作用Eca109细胞24 h,并设未处理的细胞为对照组。
1.3.4 S3划痕实验
使用IncuCyte S3活细胞动态成像与分析系统评估细胞迁移。
IncuCyte S3活细胞动态成像与分析系统可高通量、非伤害的长时间实时动态观察活细胞,并自动收集每个时间点的图像。在划痕实验中除了可以得到图像外,还可得到由系统软件自动依据饱和度和计数分析生成的相对伤口密度与时间图表。
应用IncuCyte S3活细胞动态成像与分析系统完成划痕实验,观察各剂量四物饮对食管癌细胞迁移能力的影响,用IncuCyte软件评估划痕闭合率,用相对伤口密度(%)与时间图表表示,筛选四物饮抑制食管癌细胞迁移的有效剂量。
依据前期实验经验确定细胞浓度[6],4×103Eca109细胞/孔接种在96孔培养板中,并在37℃,5% CO2的RPMI1640完全培养基中培养24 h。然后用划痕器进行划痕。用培养基清洗细胞2次,不同浓度的四物饮(30、70、150、300、600μg/mL)干预细胞,对照组细胞不加干预。细胞培养板被放在IncuCyte S3活细胞动态成像与分析系统和划痕区域的图像(10×倍放大)每1 h记录。显微镜下测量划痕的宽度,以0 h划痕宽度为标准对照。划痕宽度越大,表明细胞迁移能力越弱。实验重复3次。
因为本实验筛选四物饮抑制食管癌Eca109细胞迁移最佳浓度为150μg/mL,故之后细胞功能实验均采用150μg/mL浓度。
1.3.5 Transwell测细胞侵袭
采用Transwell系统检测肿瘤细胞侵袭能力。
四物饮组用四物饮150μg/mL干预细胞24 h。用预冷后的枪头将过夜液化的Matrigel人工基质胶(1.5 mg/mL;美国BD生物科学)与4℃预冷的无血清培养基1∶4比例混合,每个Transwell小室的上室均匀铺入40μL稀释过的Matrigel胶,此步操作均在冰上进行。将铺好胶的小室放入恒温培养箱1 h使胶固化。参考文献[4],将不含牛清的细胞(1×105/mL)加到Transwell小室的上室和0.5 mL含有牛清的培养基放在Transwell小室的下室。在37℃,5%的二氧化碳孵育过夜。用棉签轻轻从上室刮下细胞。将Transwell小室放入新板,将附着内容的上室和附着细胞的下室表面用4%多聚甲醛固定20 min,用结晶紫染色30 min。用PBS冲洗后,在显微镜下拍摄细胞。实验重复3次。
1.3.6 激光共聚焦显微镜观察鬼笔环肽标记细胞微丝骨架
FITC标记的鬼笔环肽可特异的与细胞微丝结合,从而显示微丝骨架在细胞中的分布,因此可应用鬼笔环肽标记观察食管癌细胞的形态。细胞微丝在细胞的变形运动中起着关键的作用,上皮细胞间质化(epithelial to mesenchy-mal transition,EMT)时,伪足由细胞膜伸出,以此获得运动的能力。
依据前期实验经验确定细胞浓度[7],将1×106食管癌细胞Eca109接种于24孔板,待细胞贴壁后四物饮组用150μg/mL的四物饮作用细胞24 h,对照组不予干预,每组3个复孔。将细胞用PBS洗3次,每次5 min。用1 mL 4%多聚甲醛室温固定20 min,然后1 mL 0.3% TRIton X-100室温透膜10 min,再以PBS洗3次,每次5 min。1 mL 10%BSA室温封闭30 min。加入2% BSA 1∶100稀释的鬼笔环肽(phalloidin-FITC),4℃过夜。用含0.1%Tween 20的PBS洗涤3次,每次5 min。PBS洗涤1次,5 min,甘油封片。应用激光共聚焦显微镜观察结果,采集图像。实验重复3次。
1.3.7 RNA-Seq测序及信息分析
四物饮组细胞用四物饮150μg/mL干预24 h,分别收集两组细胞,提取总RNA。测OD值,-80℃保存备用。测序文库构建:使用oligo dT微珠纯化mRNA,使其片段化处理,反转录反应合成双链cDNA。双链DNA末端修复及3’末端加‘A’,使用特定的测序接头连接DNA片段两端,高保真聚合酶扩增构建成功测序文库,DNA成簇(Cluster)扩增后进行高通量测序。实验重复3次。
1.4 统计学方法
采用SPSS 22.0统计学软件对实验数据进行统计分析。所有实验均重复3次以上。计量资料符合正态分布以平均数±标准差(±s)表示,两组间比较采用两独立样本t检验;多组间均数比较采用单因素方差分析;计数资料采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 细胞生长情况
倒置显微镜下观察Eca109细胞生长情况:细胞形态不一,多呈卵圆形,贴壁生长,细胞间连接紧密,传代时间约为72 h。
2.2 应用IncuCyte Zoom观察四物饮对细胞迁移的影响以筛选药物浓度
用IncuCyte软件评估划痕闭合率,从相对伤口密度(%)与时间图中可以看出,不同浓度的四物饮均能够抑制食管癌细胞迁移,但当四物饮浓度为150μg/mL时抑制细胞迁移效果最好(P<0.05),因此,四物饮抑制食管癌细胞迁移的有效浓度为150μg/mL,见图1。
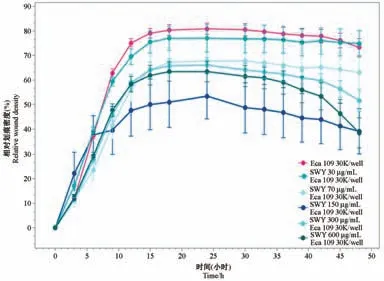
注:四物饮浓度为150μg/mL时对食管癌细胞Eca109的迁移能力抑制最强。图1 应用IncuCyte Zoom观察四物饮对食管癌细胞迁移的影响Note.Siwuyin concentration was 150μg/mL,it had the strongest inhibition on the migration of esophageal cancer cell line Eca109.Figure 1 The effect of Siwuyin on the migration of esophageal cancer cells was observed by incucyte zoom
2.3 划痕实验观察四物饮对细胞迁移的影响
从IncuCyte Zoom系统记录的大量图像中提取对照组、四物饮70μg/mL组、四物饮150μg/mL组图像进行分析,发现在20 h对照组细胞划痕宽度基本为0,故以20 h为结束时间。
显微镜下测量划痕的宽度,以0 h划痕宽度为标准对照100%,取所测量时刻的划痕宽度与0 h划痕宽度比值的百分数,所测量时刻划痕宽度越大,则百分数数值越大,表明细胞迁移能力越弱。结果表明当四物饮浓度为150μg/mL时,细胞迁移能力最低(P<0.05),见图2、表1。
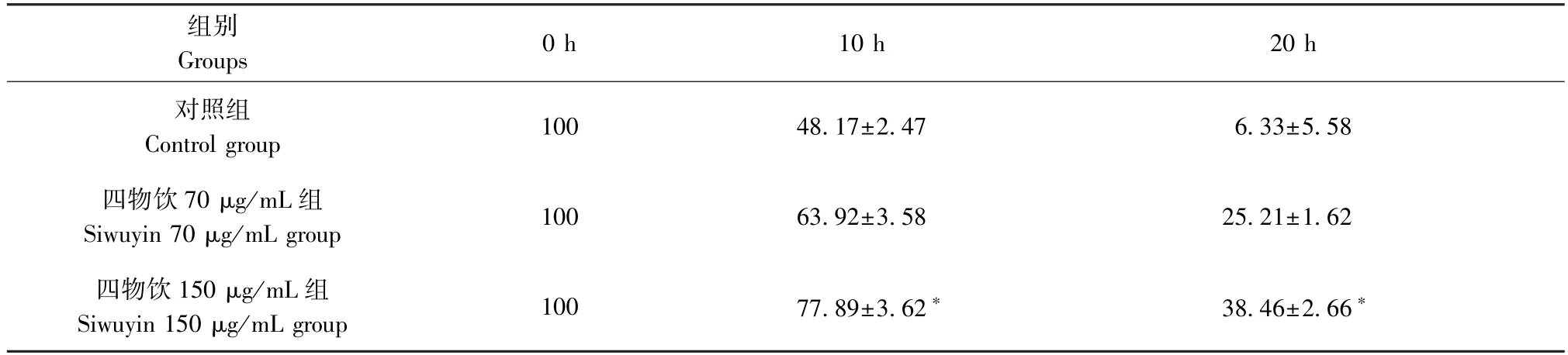
表1 IncuCyte Zoom测量食管癌细胞Eca109的迁移(每小时划痕宽度%,n=3)Table 1 Migration of Eca109 cells was measured by incucyte zoom (scratch width/hour scratch width)
2.4 应用Transwell观察四物饮对细胞侵袭的影响
四物饮组(150μg/mL)与对照组相比,四物饮组细胞穿过Transwell小室的数量明显减少(P<0.05)。结果表明,四物饮150μg/mL时能够明显抑制食管癌细胞侵袭,见图3、表2。

表2 四物饮对食管癌细胞迁移的影响Table 2 The effect of Siwuyin on the migration of esophageal cancer cells
2.5 激光共聚焦显微镜观察四物饮对细胞微丝骨架的影响
与对照组相比,经150μg/mL四物饮干预后细胞微丝排列更加有序,细胞膜上伪足也伸出更少,证实四物饮能够明显抑制食管癌细胞EMT,见图4。
2.6 应用RNA-Seq测序及信息分析明确四物饮对食管癌细胞RNA的影响
应用RNA-Seq测序进一步明确四物饮干预后食管癌细胞中RNA的改变,并通过信息分析明确四物饮主要干预的信号传导通路,从而初步明确四物饮抑制食管癌细胞迁移及侵袭的机制。
RNA-Seq检测经150μg/mL四物饮干预后食管癌细胞RNA变化,结果显示,与对照组相较,四物饮组食管癌细胞中丙氨酸,天门冬氨酸和谷氨酸代谢通路明显改变,而其作用点主要在抑制延胡索酸生成上,见图5。

注:IncuCyte Zoom系统中记录对照组、四物饮70μg/mL组、四物饮150μg/mL组分别于0 h、10 h、20 h图像。如图可见,当四物饮浓度为150μg/mL时,细胞迁移能力最低。图2 应用IncuCyte Zoom观察四物饮对食管癌细胞迁移的影响Note.The images of the control group,Siwuyin 70μg/mL group and Siwuyin 150μg/mL group were recorded in the incucyte zoom system at 0,10 and 20 hours respectively.As shown in the figure,when Siwuyin concentration is 150μg/mL,the cell migration ability is the lowest.Figure 2 The effect of siwuyin on the migration of esophageal cancer cells was observed by incucyte zoom
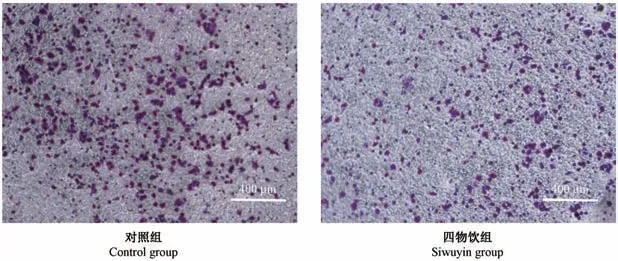
注:经四物饮干预后食管癌细胞穿过小室的细胞数明显减少。图3 应用Transwell观察四物饮对细胞侵袭的影响Note.The number of cells passing through the transwell of esophageal cancer cells decreased significantly after Siwuyin treatment.Figure 3 Transwell was used to observe the effect of Siwuyin on Eca109 cells invasion
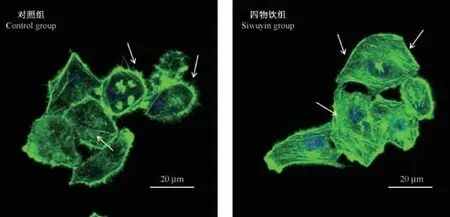
注:经四物饮作用后细胞微丝排列的同向性增强,微丝排列规律,而对照组细胞中微丝排列杂乱无章。图4 激光共聚焦显微镜观察四物饮对食管癌细胞Eca109中微丝排列的影响(油镜)Note.Siwuyin group,the arrangement of microfilaments was enhanced in the same direction.Control group,the arrangement of microfilaments was disordered.Figure 4 Laser confocal microscopy was used to observe the effect of Siwuyin on the arrangement of microfilaments in Eca109 cells(oil mirror)
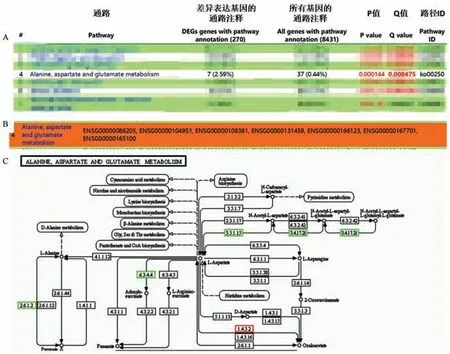
注:A:RNA-seq测食管癌细胞株Eca109经四物饮(150μg/mL)作用后变化,结果显示:丙氨酸,天门冬氨酸和谷氨酸代谢通路被抑制。B:四物饮干预后中改变的RNA。C:丙氨酸,天门冬氨酸和谷氨酸代谢通路。图中绿色标记显示经四物饮作用后明显降低的RNA,其中3.4.17.21、3.5.1.15、6.3.4.4分别为叶酸水解酶1(folate hydrolase 1,FOLH1)、天门冬氨酸酶(asparaginase,ASPA)、腺苷琥珀酸合成酶(adenosine succinate synthetase,ADSS)。图5 应用RNA-Seq测序明确四物饮对食管癌细胞RNA的影响Note.A,RNA-seq was used to detect the changes of esophageal cancer cell line Eca109 after treated with Siwuyin(150μg/mL).The results showed that the alanine,aspartic acid and glutamate pathway was inhibited.B,RNA changed after Siwuyin intervention.C,The alanine,aspartic acid and glutamate pathway.The green marker in the figure shows the significantly reduced RNA after Siwuyin treatment,among which 3.4.17.21,3.5.1.15 and 6.3.4.4 are FOLH1,ASPA and ADSS respectively.Figure 5 RNA-seq was used to determine the effect of Siwuyin on the RNA of esophageal cancer cells
3 讨论
食管癌就其临床表现而言归属于中医“噎膈”范畴。本课题组应用“甘润濡养”之法防治食管癌转移,取得了一定的成果[4-8]。
四物汤由当归、川芎、白芍、熟地黄四味药材组成,藁本内酯(ligustilide),正丁烯基酜内酯(butylidene phthalide),川芎内酯(senkyunolide),阿魏酸(ferulic acid),没食子酸(gallic acid),芍药苷(peoniflorin),焦地黄素A(jioglutin A),梓醇(catalpol)是该方主要活性成分,四物汤类方能够干预多种恶性肿瘤[11],但在食管癌方面没有相关报道。
本次实验证实四物饮能够明显抑制食管癌细胞微丝骨架重排,使食管癌细胞微丝排列更规整,并减少伪足伸出,从而抑制食管癌的迁移能力,进一步抑制食管癌细胞EMT。为进一步明确四物饮的作用机制,我们对四物饮干预的食管癌细胞及对照组细胞给予RNA-Seq测序,结果显示,经四物饮干预后食管癌细胞中丙氨酸,天门冬氨酸和谷氨酸代谢通路明显改变。通路中叶酸水解酶1(folate hydrolase 1,FOLH1),天门冬氨酸酶(asparaginase,ASPA),腺苷琥珀酸合成酶(adenosine succinate synthetase,ADSS)的表达明显降低,从而抑制了延胡索酸的生成。
延胡索酸在三羧酸循环中通常作为一种中间产物,被细胞用来产生能量。大量研究显示延胡索酸水合酶(fumarate hydratase,FH)的缺乏导致延胡索酸堆积,促进了肿瘤细胞EMT的发生[12-13]。英国剑桥大学的研究人员向FH正常的肾上皮细胞中加入可渗入细胞的延胡索酸之后,细胞仍旧发生了EMT,证实了FH的缺失可能并不能直接导致肿瘤转移,而是延胡索酸堆积直接加速了肿瘤转移的出现[14]。本次实验证实四物饮能够抑制延胡索酸的生成,这可能是抑制食管癌转移的机制所在。
综上所述,四物饮能够改变食管癌细胞中丙氨酸,天门冬氨酸和谷氨酸代谢通路,抑制延胡索酸生成,从而抑制食管癌细胞EMT的发生,进而抑制食管癌细胞侵袭及迁移能力。
