基于NF-κB/JNK信号通路研究他克莫司对脊髓损伤模型大鼠的调节作用
2020-05-26张七妹麦宜准郭仁芬
张七妹,柴 芳*,麦宜准,郭仁芬,王 光
(1.三亚市人民医院,海南 三亚 572000;2.海南医学院,海口 570102)
脊髓损伤是一种严重的创伤性神经系统疾病,严重影响患者的生活质量。近年来脊髓损伤的发病率呈现高发趋势,并具有高致残、高致死的临床特征。临床将其分为原发性脊髓损伤和继发性脊髓损伤;原发性脊髓损伤则主要是由于瞬间外力或局部出血导致的不可逆神经细胞直接受损。而继发性脊髓损伤则是由于原发性脊髓损伤后因各种原因引起的持续性病理损伤,其中炎症、氧化应激和神经元凋亡等均参与了继发性脊髓损伤过程[1-4]。脊髓组织发生损伤后,导致脊髓内神经传导信号通路受损,进而诱发神经元持续凋亡、坏死;且受损组织处星形胶质细胞过度活化、增生,最终形成胶质瘢痕[5-6]。因此,神经保护类药物在脊髓损伤的临床治疗及恢复也已成为该领域的研究重点。
他克莫司(Tacrolimus)是一种大环内酯类抗生素,具有较强的免疫抑制作用。大量文献表明,他克莫司还具有较强的神经保护作用,其受体蛋白FKBPP(FK506 binding protein,FKBPP)在神经系统内广泛分布。他克莫司能够与FKBPP受体蛋白结合,进而发挥神经保护及促进神经再生作用。脊髓受损后,其脊髓组织中的神经元会加速发生凋亡;因此,阻断和延缓神经细胞的凋亡对于脊髓损伤后的恢复具有重要意义[7-8]。
因此,本研究旨在通过观察给予他克莫司后脊髓损伤大鼠的恢复状况,并探究其对NF-κB/JNK通路的调节作用。
1 材料和方法
1.1 实验动物
45只SPF级雄性SD大鼠,8周龄,体重为220~240 g,购于广东省医学实验动物中心[SCXK(粤)2017-002],实验在海南医学院[SYXK(琼)2017-0025]进行,研究方案经海南医学院委员会机构动物伦理委员会批准(IACUC 20170524005)。并按实验动物使用的3R原则给予人道的关怀。
1.2 主要试剂与仪器
他克莫司购买自Astellas Ireland公司(日本);TRIzol试剂RNA提取试剂盒(批号∶14105)购买自Invitrogen公司(卡尔斯巴德,美国);PCR扩增试剂盒(批号∶AK9906)购买自TaKaRa公司(日本);NFκB(批号∶1416173)和JNK(批号∶J4750)相关抗体均购买自Sigma公司(美国);IL-4(批号∶H005)和TGF-β(批号∶H034)试剂盒购买自南京建成生物科技有限公司(中国)。
1.3 实验方法
1.3.1 SCI大鼠模型的建立
大鼠在适应两周后,将所有实验用大鼠随机分为三组(n=15):假手术组(Sham),模型组(SCI),他克莫司给药组(SCI+0.3 g/kg)。采用Allen’s法建立T10脊髓损伤动物模型[9-10]。首先将实验大鼠麻醉后,用10 g的铁锤由4 cm,打击强度为4.0 cm×10 g,损伤直径约为3.0 mm。打击后,可见大鼠双后肢及尾部均可发生不同程度抽搐,提示脊髓损伤模型制备成功。假手术组则给予相同手术处理,但是不进行脊髓损伤。术后若大鼠无异常情况,则缝合伤口;并每天腹腔注射给予实验大鼠青霉素8×104U,连续3 d以预防术后感染。造模后每天给予实验大鼠一次他克莫司0.3 mg/kg,连续给21 d。
1.3.2 各组实验大鼠的BBB评分
按照Basso Beattie Bresnahan(BBB)评分方法对大鼠后肢运动功能进行测试[9-10]。分别在第0、1、7、14、21天进行测试。BBB评分将大鼠后肢运动功能分为0~21分,共有22个等级。0分表明后肢无运动能力,21分表明后肢运动功能完全正常。
1.3.3 组织及形态学观察
采用HE染色对神经元形态的变化进行观察。手术21 d后将大鼠麻醉,采用4%多聚甲醛对大鼠进行灌注;切取包括手术区域在内的脊髓组织,并在4%的多聚甲醛中浸泡24 h。然后进行脱水、包埋、切片,厚度约为5μm。进行HE染色,封片后,在显微镜下观察脊髓组织的病理形态学变化。
1.3.4 RT-PCR分析脊髓组织中IL-4和TGF-β mRNA的表达水平
将收集的脊髓组织在液氮中进行匀浆,并加入1 mL裂解液,采用TRIzol总RNA提取试剂盒提取总RNA,并测定相应RNA的浓度。将提取的总RNA(2μL)加入逆转录反应体系混合(共10μL)以合成cDNA。然后按照试剂盒说明书的具体指示测定IL-4和TGF-βmRNA的表达。
1.3.5 脊髓损伤后氧化应激相关指标的测定
行为学时间结束后,采用戊巴比妥钠腹腔注射进行麻醉后,将各组大鼠处死后,收集以损伤取为中心的长约1 cm的脊髓,以冰冷的生理盐水冲洗血液后用于后续实验分析。各指标均采用相应试剂盒进行测定,所有操作均按照试剂盒说明书进行。
1.3.6 Western blot分析
将收集的脊髓组织在液氮中进行匀浆,加入一定量的蛋白裂解液,置于冰上,以200 r/min的速度摇床晃动30 min;然后涡旋10 s,以12000 r/min离心15 min后取上清,并采用BCA法测定蛋白浓度。然后加入相应体积的loading buffer,沸水浴中变性10 min。分别进行SDS-PAGE电泳,电泳完毕后将蛋白转移至PVDF膜上;用5%的胎牛血清(BSA)封闭2 h后加入一抗,平缓摇动于杂交袋,4℃过夜;TBST洗涤3次后加入荧光二抗,平缓摇动于杂交袋内2 h;弃去液体,TBST洗涤3次。凝胶成像系统成像,采用图像分析软件系统分析目的蛋白的相对灰度值。
1.4 统计学方法
数据采用SPSS 22.0软件进行数据的统计分析,数据均以平均数±标准差(±s)表示,采用单因素方差分析进行组件分析;BBB评分则采用重复测量方差分析。以P<0.05认为具有显著性差异。
2 结果
2.1 各组实验大鼠脊髓损伤后的运动恢复情况
术前所有实验大鼠均经过BBB评分测试,所有实验大鼠术前的BBB评分均为21分,表明实验大鼠运动能力均正常,无任何运动障碍。其术后的BBB评分结果如表1所示,造模1 d后,假手术组与模型组相比BBB评分出现显著性差异(P<0.01),表明脊髓损伤模型建立成功;当连续给予他克莫司3 d后,其脊髓功能逐渐恢复,各组差异逐渐加大;当连续给药21 d后,其BBB评分明显升高(P<0.05),表明他克莫司对于大鼠脊髓损伤均有一定的改善作用。
2.2 各组实验大鼠的脊髓组织病理学观察
HE染色结果显示,假手术组大鼠脊髓组织结构完整,纤维走向平行一致,与周围组织结构清晰,且无出血现象和瘢痕组织生成。而模型组大鼠脊髓组织内部出血,结构排列紊乱,且组织纤维错乱,脊髓空洞形成,脊髓组织出现明显受损。当给予他克莫司后,其脊髓组织损伤明显减小,脊髓神经元明显增加,神经纤维排列整体,脊髓灰质白质界线较为清晰,空洞明显减少,见图1。
表1 术后各组实验大鼠在造模后不同时间的BBB评分结果(±s)Table 1 BBB scores of rats in each group on different days after operation

表1 术后各组实验大鼠在造模后不同时间的BBB评分结果(±s)Table 1 BBB scores of rats in each group on different days after operation
注:与Sham组相比,*P<0.05,**P<0.01;与SCI组相比,#P<0.05。Note.Compared with Sham group,*P<0.05,**P<0.01.Compared with SCI group,#P<0.05.
组别Groups第1天1 d第3天3 d第7天7 d第14天14 d第21天21 d假手术组Sham 18.63±2.31 19.73±1.15 19.48±1.24 20.03±1.06 19.78±0.96模型组SCI 2.43±1.97** 3.72±1.32** 7.58±1.65** 9.64±1.42* 10.36±1.05*给药组SCI+0.3 mg/kg 2.25±1.45 5.21±1.97 9.84±1.26 13.27±0.79 18.31±0.84#
2.3 各组实验大鼠脊髓组织中IL-4 mRNA和TGF-βmRNA的表达水平
术后21 d后,采用RT-PCR对各组实验大鼠脊髓组织中的IL-4 mRNA和TGF-βmRNA表达水平进行测定。实验结果显示,与假手术组相比,模型组中IL-4 mRNA和TGF-βmRNA表达量均显著性升高(P<0.05);当连续给予他克莫司(0.3 mg/kg)后,其IL-4 mRNA和TGF-βmRNA的蛋白表达量显著性降低(P<0.05),表明他克莫司能够显著性抑制IL-4 mRNA和TGF-βmRNA的表达,见图2。
2.4 各组实验大鼠脊髓组织氧化应激相关指标的变化
实验结果显示,模型组组中CAT(图3A)、SOD(图3B)、GSH-Px(图3C)活性均较与假手术组显著性降低(P<0.05),MDA(图3D)含量显著性升高(P<0.05),表明模型组大鼠机体发生氧化损伤,当给予他克莫司后,机体中CAT、SOD、GSH-Px活性显著性升高,MDA含量显著性降低(P<0.05),表明他克莫司对脊髓损伤导致的实验大鼠氧化应激损伤具有一定的保护作用,见图3。
2.5 他克莫司对脊髓损伤大鼠脊髓组织中NFκB/JNK信号通路的调节作用
与假手术组相比,模型组中NF-κB p-p65/NFκB p-p65(图4A、4B)和p-JNK/JNK(图4A、4C)的表达量比值显著性升高;当给予他克莫司后,其NFκB p-p65/NF-κB p-p65和p-JNK/JNK表达量比值显著性降低;这表明他克莫司对于NF-κB/JNK信号通路具有明显的调节作用,见图4。
3 讨论
脊髓损伤在临床诊治过程中非常常见,但是其病理机制较为复杂。有研究表明脊髓损伤后诱发的神经毒性反应会加重神经元的丢失,进而导致神经功能障碍。机体的过炎症反应对神经元的丢失起着至关重要的作用[11-13]。正常情况下,脊髓受损后一定程度的炎症反应,能够加速受损组织修复,对于机体组织有着一定的保护作用。当机体处于过炎症状态时,则会加速神经元丢失。因此,有效的抑制脊髓损伤机体组织的过炎症反应,对于神经功能的保护及恢复起着重要作用。他克莫司作为一种免疫抑制类药物,具有减少神经细胞凋亡、促进神经细胞及组织再生的功能,能够作用于中枢神经系统类疾病,发挥神经保护作用。他克莫司必须与其受体蛋白相结合才能发挥作用,研究表明他克莫司的受体蛋白广泛存在于免疫系统和神经系统。与其他神经营养因子类药物相比较,他克莫司口服后即可起效,且更加容易通过血脑屏障;因此,他克莫司在神经保护相关领域研究中得到了广泛的关注[14-15]。
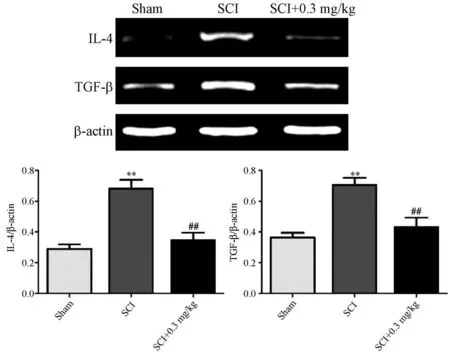
注:与Sham组相比,**P<0.01;与SCI组相比,##P<0.01。图2 各组实验大鼠脊髓组织中IL-4 mRNA和TGF-βmRNA的表达水平Note.Compared with Sham group,**P<0.01.Compared with SCI group,##P<0.01.Figure 2 The expression levels of IL-4 mRNA and TGF-βmRNA in spinal cord tissue of rats in each group
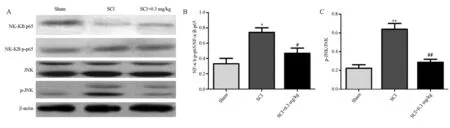
注:与Sham组相比,*P<0.05,**P<0.01;与SCI组相比,#P<0.05,##P<0.01。图4 各组脊髓损伤大鼠脊髓组织中NF-κB p-p65、NF-κB p-p65、p-JNK和JNK的蛋白表达量变化Note.Compared with Sham group,*P<0.05,**P<0.01.Compared with SCI group,#P<0.05,##P<0.01.Figure 4 Changes of protein expressions of NF-κB p-p65,NF-κB p-p65,p-JNK and JNK in spinal cord tissues of rats with spinal cord injury in each group
脊髓组织由于富含各种脂质类成分,因此对于氧化反应较为敏感。在正常的生理状态下,机体组织产生的超氧阴离子、过氧化氢等产物均可被SOD、CAT等抗氧化酶所清除,机体的氧化与抗氧化体系处于一种动态平衡过程,因此不会对于脊髓组织产生病理性损伤。然而,当机体受损后,机体的自我保护机制会使得机体处于过氧化状态,进而导致氧化应激损伤[16-18]。本实验结果显示,脊髓损伤大鼠机体处于氧化应激损伤状态,而他克莫司对于这种氧化应激导致的损伤具有一定的保护作用。
氧化应激损伤能够诱发或加重机体的炎症反应。有研究表明,机体组织受损后,会导致各种免疫相关细胞浸润在损伤处,并分泌各种炎症因子和促炎因子,例如IL-4、TGF-β等,促进机体组织的自我修复。而过度的IL-4、TGF-β分泌,则会导致硬膜外瘢痕的形成。而NF-κB信号通路的抑制,则能够显著性降低IL-4和TGF-β的表达。JNK信号通路则是参与机体应激反应的重要信号通路,对于神经元细胞的凋亡和再生起着中重要作用[19-22]。因此,本研究测定了IL-4和TGF-β的表达水平,以及NFκB/JNK信号通路相关蛋白,结果显示机体处于过炎症反应,而他克莫司对于脊髓损伤诱发的炎症反应具有一定的抑制作用。然而,他克莫司在临床应用中部分会发生剂量依赖性的轻、中度神经毒性作用,并且其神经毒性的发生机制仍不清楚。这极大的限制了他克莫司的临床使用。因此,他克莫司的相关衍生物的研制就显得极为重要。
综上所述,本研究结果表明他克莫司对大鼠脊髓损伤具有一定的保护作用,其作用机制可能是通过抑制NF-KN/JNK信号通路,降低脊髓损伤组织的炎症因子释放,进而减轻机体炎性反应、氧化应激损伤,发挥神经保护作用。但是由于本实验样本及其数量的局限性,其在临床的推广及应用仍需要进一步的研究。
