黄芪甲苷对脑缺血再灌注大鼠炎症因子及超微结构的影响
2020-05-26靳晓飞张彐宁周晓红高维娟
靳晓飞,张彐宁,周晓红,高维娟
(河北中医学院,河北省心脑血管病中医药防治研究重点实验室,石家庄 050091)
脑缺血再灌注损伤(cerebral ischemiareperfusion injury,CIRI)归属于中医“中风”范畴,“气虚血瘀、经脉不通”是其主要病机,使用补气活血药可达到良好的治疗效果[1]。现代医学研究显示,脑缺血再灌注损伤的发生机制至今仍未完全阐明,而再灌注期间大量炎症因子的释放,引发炎症级联反应,被认为是脑缺血后再灌注引起损伤的重要机制之一[2-3]。中药黄芪是临床常用补气要药,被誉为补气药中的“耆长”。大量文献记载和临床研究证实,黄芪不仅具有补气的作用,还兼具活血化瘀、通经活络之功,在防治脑缺血再灌注损伤方面效果显著[4-5]。黄芪甲苷(astragaloside IV,AST)是黄芪的重要活性单体成分,是黄芪补气行血、通经活络的物质基础,常作为检测黄芪质量优劣的参考指标。本课题组前期研究发现,黄芪甲苷可有效减轻脑缺血再灌注损伤,发挥神经保护作用[6],但是其具体作用机制以及对脑组织超微结构的影响,尚不明确。本研究重点探讨黄芪甲苷对脑缺血再灌注大鼠炎症因子及超微结构的影响,为黄芪甲苷拮抗脑缺血再灌注损伤提供新的研究依据。
1 材料和方法
1.1 实验动物
SD大鼠(雄性,健康清洁级,40只,体重260~280 g,鼠龄7~8周),购买于北京维通利华实验动物公司[SCXK(京)2016-0011],饲养在河北中医学院实验动物中心[SYXK(冀)2017-005]。饲养环境:温度为22℃~25℃,相对湿度为50%~60%,进食自由。动物实验通过河北中医学院动物伦理委员会批准(DWLL2018032)。实验严格遵循3R原则。
1.2 主要试剂与仪器
黄芪甲苷购买于上海士峰生物科技公司,规格∶每瓶20 mg,纯度≥98%,生产批号∶15082136;尼莫地平注射液、TTC染液、磷酸盐缓冲溶液(PBS)、戊巴比妥钠、大鼠模型制作线栓(型号∶2838A3)、甲苯胺蓝水溶液均购买于北京索莱宝生物公司;其他试剂均是国产分析纯。
脑切片模具(型号∶BS-300C)购置于北京西浓科技公司;组织包埋机(型号∶EG11508)、全自动切片机(型号∶RM2255)、倒置光学显微镜(型号∶DMI3000B)均购置于Leica公司;透射电子显微镜(型号∶H-7650)购置于HITACHI公司。
1.3 实验方法
1.3.1 实验分组、给药和模型建立
应用随机单位组设计分组法,将40只SD雄性大鼠随机分为4组∶假手术组(Sham)、模型组(脑缺血再灌注损伤组,Model)、黄芪甲苷组(AST)和尼莫地平组(阳性药物组,NIM)。采用大脑中动脉闭塞(MCAO)法建立大鼠局灶性脑缺血再灌注损伤模型[7]:大鼠适应饲养1周,手术前4 h禁止给水、12 h禁止喂食;用2%戊巴比妥钠(40 mg/kg)腹腔注射麻醉大鼠,将大鼠固定在小动物手术台上,小心备皮,酒精棉球消毒;从大鼠颈部正中切开一小口,逐层分离组织,找到左侧颈总动脉、颈外动脉、颈内动脉,将颈外动脉结扎、阻断,选用特定线栓通过颈外动脉残端插入,后经颈内动脉抵达大鼠大脑中动脉,实现大脑中动脉缺血闭塞;线栓阻塞大脑中动脉(缺血)2 h后拔出,再灌注24 h;选取造模成功大鼠,处死,取材,检测相关指标。其中,黄芪甲苷组(给药浓度为20 mg/kg)、尼莫地平组(给药浓度为10 mg/kg)于造模前一周腹腔注射给药,每24 h追加给药一次;假手术组仅分离暴露颈总动脉、颈外动脉和颈内动脉,不做线栓插入处理;假手术组和模型组均给予等量生理盐水腹腔注射处理。需说明的是,动物造模有死亡现象,本研究仅将造模成功的大鼠列为实验对象,造模成功率在80%以上。
1.3.2 Zea Longa评分法检测大鼠神经功能
评分标准∶0分,没有任何神经功能缺损,大鼠正常;1分,对侧前爪不能伸展完全;2分,向对侧转圈行走;3分,向对侧行走倾倒;4分,意识不清,不能站立行走。每组大鼠于再灌注24 h后立即做Zea Longa评分,得1、2或3分者视为造模成功。
1.3.3 TTC染色检测脑梗死体积
大鼠做完神经功能评分后,用2%戊巴比妥钠腹腔注射麻醉大鼠,断头取脑。将完好的脑组织放在-20℃冰箱,速冻15 min,应用脑切片模具对大脑行冠状位切片(2 mm)。将脑切片置于2% TTC染液,放在切片盒,37℃避光反应30 min。其间,每隔10 min用镊子翻动脑切片,保证染色均匀。随后,吸取TTC染液,4%多聚甲醛固定脑切片1 h,拍照。正常脑组织呈现红色,脑梗死组织呈现白色。用Image Pro Plus 6.0软件对拍照结果进行分析,计算脑梗死体积。
1.3.4 ELISA法检测TNF-α、IL-6、IL-1β含量
各组取同质量(100 mg)缺血区脑皮质组织,生理盐水清洗3遍,滤纸吸干组织表面水分,天平称重,用预冷生理盐水将组织制成组织匀浆(脑组织g∶生理盐水mL=1∶9),低温高速离心10 min,取上清液。参照ELISA试剂盒说明书步骤操作,酶标仪检测各孔样本OD值,利用标准品浓度和OD值制作标准曲线,参照标准曲线,依据样本OD值,计算TNF-α、IL-6、IL-1β的相应含量。
1.3.5 尼氏染色观察神经细胞形态学变化
制缺血区脑皮质石蜡切片,二甲苯常规脱蜡,100%、95%、90%、80%、70%、50%梯度酒精脱水,1%甲苯胺蓝溶液染色,置于60℃恒温箱反应40 min,蒸馏水冲洗3次(每次3 min),95%酒精分色,梯度酒精脱水,二甲苯透明,封片,倒置显微镜400倍镜下观察、拍照。正常神经元中尼氏体数量丰富;当神经元受损时,尼氏体可减少、解体或消失。
1.3.6 透射电镜观察神经细胞超微结构变化
制作缺血区脑皮质1 mm3组织块,PBS浸洗组织3遍,4%戊二醛固定组织2 h,PBS浸洗组织3遍,1%锇酸固定组织2 h,50%、70%、80%、90%、100%梯度丙酮脱水,纯包埋剂处理,37℃、60℃恒温箱聚合,超薄切片机切片(厚度50 nm左右),醋酸铀、酸铅双染,透射电子显微镜观察细胞超微结构。
1.4 统计学方法
实验结果用SPSS 19.0软件进行统计,数据用平均数±标准差(±s)表示,各组数据之间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 黄芪甲苷对大鼠神经功能评分的影响
假手术组大鼠神经功能评分为0,无神经功能缺损症状;与假手术组相比,模型组神经功能评分明显升高(P<0.05),大鼠出现对侧前爪不能伸展完全、向对侧转圈行走、向对侧行走倾倒等不同程度的神经功能缺损症状;与模型组相比,黄芪甲苷组和尼莫地平组神经功能评分有所降低(P<0.05),神经功能缺损有所改善,差异有统计学意义(见表1)。
表1 黄芪甲苷对大鼠神经功能评分的影响(±s)Table 1 Effects of astragaloside IV on nerve function score in rats
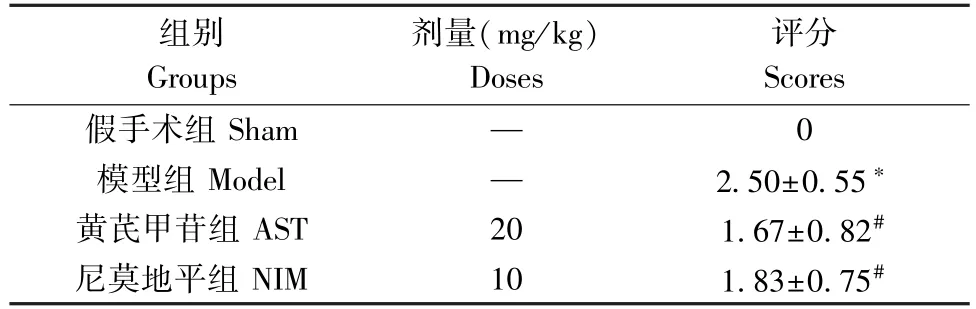
表1 黄芪甲苷对大鼠神经功能评分的影响(±s)Table 1 Effects of astragaloside IV on nerve function score in rats
注:与假手术组相比,*P<0.05;与模型组相比,#P<0.05。Note.Compared with the sham group,*P<0.05.Compared with the model group,#P<0.05.
组别Groups剂量(mg/kg)Doses评分Scores假手术组Sham — 0模型组Model — 2.50±0.55*黄芪甲苷组AST 20 1.67±0.82#尼莫地平组NIM 10 1.83±0.75#
2.2 黄芪甲苷对大鼠脑梗死体积的影响
假手术组未见脑梗死病灶;与假手术组相比,模型组脑梗死体积明显增加(P<0.05);与模型组相比,黄芪甲苷组和尼莫地平组脑梗死体积均减少(P<0.05),差异有统计学意义(见图1)。
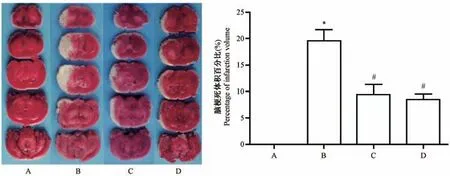
注:A:假手术组;B:模型组;C:黄芪甲苷组;D:尼莫地平组。与假手术组相比,*P<0.05;与模型组相比,#P<0.05。图1 黄芪甲苷对大鼠脑梗死体积的影响Note.A,Sham group.B,Model group.C,AST group.D,NIM group.Compared with the sham group,*P<0.05.Compared with the model group,#P<0.05.Figure 1 Effects of astragaloside IV on the volume of cerebral infarction in rats
2.3 黄芪甲苷对炎症因子TNF-α、IL-6、IL-1β含量的影响
与假手术组相比,模型组炎症因子TNF-α、IL-6、IL-1β含量均升高(P<0.05),提示炎性损伤显著;与模型组相比,黄芪甲苷组和尼莫地平组TNFα、IL-6、IL-1β含量均下降(P<0.05),差异有统计学意义(见表2)。
表2 黄芪甲苷对TNF-α、IL-6、IL-1β含量的影响(±s,pg/mL)Table 2 Effects of astragaloside IV on the contents of TNF-α、IL-6 and IL-1β
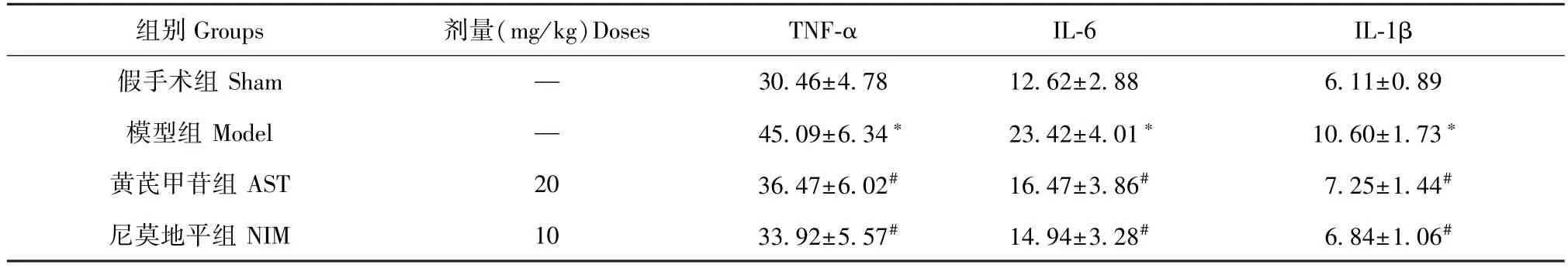
表2 黄芪甲苷对TNF-α、IL-6、IL-1β含量的影响(±s,pg/mL)Table 2 Effects of astragaloside IV on the contents of TNF-α、IL-6 and IL-1β
注:与假手术组相比,*P<0.05;与模型组相比,#P<0.05。Note.Compared with the sham group,*P<0.05.Compared with the model group,#P<0.05.
组别Groups 剂量(mg/kg)Doses TNF-α IL-6 IL-1β假手术组Sham — 30.46±4.78 12.62±2.88 6.11±0.89模型组Model — 45.09±6.34* 23.42±4.01* 10.60±1.73*黄芪甲苷组AST 20 36.47±6.02# 16.47±3.86# 7.25±1.44#尼莫地平组NIM 10 33.92±5.57# 14.94±3.28# 6.84±1.06#
2.4 黄芪甲苷对神经细胞形态学变化的影响
假手术组神经细胞和尼氏体数量丰富,细胞规整、排列整齐,未见坏死细胞;与假手术组相比,模型组神经细胞出现变形,细胞排列混乱,尼氏体数量明显减少(P<0.05);与模型组相比,黄芪甲苷组和尼莫地平组细胞状态得到改善,尼氏体数量增多(P<0.05),细胞排列较为整齐,细胞形状趋于规整(见图2)。
2.5 黄芪甲苷对神经细胞超微结构变化的影响
假手术组神经细胞超微结构清晰正常,细胞膜完好,细胞核规整,染色质分布均匀;与假手术组相比,模型组细胞核变形,核出现固缩,染色质分布不均匀,少量细胞可见细胞膜破损、线粒体肿胀且数量减少、内质网扩张等细胞坏死表现;与模型组相比,黄芪甲苷组和尼莫地平组细胞超微结构较为清晰,细胞核较为规整,核固缩减轻,染色质分布较为均匀,线粒体肿胀减轻且数量增多,坏死细胞减少(见图3)。
3 讨论
脑血管疾病(cerebrovascular disease,CVD)与肿瘤、心脏病已并列成为导致人类死亡的三大疾病,严重影响着人类生活和健康,危害巨大[8]。脑血管疾病根据其病因可分为出血性脑血管病和缺血性脑血管病两大类,其中缺血性脑血管病更为多见,其发病率和死亡率不断攀升,危害巨大。脑缺血再灌注损伤是缺血性脑血管病治疗和恢复过程中的一个重要病理过程,目前仍然是阻碍缺血性脑血管病临床治疗效果的一大难题。脑缺血再灌注损伤的产生机制涉及多方面因素,炎症反应在其中扮演着重要角色[2,9]。研究发现,脑缺血再灌注可产生大量氧自由基,继而激活炎性细胞,释放大量炎症因子,包括肿瘤坏死因子α(TNF-α)、白细胞介素-6(IL-6)和白细胞介素-1β(IL-1β)等,其中TNF-α是大多数炎症因子的启动因子,TNF-α、IL-6的产生可激活星形胶质细胞和小胶质细胞分泌IL-1β,促使NOS生成增加,引发炎症反应。与此同时,大量炎症因子的释放可导致更多的炎性细胞集聚和浸润,形成一种相互作用、相互增强的炎症级联反应,引起恶性循环,最终造成再灌注损伤[10]。
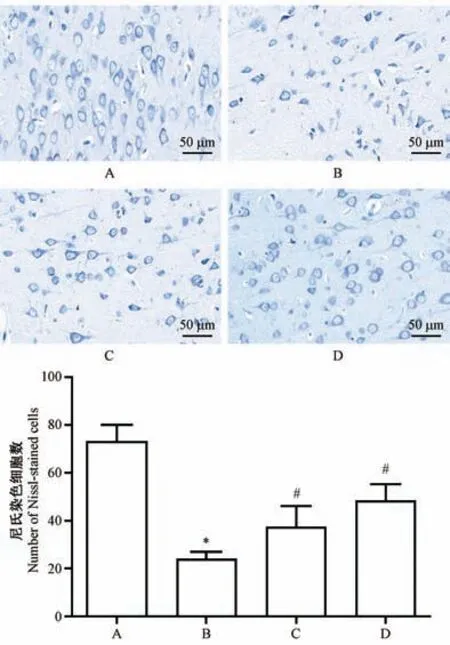
注:A:假手术组;B:模型组;C:黄芪甲苷组;D:尼莫地平组。与假手术组相比,*P<0.05;与模型组相比,#P<0.05。图2 黄芪甲苷对神经细胞形态学变化的影响(尼氏染色)Note.A,Sham group.B,Model group.C,AST group.D,NIM group.Compared with the sham group,*P<0.05.Compared with the model group,#P<0.05.Figure 2 Effects of astragaloside IV on the morphological changes of nerve cells(Nissl staining)
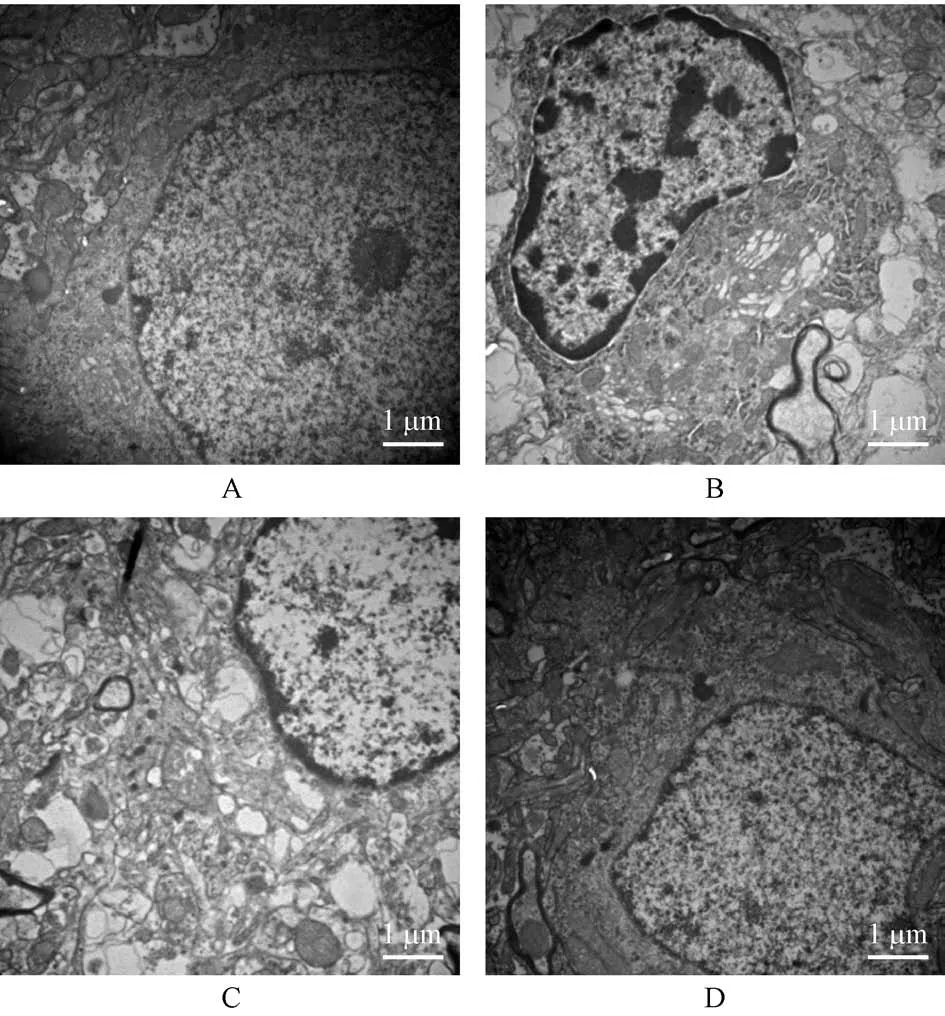
注:A:假手术组;B:模型组;C:黄芪甲苷组;D:尼莫地平组。图3 黄芪甲苷对神经细胞超微结构变化的影响Note.A,Sham group.B,Model group.C,AST group.D,NIM group.Figure 3 Effects of astragaloside IV on the ultrastructural changes of nerve cells
黄芪是一味临床常用补气要药,收录在《中华人民共和国药典》,素有“补气药之耆长”、“补气升阳之要药”、“疮家圣药”等美誉[11]。大量医籍记载,黄芪补气兼活血,具有良好的活血化瘀的作用。《名医别录》首载其能“逐五脏间恶血”,《药类法象》指出黄芪善冶“血脉不行”,《本草纲目》言其“生血活血”;《金匮要略》中黄芪桂枝五物汤以黄芪为君药,治疗血痹、中风后遗症,取得良好效果;《医林改错》中补阳还五汤重用黄芪,意在补益元气,使气盛则血行,瘀去而络脉通畅,广泛用于治疗缺血性中风及脑缺血后遗症[4,12]。黄芪的主要化学成分包括黄芪皂苷类、黄芪黄酮类和黄芪多糖类,其中黄芪甲苷是黄芪皂苷类的活性单体成分,被认为是黄芪补气、活血、通络的重要物质基础[13-14]。现代药理学研究发现,黄芪甲苷具有抗炎、抗衰老、抗凋亡、抗氧化、调节能量代谢、调控自噬等生物活性[15-17]。本课题组前期研究发现,黄芪甲苷可有效降低脑缺血再灌注大鼠脑梗死体积,改善神经功能障碍,抑制缺血再灌注损伤,发挥脑保护作用,但是其具体作用机制以及对神经细胞超微结构的影响,尚不明确,亟待探究。
本研究在前期工作的基础上,以SD大鼠为实验对象,通过MCAO法建立大鼠脑缺血再灌注损伤模型,在动物水平,从炎症反应角度,探讨黄芪甲苷对脑缺血再灌注大鼠炎症因子及超微结构的影响。实验结果显示,脑缺血再灌注损伤大鼠神经功能缺损症状明显,脑梗死体积明显增加,神经细胞超微结构出现明显病变,细胞核变形、固缩,染色质分布不均匀,炎症因子TNF-α、IL-6、IL-1β含量均上升;当分别给予黄芪甲苷和尼莫地平处理后,大鼠神经功能缺损症状减轻,脑梗死体积减少,神经细胞超微结构得到改善,炎症因子TNF-α、IL-6、IL-1β含量均下降,表明黄芪甲苷减轻大鼠脑缺血再灌注损伤、改善神经细胞超微结构,与抑制炎症反应、降低炎症因子TNF-α、IL-6、IL-1β的表达密切相关。该研究结果为黄芪甲苷抑制脑缺血再灌注损伤的抗炎作用机制提供了一定理论依据。然而,黄芪甲苷发挥抗炎作用的具体信号转导通路如何?其抗炎作用与黄芪甲苷其他生物活性是否存在相互联系?尚需进一步探究,这也将是我们课题组下一步研究的重点。
