MRTF-A诱导自噬从而缓解脑缺血再灌注大鼠皮层神经细胞损伤*
2020-05-26赵玉洁李瑞雯曹晓璐
李 翔,张 玲,贾 粤,李 桢,赵玉洁,马 兰,李瑞雯,李 力,曹晓璐△
(1武汉科技大学医学院公共卫生学院环境卫生与职业医学教研室,职业危害识别与控制湖北省重点实验室,湖北武汉430081;2武汉科技大学附属普仁医院病理科,科教部,湖北武汉430081)
脑卒中是严重危害人类健康的疾病,2018年我国现患脑卒中病人约1300万,而缺血性脑卒中(cerebral ischemic stroke,CIS)占60%~70%[1]。目前,针对CIS的治疗手段主要是在有效时间窗内实施溶栓治疗,尽快恢复血供以防止缺血区域扩散[2]。一旦超过有效时间窗,可能导致脑细胞不可逆损伤甚至死亡,发生缺血性脑卒中再灌注(cerebral ischemic stroke-reperfusion,CIS/R)损伤,危及生命[3-4]。CIS/R损伤的发生机制如何?是否能有效防止病程发展至CIS/R期?为此本研究探讨了CIS/R损伤的机制,为寻找有效的治疗方法提供科学依据。
SAP蛋白家族的心肌素相关转录因子A(myocardin-related transcription factor-A,MRTF-A)由 807个氨基酸残基组成,是血清反应因子(serum response factor,SRF)的辅助激活因子,在脑组织中表达并参与基因转录调控[5]。研究表明,通过组蛋白乙酰化修饰,MRTF-A可抑制缺血再灌注介导的神经细胞凋亡,但其具体分子机制并未完全阐明[6]。本研究拟在整体动物水平,检测脑缺血再灌注诱导的神经细胞损伤时,MRTF-A对神经细胞凋亡和自噬的影响及相关蛋白的表达调控,初步探讨MRTF-A抑制大鼠脑缺血再灌注损伤的保护机制。
材料和方法
1 动物及处理方法
6周龄SPF级雄性SD大鼠,体重250~300 g,购自三峡大学实验动物中心,许可证号为SCXK(鄂)2018-0045。室温、常规大鼠饲料喂养,动物自由饮水。采用大脑中动脉栓塞法(middle cerebral artery occlusion,MCAO)缺血2 h再灌注24 h建立脑缺血再灌注模型[7]。采用随机数字表法将90只SD大鼠随机分成3组:假手术组(sham组)30只、模型组(MCAO/R组)30只和实验组(Lv+MCAO/R组)30只。假手术组和模型组注射慢病毒空载体,实验组注射MRTF-A高表达慢病毒,注射7 d后假手术组和实验组先各随机抽取5只大鼠用于验证MRTF-A是否成功高表达,其余模型组和实验组大鼠构建脑缺血再灌注模型,假手术组实施手术但不插线栓。
2 主要试剂与器材
MRTF-A高表达慢病毒由上海吉凯基因技术有限公司设计合成;小鼠抗MRTF-A单抗(SC-390324)购自Santa Cruz;小鼠抗β-actin单抗(BM0627)购自BOSTER;兔抗beclin-1单抗(ab207612)购自Abcam;兔抗LC3-I和LC3-II单抗(AF5402)购自AFFINITY;兔抗Bcl-2单抗(bsm-52023R)、小鼠抗Bax单抗(bsm-33283M)和兔抗LC3多抗(bs-8878R)购自BIOSS;山羊抗兔、抗鼠Cy3购自Solarbio;TUNEL试剂盒(MA0223)购自Meilunbio。脑立体定位仪(江苏赛昂斯生物技术有限公司);激光共聚焦显微镜(奥林巴斯,FV1000);透射电镜(transmission electron microscope,TEM)由中国科学院武汉病毒研究所分析测试中心提供。
3 主要方法
3.1 MCAO再灌注损伤模型的构建 将直径0.23 mm尼龙线一端反复浸入熔化的石蜡5次,待尼龙线表面石蜡凝固后即制作成栓线备用。大鼠用10%水合氯醛腹腔注射麻醉(3.5 mL/kg),仰卧固定于手术台上,取颈部正中切口,剪开筋膜,钝性分离右侧胸锁乳突肌与胸骨舌骨肌,暴露右侧颈总动脉(common carotid artery,CCA)和迷走神经并分离。沿着右侧颈外动脉(external carotid artery,ECA)和颈内动脉(internal carotid artery,ICA)分叉,分离ECA和ICA,结扎ECA。用动脉夹夹住CCA和ICA,在ECA距动脉分叉5 mm处用眼科剪剪一小口,将栓线缓慢向ICA插入,至ICA与ECA交叉处时,去掉ICA动脉夹,调整插线角度,继续将线栓缓慢向ICA入颅方向推进,插入深度(18.0±0.5)mm为止。将栓线与ECA结扎固定,松开CCA动脉夹,剪除线栓多余末端,最后缝合筋膜、皮肤。缺血2 h之后,抽出线栓,结扎ECA近分叉端,假手术组除不插线外,其余手术步骤同模型组。
3.2 脑室注射慢病毒及免疫荧光验证MRTF-A的高表达 实验组大鼠麻醉后,固定于脑立体定位仪上,在右侧脑室注射2 μL Lv-MRTF-A,滴度为8×1011TU/L(TU:transduction unit),注射位点为囟点后1.72 mm,矢状缝旁开2 mm,深2.6 mm处。慢病毒注射7 d后,用10%水合氯醛腹腔注射麻醉大鼠,打开胸腔,用4%多聚甲醛心脏灌流固定15 min,取出脑组织后继续在4%多聚甲醛中浸泡24 h,梯度乙醇脱水,石蜡包埋切片。用免疫荧光法验证慢病毒注射后是否成功高表达MRTF-A,在此基础上构建脑缺血再灌注模型。
3.3 神经功能评分和2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)染色 缺血再灌注24 h后,对大鼠进行神经行为学变化观察,根据Longa’s 5分法评价大鼠神经功能。活动正常,无神经功能缺损;左前肢不能完全伸展为1分;爬行时向左侧转圈为2分;爬行时向左侧倾倒为3分;不能自发行走,意识丧失为4分。实验中将评分1~4分大鼠纳入研究。术后24 h,将3组大鼠麻醉后取脑,-20℃冷冻30 min,将鼠脑从额极向后连续冠状切面,约2 mm切一层,将脑片置于1%的TTC溶液中,于37℃避光孵育20 min,再置于4%多聚甲醛溶液中固定24 h,扫描仪扫描获取图像,正常脑组织呈鲜红色,梗死脑组织呈白色。ImageJ软件测定各脑片白色梗死区域面积,最后计算梗死体积百分率。
3.4 Western blot检测皮层组织自噬与凋亡相关蛋白的表达 取注射点周围缺血半暗带5 mm范围皮层组织,RIPA裂解液提取总蛋白,BCA法测定蛋白浓度。配制12%的SDS-PAGE分离胶,5%的浓缩胶,50 μg蛋白变性后上样,跑胶,转膜,5%脱脂奶粉封闭2 h,孵育I抗(MRTF-A,1∶2 000;β-actin,1∶500;beclin-1,1∶1 000;LC3-I和LC3-II,1∶2 000;Bcl-2,1∶500;Bax,1∶1 000),4℃过夜,TBST洗I抗3次,加入II抗室温孵育2 h,TBST洗II抗后加ECL显影液进行显影,X线胶片曝光、显影、定影,冲洗胶片并扫描成像,使用ImageJ软件进行灰度值分析,以目的蛋白和β-actin的比值进行相对定量。
3.5 TUNEL法分析神经细胞凋亡率联合免疫荧光检测LC3蛋白的表达 石蜡切片60℃烤片1 h,二甲苯脱蜡后梯度乙醇复水,Proteinase K工作液37℃恒温孵育30 min,加入TUNEL反应液,37℃孵育1 h(MCAO/R及Lv+MCAO/R组加入50 μL TdT+450 μL dUTP液;假手术组不加dUTP,仅加入50 μL dUTP液),滴加50 μL FITC液,37℃避光孵育1 h,10%山羊血清封闭30 min,湿盒中孵育I抗(LC3,1∶150)4℃冰箱过夜,孵育II抗(Cy3,1∶200),DAPI核染甘油封片。TUNEL阳性细胞形态多样化且呈绿色荧光,激光共聚焦显微镜下对TUNEL阳性细胞计数并拍照,随机选取大脑皮层S1HL区缺血半暗带5个视野用于分析凋亡率及LC3蛋白表达分布。
3.6 TEM观察神经细胞结构及自噬溶酶体 取大鼠右侧大脑皮层S1HL区缺血半暗带约1 mm×1 mm×1 mm组织,生理盐水清洗,用2.5%戊二醛二甲砷酸钠固定液固定2~3 h,二甲砷酸钠缓冲液洗2次后,在1%四氧化锇中作后固定、包埋、超薄切片,醋酸双氧铀和枸橼酸铅双重染色后,用TEM观察神经细胞结构及自噬溶酶体,并拍照记录。
4 统计学处理
应用SPSS 22.0统计学软件分析,数据以均数±标准差(mean±SD)表示。两独立样本均数比较用t检验,多组间比较采用单因素方差分析,方差齐时用Bonferroni法进行多重比较,不齐时用Dunnett法。以P<0.05为差异有统计学意义。
结 果
1 高表达MRTF-A后神经功能评分及脑梗死体积的变化
假手术组30只大鼠全部存活;模型组造模成功23只,5只死亡,神经功能评分为0的2只舍去,造模成功率为76.67%;实验组造模成功22只,4只死亡,神经功能评分为0的4只舍去,造模成功率为73.33%。
实验组慢病毒脑室注射后7 d,MRTF-A荧光表达强度显著高于假手术组,差异有统计学意义(P<0.01),见图1A,在此基础上构建实验组MCAO模型。假手术组神经功能评分和脑梗死体积均为0;模型组神经功能评分为2.57±0.20,梗死体积为(31.67±2.73)%;实验组神经功能评分为1.71±0.18,梗死体积为(12.00±1.16)%,与模型组相比均显著降低(P<0.01),见图1B、C。
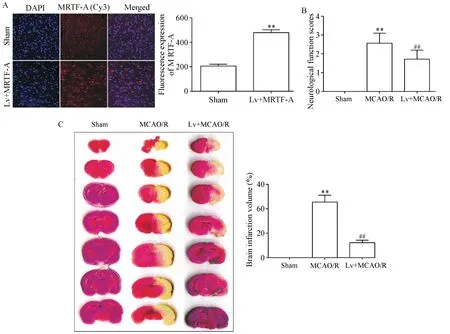
Figure 1.The effect of high expression of MRTF-A on cerebral ischemia-reperfusion injury.A:high expression of MRTF-A by lentiviral injection(×400,n=5);B:neurological function score;C:TTC staining and percentage of cerebral infarction volume.Mean±SD.n=5 in A;n=7 in B and C.**P<0.01 vs sham group;##P<0.01 vs MCAO/R group.图1 高表达MRTF-A对脑缺血再灌注损伤的影响
2 脑缺血再灌注损伤对缺血半暗带神经细胞形态学影响
TEM观察显示,假手术组神经细胞核膜完整,为双层膜结构(图2A1),核周线粒体嵴纹理、内质网、高尔基体形态清晰排列紧凑(图2A2),自噬溶酶体少见(图2A);模型组神经细胞核膜结构缺损,部分区域呈单层膜结构(图2B1),线粒体、内质网、高尔基体等细胞器明显肿胀变形,大量空泡形成(图2B2),伴随有自噬溶酶体形成(图2B);与模型组相比,实验组核膜形态恢复为双层膜结构(图2C1),线粒体肿胀程度缓解空泡较少,嵴纹理清晰(图2C2),自噬溶酶体数量进一步增多(图2C)。
3 脑缺血再灌注损伤后MRTF-A诱导自噬和凋亡相关蛋白表达的变化

Figure 2.Observation of nuclear membrane and organelles of the nerve cells under transmission electron microscope.The red arrows indicate the autophagic lysosomes(A,B and C,×1 700),the yellow arrows indicatethenuclear membrane(A1,B1andC1,×5 000),and the black arrows indicate the mitochondria(A2,B2 and C2,×5 000).图2 TEM观察神经细胞核及周围细胞器的形态结构
Western blot结果显示,与假手术组相比,模型组LC3-II/LC3-I比值及beclin-1和MRTF-A蛋白表达量的差异无统计学显著性(P>0.05),Bcl-2/Bax比值显著下降(P<0.01);与模型组相比,实验组LC3-II/LC3-I和Bcl-2/Bax比值及beclin-1和MRTF-A蛋白表达量均显著升高(P<0.05或P<0.01),见图3。
4 脑缺血再灌注损伤对缺血半暗带神经细胞凋亡及LC3蛋白表达的影响
TUNEL联合免疫荧光法结果显示,假手术组皮层神经细胞核呈圆形饱满,极少有TUNEL阳性细胞,凋亡率为(3.31±2.72)%,LC3蛋白在神经细胞胞浆中表达,分布均匀呈弥散状;模型组缺血侧皮层神经细胞核体积明显缩小,染色加深,胞浆及胞核固缩,细胞核形态多样,含有大量TUNEL阳性细胞,其神经细胞凋亡率为(57.02±11.04)%,与假手术组相比显著升高(P<0.01),LC3蛋白在神经细胞中呈现聚集状;实验组皮层神经细胞核皱缩较少,细胞核形态多样化,含有少量TUNEL阳性细胞,凋亡率[(42.10±5.20)%]与模型组相比显著降低(P<0.05),LC3蛋白荧光强度与模型组相比显著升高(P<0.05),在神经细胞胞浆中聚集更明显,呈斑片状,见图4。
讨 论
MRTF-A在脑、心肌等组织中广泛表达,作为共激活因子与SRF结合形成复合物,作用于靶基因(如即早基因等)的启动子区域CArG box并激活其转录表达,从而调节细胞的生理功能[8]。有研究表明,MRTF-A通过调控ERK/PI3K等信号通路参与细胞增殖、分化及凋亡过程[9-10]。在不同组织器官病理条件下,MRTF-A的作用存在差异。有研究通过敲除MRTF-A或抑制MRTF-A活性,降低巨噬细胞中活性氧簇(reactive oxygen species,ROS)的产生,显著减轻缺血再灌注诱导的小鼠急性肾损伤[11]。而我们既往的研究发现,MRTF-A在CIS/R介导的神经损伤早期,具有明显的抑制神经细胞凋亡的作用[6],但其具体作用分子机制还有待进一步阐明。
CIS/R损伤是CIS临床溶栓治疗后神经功能恢复的主要障碍,其作用机制与自由基损伤、炎症反应和脑血管损伤等多种因素有关,可导致脑内屏障系统结构破坏、微血栓形成并最终导致神经细胞死亡[12-14]。本项目研究也发现,在构建大鼠MCAO模型再灌注24 h后,缺血中心区域脑组织出现大面积坏死,坏死组织周围(缺血半暗带)神经细胞大量凋亡,核周线粒体肿胀变形、嵴模糊不清、空泡化明显,部分核膜变为单层,高尔基体、内质网囊泡肿胀碎裂。因此,逆转缺血半暗带损伤、减少神经细胞凋亡为CIS/R治疗的关键。为了验证MRTF-A可有效抑制CIS/R介导的神经细胞凋亡,本研究在大鼠脑室过表达MRTF-A后构建MCAO再灌注模型,发现缺血侧梗死体积显著减小,缺血半暗带神经细胞凋亡率明显下降,双层核膜和线粒体嵴清晰可见,内质网和高尔基体囊泡完整无碎裂,损伤较轻,说明MRTF-A在CIS/R过程中能有效减少神经细胞损伤和凋亡。据报道,通过维持线粒体的通透性、降低内质网应激作用可明显减轻CIS/R过程脑组织损伤[15-16]。MRTF-A对CIS/R过程中对神经细胞的保护作用可能也与维持神经细胞内线粒体、内质网等细胞器正常的结构和功能有关。
为了进一步研究MRTF-A的抗神经损伤的相关分子机制,我们检测了凋亡相关基因Bcl-2和Bax表达水平。Bcl-2与Bax共属于一个家族,通过控制线粒体膜的通透性来调节凋亡激活物,Bcl-2水平的升高和Bax的降低表明细胞对凋亡的抵抗性增强[17]。我们前期的研究证明,在培养的原代神经细胞中,MRTF-A可通过结合至bcl-2基因启动子CArG box区域,上调Bcl-2的转录活性[18]。在本研究中,CIS/R过程导致神经细胞抵抗凋亡能力显著降低,Bcl-2/Bax比值显著下降;而高表达MRTF-A的大鼠在CIS/R发生24 h后,Bcl-2/Bax比值显著升高了,提示MRTF-A通过激活Bcl-2并抑制Bax通路显著增强缺血条件下机体对CIS/R介导的凋亡抗性。这也进一步在整体动物水平证明了MRTF-A对抗凋亡基因bcl-2表达的调控作用。

Figure 3.The protein expression of MRTF-A,autophagy-related molecules and apoptosis-related molecules.A:the expression levels of MRTF-A,beclin-1,LC3-I and LC3-II;B:the expression levels of Bcl-2 and Bax.Mean±SD.n=5.**P<0.01 vs sham group;#P<0.05,##P<0.01 vs MCAO/R group.图3 MRTF-A、自噬相关蛋白及凋亡相关蛋白的表达情况
自噬是一种高度保守的细胞行为,通过溶酶体降解途径进行自我吞噬,一般经历形成吞噬泡、自噬小体和自噬溶酶体3个过程[19]。目前主要认为,自噬是一种细胞自我保护机制,可以有效抵御外界恶劣环境刺激,延缓细胞凋亡,但多度或过快的自噬也会导致自噬性细胞死亡[20]。本研究发现,在生理情况下神经细胞自噬水平较低,MCAO再灌注模型组中,缺血半暗带区神经细胞自噬溶酶体数量增加,而高表达MRTF-A后的MCAO再灌注后,实验组神经细胞自噬溶酶体进一步增多,提示MRTF-A增强了CIS/R过程中神经细胞的自噬水平。一项老年大鼠MCAO模型实验表明,通过慢病毒过表达NMNAT1,激活PI3K/Akt信号通路,可增强神经细胞自噬水平,缺血侧脑梗死体积明显减小[21]。这与我们的研究结果相似,说明增强自噬水平,的确可以减轻CIS/R介导的脑损伤。
自噬发生能促进LC3蛋白脂质化:非激活型胞质LC3(LC3-I)经过水解和脂质化后转变为激活的自噬小体膜结合的LC3-II[22]。本研究发现,MRTF-A高表达MCAO再灌注模型LC3-II/LC3-I的比值显著升高,说明此时神经细胞中大量LC3-I向LC3-II转变,自噬小体形成增加。形态学观察发现,正常情况下神经细胞LC3在胞浆中均匀分布表达,而造模后LC3发生聚集性改变,且MRTF-A高表达MCAO再灌注模型的LC3蛋白聚集性进一步增加,呈斑片状改变,这也说明了MRTF-A的确在增强凋亡抵抗力的同时调控了自噬相关基因LC3的表达,从而促进了神经细胞自噬水平。

Figure 4.The effects of high expression of MRTF-A on the nerve cell apoptosis,and LC3 expression and distribution.A:images of TUNEL and immunofluorescence(×400;A1,A2,A3:×1 600);B:apoptotic rates of the nerve cells;C:fluorescence intensity of LC3 protein.Mean±SD.n=5.**P<0.01 vs sham group;#P<0.05 vs MCAO/R group.图4 高表达MRTF-A对神经细胞凋亡及LC3表达分布的影响
已有研究表明,上调beclin-1在哺乳动物细胞中的表达,能够刺激自噬发生[23]。我们研究发现,MCAO再灌注模型beclin-1表达水平略有升高,高表达MRTF-A后发生CIS/R过程中,beclin-1表达水平显著升高。这一结果进一步证明了MRTF-A可以通过上调自噬相关基因、激活自噬通路来增强自噬作用。有研究报道,Bcl-2作为抗凋亡蛋白,能与beclin-1的BH3结构域结合,两者相互作用并调节自噬水平[24-26]。在我们的研究中,当大鼠大脑过表达MRTFA后,缺血区Bcl-2上调的同时beclin-1表达水平持续升高。其原因一方面可能由于MRTF-A调控了其他beclin-1依赖的自噬通路发挥了作用;另一方面可能是由于在神经细胞凋亡程度较重前提下,自噬被MRTF-A激活并有效的抑制了神经凋亡,但其详细调控机制还有待进一步验证探讨。
综上所述,CIS/R诱导了大鼠皮层神经细胞的凋亡和轻微自噬反应,MRTF-A通过上调LC3-II和beclin-1表达,增强自噬作用,并通过激活Bcl-2、抑制Bax来增强机体的抗凋亡能力。但自噬的发生十分复杂,MRTF-A在诱导自噬过程中处于何种地位仍需进一步阐明。
