普鲁卡因调控CXCR7并影响AKT和STAT3信号通路从而抑制膀胱癌细胞活力、迁移和侵袭*
2020-05-26曾凯辉吕慧莹罗金泰赵子良
曾凯辉,吕慧莹,罗金泰,赵子良△
(1广州医科大学附属第一医院麻醉科,2广州市越秀区光塔街社区卫生服务中心,3广州医科大学附属第一医院泌尿外科,广东广州510120)
膀胱癌是泌尿生殖系统中常见的一种恶性肿瘤,其发病率逐年增长,且复发率高[1],因此寻找一种能够治疗膀胱癌的药物具有重要意义。普鲁卡因(procaine,PCA)是一种局麻药物,但在许多疾病的临床治疗中有广泛的应用,如呼吸科、妇产科、皮肤科和神经科疾病以及恶性肿瘤等[2]。CXC趋化因子受体7(CXC chemokine receptor 7,CXCR7)是一种趋化因子受体,属于G蛋白偶联受体超家族,与膀胱癌的临床分期和预后相关[3],并参与多种肿瘤的发生发展[4]。蛋白激酶B(protein kinase B,PKB/AKT)是PI3K/AKT信号通路中的关键蛋白,调控其下游增殖、侵袭和转移的相关信号,AKT磷酸化后才被激活[1-5]。有研究发现,AKT信号通路可能是CXCR7发挥作用的关键通路[6],CXCR7能够激活AKT信号通路,抑制肿瘤细胞的凋亡[7]。信号转导和转录激活因子 3(signal transducer and activator of transcription 3,STAT3)磷酸化后可调控下游靶基因,在细胞信号转导中起关键作用[8-9]。本实验研究了PCA及CXCR7对膀胱癌细胞生长、迁移和侵袭的影响,并分析了PCA和CXCR7之间的关系以及它们对AKT/STAT3信号通路的影响,为膀胱癌的预防和治疗提供新靶点并为药物治疗提供实验依据。
材料和方法
1 材料与试剂
人膀胱癌RT4细胞购自中国科学院上海细胞库。胎牛血清(fetal bovine serum,FBS)和RPMI-1640培养基购自Gibco;RNA提取试剂盒和反转录试剂盒购自TaKaRa;Taq DNA Polymerase和AceQ qPCR SYBR®Green Master Mix购自南京诺唯赞生物公司;细胞计数试剂盒8(Cell Counting Kit-8,CCK-8)、蛋白提取试剂盒和BCA蛋白定量试剂盒均购自上海碧云天生物技术有限公司;PCA购自武汉鑫佳灵生物科技有限公司。
2 方法
2.1 细胞培养 RT4细胞常规培养于含10%FBS的RPMI-1640培养基,置于37℃、5%CO2恒温箱培养,每2~3 d传代1次。
2.2 PCA处理膀胱癌细胞 取对数生长期的RT4细胞消化后接种于96孔板(每孔1×104个),DMEM培养液培养24 h后,吸去原培养液,换成含不同浓度(0、0.25、1、4和16 mmol/L)PCA的培养液,继续培养24、48和72 h,根据不同实验需求收集细胞。
2.3 细胞分组和转染 PCA实验分为PBS组和PCA组,以未经PCA处理的RT4细胞作为PBS组,以4 mmol/L PCA处理的RT4细胞作为PCA组;CXCR7敲减实验分为siRNA阴性对照(siRNA negative control,si-Con)组和CXCR7siRNA(si-CXCR7)组,将si-Con和si-CXCR7分别转染到RT4细胞中;CXCR7过表达实验分为PBS组、PCA组、PCA+pcDNA组和PCA+pcDNA-CXCR7组,前2组与PCA实验中相同处理,后2组的处理为将pcDNA和pcDNA-CXCR7分别转染至4 mmol/L PCA处理的RT4细胞中。转染均按照LipofectamineTM2000试剂盒进行操作。
2.4 RT-qPCR分析CXCR7的mRNA表达水平 按照TRIzol说明书提取总RNA,用反转录试剂盒逆转录成cDNA,按照AceQ qPCR SYBR®Green Master Mix说明书进行RT-qPCR扩增。循环条件为95℃30 s、60℃ 30 s、72℃ 30 s,共40个循环;60℃延长5 min。目的基因的相对表达量采用2-ΔΔCt法计算。CXCR7的上游引物序列为5′-TGGGTGGTCAGTCTCGT-3′,下游引物序列为5′-CCGGCAGTAGGTCTACT-3′;内参照β-actin的上游引物序列为5′-CTCCATCCTGGCCTCGCTGT-3′,下游引物序列为5′-GCTGTCACCTTCACCGTTCC-3′。
2.5 CCK-8法测定RT4细胞活力的变化 分别取不同浓度PCA处理的对数生长期细胞消化后,接种于96孔板(每孔5×103个)培养,分别于24、48和72 h培养时点,每孔加入10 μL CCK-8试剂继续孵育2 h。取si-Con组、si-CXCR7组、PCA+pcDNA组和PCA+pcDNA-CXCR7组的对数生长期细胞消化后,接种于96孔板(每孔5×103个)培养48 h后,每孔加入10 μL CCK-8试剂继续孵育2 h。酶标仪测定各孔波长450 nm处的吸光度(A),另设单孔只加培养基作为空白对照。细胞活力(%)=A实验组/A空白对照组×100%。以上实验重复3次。
2.6 Transwell实验检测细胞的迁移和侵袭能力收集各组稳定表达的膀胱癌RT4细胞,采用无血清培养基制备细胞悬液,接种于Transwell小室上层(每孔3×103个细胞)。Transwell小室风干后,加入500 μL 0.1%结晶紫染色,显微镜下拍照并计数发生迁移的细胞数量。细胞侵袭实验参考贺晶等[10]的方法,在Transwell小室上层加入50 μL 2.0 g/L基质胶Matrigel,凝固后接种RT4细胞,之后操作同细胞迁移。
2.7 Western blot法检测蛋白水平 收集稳定表达的各组RT4细胞,提取细胞中总蛋白,BCA试剂盒测定蛋白总量。各组蛋白上样量为60 μg,经SDSPAGE分离后,经电转将蛋白转移至PVDF膜上。用5%脱脂牛奶室温封闭90 min,加入I抗,4℃孵育过夜,PBS洗涤3次,每次5 min;再加入相对应的II抗,室温孵育2 h,TBST洗涤3次,每次10 min,然后在暗室中显影,定影。用Tanon 600系统进行拍照分析,测定各组蛋白条带的吸光度,以目的条带和β-actin条带的比值作为蛋白表达水平。
3 统计学处理
采用SPSS 20.0进行统计学分析。计量资料以均数±标准差(mean±SD)表示,两组间比较行t检验,多组间比较采用单因素方差分析,以P<0.05表示差异有统计学意义。
结 果
1 不同浓度的PCA对RT4细胞活力的影响
CCK-8法检测结果显示,与对照组相比,不同浓度PCA处理后RT4细胞的活力显著降低(P<0.05),见图1。这一结果表明,PCA可抑制RT4细胞的活力。

Figure 1.The viability of the RT4 cells treated with procaine at different concentrations.Mean±SD.n=3.*P<0.05 vs 0 mmol/L group.图1 不同浓度普鲁卡因对RT4细胞活力的影响
2 PCA对RT4细胞迁移和侵袭能力的影响
Transwell实验的检测结果显示,相较于PBS组,PCA组迁移和侵袭的RT4细胞数量显著减少(P<0.05),见图2。这表明PCA可抑制RT4细胞的迁移和侵袭能力。
3 PCA对RT4细胞CXCR7表达的影响
RT-qPCR检测结果显示,相较于PBS组,PCA组膀胱癌RT4细胞中CXCR7的mRNA表达水平显著降低(P<0.05),见图3A。Western blot检测结果显示,相较于PBS组,PCA组RT4细胞中CXCR7蛋白的表达水平显著降低(P<0.05),见图3B。可见PCA抑制膀胱癌RT4细胞CXCR7的表达。
4 敲减CXCR7表达对RT4细胞的活力、迁移和侵袭的影响
RT-qPCR检测结果显示,相较于si-Con组,si-CXCR7组RT4细胞中CXCR7的mRNA表达水平显著降低(P<0.05),见图4A;Western blot检测结果显示,相较于si-Con组,si-CXCR7组RT4细胞中CXCR7蛋白的表达水平显著降低(P<0.05),见图4B;CCK-8法检测结果显示,相较于si-Con组,si-CXCR7组RT4细胞的活力显著降低(P<0.05),见图4C;Transwell法检测结果显示,相较于si-Con组,si-CXCR7组迁移和侵袭的RT4细胞数量显著减少(P<0.05),见图4D、E。这表明抑制CXCR7表达可抑制RT4细胞的活力、迁移和侵袭。
5 过表达CXCR7逆转PCA对RT4细胞活力、迁移和侵袭的抑制作用
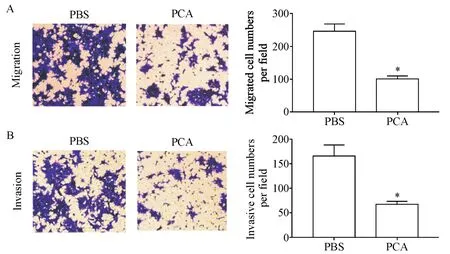
Figure 2.Procaine(PCA)inhibited the migration(A)and invasion(B)abilities of the RT4 cells.The migration and invasion of the RT4 cells were detected by Transwell assays(×200).Mean±SD.n=3.*P<0.05 vs PBS group.图2 普鲁卡因抑制RT4细胞的迁移和侵袭

Figure 3.Procaine(PCA)inhibited CXCR7 expression in the RT4 cells.A:the mRNA expression of CXCR7 in the RT4 cells was detected by RT-qPCR;B:the protein expression of CXCR7 in the RT4 cells was detected by Western blot.Mean±SD.n=3.*P<0.05 vs PBS group.图3 普鲁卡因抑制RT4细胞中CXCR7的表达
RT-qPCR检测结果显示,相较于PBS组,PCA组RT4细胞中CXCR7的mRNA表达水平显著降低;相较于PCA+pcDNA组,PCA+pcDNA-CXCR7组RT4细胞中CXCR7的mRNA表达水平显著升高(P<0.05),见图5A。Western blot检测结果显示,相较于PBS组,PCA组RT4细胞中CXCR7的蛋白表达水平显著降低;相较于PCA+pcDNA组,PCA+pcDNA-CXCR7组RT4细胞中CXCR7的蛋白表达水平显著升高(P<0.05),见图5B。CCK-8实验结果显示,相较于PBS组,PCA组RT4细胞的活力显著降低;相较于PCA+pcDNA组,PCA+pcDNA-CXCR7组RT4细胞的活力显著升高(P<0.05),见图5C。Transwell实验结果显示,相较于PBS组,PCA组迁移和侵袭的RT4细胞数量显著减少(P<0.05);相较于PCA+pcDNA组,PCA+pcDNA-CXCR7组迁移和侵袭的RT4细胞数量显著增多(P<0.05),见图5D、E。上述结果表明,过表达CXCR7可逆转PCA对RT4细胞活力、迁移和侵袭的抑制作用。
6 过表达CXCR7和PCA对RT4细胞AKT/STAT3信号通路的影响
Western blot的检测结果显示,相较于PBS组,PCA组p-AKT和p-STAT3的蛋白水平显著降低;相较于PCA+pcDNA组,PCA+pcDNA-CXCR7组p-AKT和p-STAT3的蛋白水平显著升高(P<0.05);而AKT和STAT3蛋白水平在各组之间的差异无统计学显著性,见图6。上述结果表明,PCA抑制RT4细胞中AKT和STAT3的磷酸化,而过表达CXCR7可逆转PCA对AKT和STAT3磷酸化的抑制作用。
讨 论
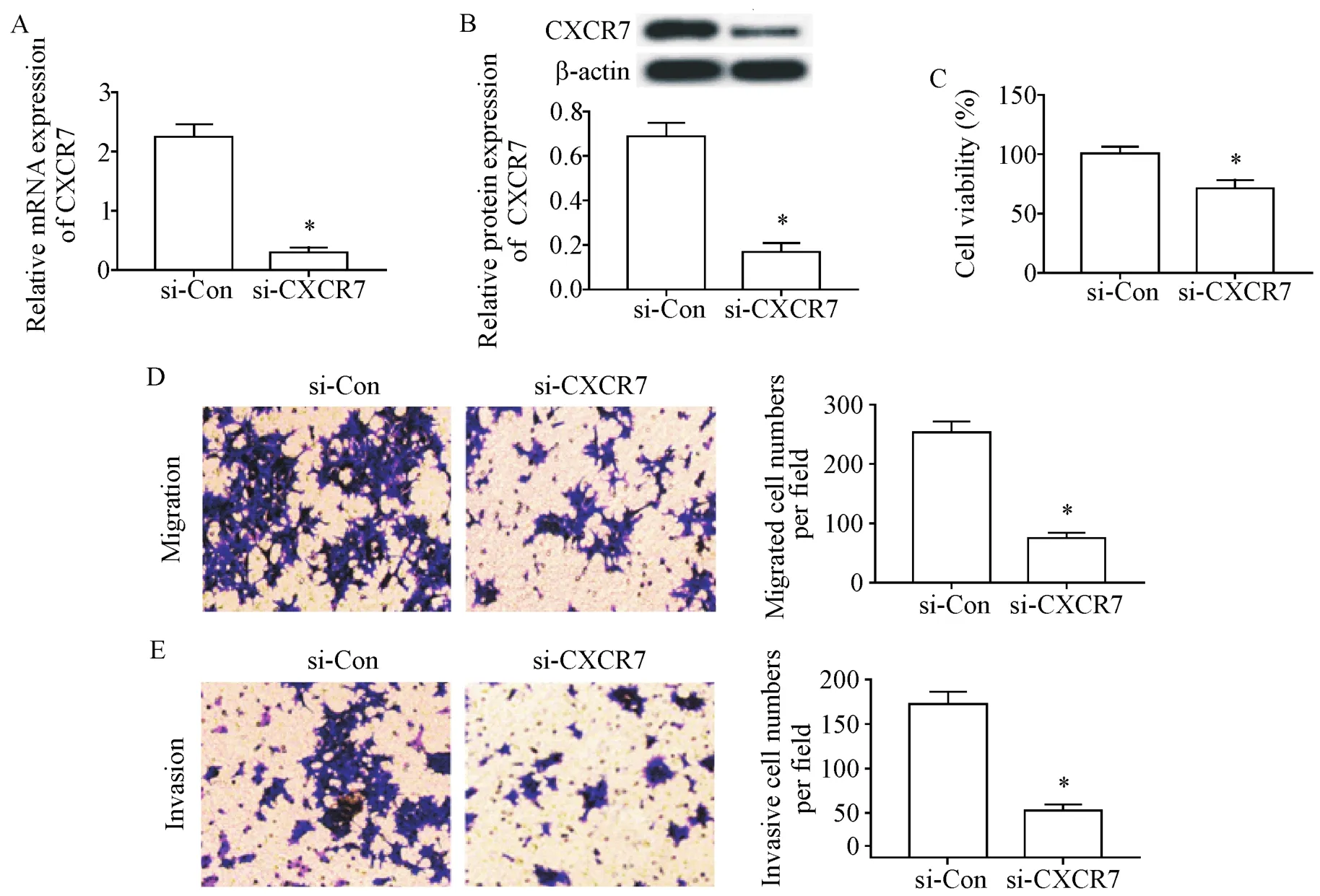
Figure 4.Knock-down of CXCR7 expression inhibited the viability,migration and invasion of the RT4 cells.A:the mRNA expression of CXCR7 in the RT4 cells was detected by RT-qPCR;B:the protein expression of CXCR7 in the RT4 cells was detected by Western blot;C:the viability of the RT4 cells was detected by CCK-8 assay;D,E:the migration and invasion abilities of the RT4 cells were detected by Transwell assays(×200).Mean±SD.n=3.*P<0.05 vs si-Con group.图4 敲减CXCR7的表达抑制RT4细胞的活力、迁移和侵袭
膀胱癌的发生发展过程复杂,研究膀胱癌的分子遗传学基础可给临床诊断、治疗和预后预测提供理论依据[11]。PCA是一个有前景的抗肿瘤药物,还可以拮抗化疗相关的肾脏和肝脏毒性[12-13]。研究表明高温联合PCA可在体外净化白血病骨髓[14]。研究发现 PCA 对人鼻咽癌 CNE-2Z细胞[15]和HepG2细胞[16]具有抑制增殖的作用。CXCR7参与肿瘤的发生发展,张娜等[4]研究发现CXCR7通过抗凋亡因子survivin参与胃癌的生长,并可能参与胃癌的淋巴结转移。研究发现CXCR7在宫颈癌细胞中高表达,抑制CXCR7表达可抑制宫颈癌细胞的增殖和侵袭能力[17],在神经母细胞瘤中具有抗肿瘤功能[18]。抑制CXCR7表达,前列腺癌细胞增殖减少[19],并可减少肾癌细胞的迁移及侵袭[20]。林灵[21]的研究发现靶向干扰CXCR7表达可通过抑制Akt的磷酸化、下调bcl-2表达、上调多聚腺苷酸二磷酸核糖聚合酶1[poly(ADP-ribose)polymerase-1,PARP-1]表达从而介导细胞凋亡的发生。
AKT在细胞存活、代谢、迁移和侵袭等信号通路中起着重要的调控作用,其在多种肿瘤中异常活化[22-23]。AKT能磷酸化一系列蛋白成分,通过多种途径抑制细胞凋亡[24]。理论上靶向AKT基因抑制AKT的活性能够抑制肿瘤细胞的生长,因此抑制AKT的激活对肿瘤治疗有重要意义[25]。STAT3信号转导通路在膀胱癌的增殖、凋亡、侵袭和转移调控中发挥重要作用,异常高表达的磷酸化STAT3可能通过增加血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达来促进肿瘤血管的生成,导致膀胱肿瘤恶性进展,靶向阻断STAT3信号通路为膀胱癌的治疗提供新的思路[26]。黄陈等[27]研究发现阻断STAT3信号转导通路可抑制人胰腺癌细胞增殖,促进其凋亡。CXCL-8可通过ATK和STAT3信号通路提高骨髓间充质干细胞自噬和增殖能力[28]。来伟等[29]研究发现 PRL-3能通过白细胞介素 6(interleukin-6,IL-6)上调p-AKT和p-STAT3促进结肠癌细胞增殖和迁移。赵勇[30]研究发现Hes1可通过激活PI3K/AKT和JAK/STAT3信号通路,减轻缺氧后心肌细胞凋亡,从而减轻心肌细胞缺血在灌注损伤。
本研究发现,PCA处理及敲减CXCR7的表达可使膀胱癌RT4细胞的活力、迁移和侵袭能力显著降低,说明PCA和CXCR7可能影响膀胱癌的发展过程。在PCA处理后的RT4细胞中转入CXCR7过表达表质粒可逆转PCA对膀胱癌细胞的活力、迁移和侵袭能力的抑制作用。PCA处理后RT4细胞的p-AKT和p-STAT3蛋白水平显著降低;过表达CXCR7可致膀胱癌RT4细胞细胞的p-AKT和p-STAT3蛋白水平显著升高,说明PCA可抑制膀胱癌细胞生长、迁移和侵袭,而过表达CXCR7可逆转PCA对膀胱癌细胞生长、迁移和侵袭的抑制作用,其机制可能与AKT和STAT3信号通路有关。本实验的研究成果可为膀胱癌的预防和治疗提供新的思路和实验依据。

Figure 6.The effects of CXCR7 over-expression and procaine(PCA)on the protein levels of AKT/STAT3 signaling pathway-related molecules in the RT4 cells.Mean±SD.n=3.*P<0.05 vs PBS group;#P<0.05 vs PCA+pcDNA group.图6 过表达CXCR7和普鲁卡因对RT4细胞AKT/STAT3信号通路相关分子蛋白水平的影响
