血清可溶性PD-1水平与2型糖尿病患者并发颈动脉粥样硬化斑块的关系
2020-05-25林媛媛邹欣妤黄雪梅韦海涛
林媛媛 邹欣妤 黄雪梅 韦海涛


[摘要] 目的 探討血清可溶性PD-1(sPD-1)水平与2型糖尿病(T2DM)患者颈动脉粥样硬化斑块的关系。 方法 选择2016年10月~2019年3月广西壮族自治区南宁市第一人民医院收治的T2DM患者100例,按照是否存在颈动脉粥样硬化斑块,将其分为斑块组(54例)和无斑块组(46例)。比较两组患者一般资料、生化指标以及血清sPD-1水平和颈动脉Crouse积分,多因素分析采用logistic回归分析。 结果 斑块组收缩压水平和吸烟、饮酒人数占比高于无斑块组(P < 0.05)。斑块组C反应蛋白、三酰甘油水平高于无斑块组(P < 0.05)。斑块组血清sPD-1水平和颈动脉Crouse积分高于无斑块组(P < 0.05),且血清sPD-1水平和颈动脉Crouse积分呈正相关(r = 0.384,P = 0.023)。多因素logistic回归分析显示吸烟、饮酒、C反应蛋白、sPD-1均是T2DM患者颈动脉粥样硬化斑块形成的独立危险因素(P < 0.05)。ROC曲线显示sPD-1临界值为1.41 ng/mL,曲线下面积为0.824,敏感度为81.24%,特异性为78.79%(95%CI:0.669~0.979,P = 0.027)。 结论 血清sPD-1水平升高均可能增加T2DM患者颈动脉粥样硬化斑块形成的风险,监测血清sPD-1水平可以用于诊断颈动脉粥样硬化斑块。
[关键词] 2型糖尿病;颈动脉粥样硬化斑块;可溶性PD-1;颈动脉Crouse积分
[中图分类号] R587.1 [文献标识码] A [文章编号] 1673-7210(2020)04(b)-0053-04
Relationship between serum soluble PD-1 level and carotid atherosclerotic plaque in type 2 diabetes mellitus patients
LIN Yuanyuan ZOU Xinyu HUANG Xuemei WEI Haitao
Department of Endocrinology, the First People′s Hospital of Nanning, Guangxi Zhuang Autonomous Region, Nanning, 530021, China
[Abstract] Objective To investigate the relationship between serum soluble PD-1 (sPD-1) level and carotid atherosclerotic plaque in type 2 diabetes mellitus (T2DM) patients. Methods From October 2016 to March 2019,100 cases with T2DM patients who admitted to the First People′s Hospital of Nanning of Guangxi Zhuang Autonomous Region were selected. According to the presence or absence of carotid atherosclerotic plaque, they were divided into plaque group (54 cases) and non-plaque group (46 cases). General information, biochemical index and the serum sPD-1 level and carotid Crouse integral of two groups were compared. Logistic regression analysis was used for multivariate analysis. Results The systolic blood pressure level and the proportion of smoking and drinking in plaque group were higher than those in non-plaque group (P < 0.05). The C-reactive protein, triacylglycerol levels in plaque group were higher than those in non-plaque group (P < 0.05). Serum sPD-1 levels and carotid Crouse integral in plaque group were higher than those in non-plaque group (P < 0.05), and serum sPD-1 level was positively correlated with carotid Crouse integral (r = 0.384, P = 0.023). Logistic regression analysis showed that smoking, drinking, C-reactive protein and sPD-1 level were independent risk factors for carotid atherosclerotic plaque formation in T2DM patients (P < 0.05). ROC curve analysis showed that the critical value of sPD-1 was 1.41 ng/mL, the area under the curve was 0.824, the sensitivity was 81.24%, the specificity was 78.79% (95%CI:0.669-0.979,P = 0.027). Conclusion Serum sPD-1 level may all increase the risk of carotid atherosclerotic plaque formation in T2DM patients. Monitoring serum sPD-1 level can be used to diagnose carotid atherosclerotic plaque.
[Key words] Type 2 diabetes mellitus; Carotid atherosclerotic plaque; Soluble PD-1; Carotid Crouse integral
糖尿病是临床最为常见的一种基础疾病,是指因遗传以及环境因素共同作用引发的主要表现特征为糖代谢紊乱的一组临床综合征[1]。糖尿病的发病率正呈逐年升高趋势,其中2型糖尿病(T2DM)在所有糖尿病患者中占比可达80%~90%[2]。导致T2DM患者重要并发症以及死亡的主要原因是动脉粥样硬化,尤其是大血管动脉粥样硬化改变可累及循环的各个动脉,包括主动脉、脑动脉、肾动脉、冠状动脉等,临床上动脉粥样硬化缺乏典型的症状或体征[3]。关于T2DM血管并发症的具体发病机制尚未明确,但有学者发现在动脉粥样硬化的发生、发展过程中炎性反应可能发挥着至关重要的作用,活化的T淋巴细胞贯穿动脉粥样硬化发展的所有阶段[4]。PD-1是近年来发现的一种新型共刺激分子,其与配体PD-L结合后可能抑制T细胞的效应,在T细胞的激活以及免疫应答过程中,可溶性PD-1(sPD-1)可能通过阻断PD-1/PD-L1负性信号通路的方式参与其中,并进一步介导动脉粥样硬化的发生及发展过程[5]。本文研究T2DM患者血清sPD-1水平与颈动脉粥样硬化斑块的关系,现报道如下:
1 资料与方法
1.1 一般资料
选择2016年10月~2019年3月广西壮族自治区南宁市第一人民医院(以下简称“我院”)收治的T2DM患者100例。其中男68例,女32例;年龄(59.44±10.85)岁;体重指数(BMI)(25.47±3.39)kg/m2;病程(11.23±1.38)年;吸烟31例;饮酒36例。按照颈动脉血管内-中膜厚度(IMT)进行分组,将其分为斑块组54例,无斑块组46例。所有患者均已知情同意,且本研究经我院医学伦理委员会批准。
纳入标准:①符合中国糖尿病防治指南[6]制订的T2DM相关诊断标准;②空腹血糖水平为4.4~6.1 mmol/L,餐后2 h血糖水平为4.4~8.8 mmol/L;③可正常交流者。排除标准:①继发性糖尿病以及1型糖尿病者;②伴有糖尿病急性并发症者;③存在心、肝、肺等重要脏器病变者;④合并血液系统疾病、风湿免疫性疾病及恶性肿瘤疾病者;⑤妊娠期或哺乳期者;⑥存在精神疾病者;⑦正在参与其他研究者。
1.2 方法
1.2.1 颈动脉超声检查 采用Vivid7彩色多普勒超声仪(美国GE公司),以频率7.5~12.0 MHz的探头进行检查。所有患者均仰卧,颈部置于低枕上,头部微向后仰,使颈部充分暴露。在进行一侧颈部血管如颈总动脉、颈外动脉以及颈内动脉的检查时,告知患者头偏向对侧。对颈动脉IMT进行测量,并将IMT≥1.0 mm记为颈动脉粥样硬化斑块[7]。
1.2.2 一般资料调查 采用我院自制的调查问卷对受试者的一般资料(包括年龄、性别、BMI、收缩压、舒张压、吸烟、饮酒等)进行统计、记录。
1.2.3 實验室指标检测 所有患者清晨空腹,采集静脉血10 mL,将其分为两管,其中一管进行生化指标水平检测,另一管则于3000 r/min离心10 min,离心半径为12 cm,采集上层血清置于EP管内,保存于-80℃冰箱中备用,测定血清sPD-1水平。采用日立7180型自动生化分析仪(南京新惠通生物科技有限公司)检测三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、空腹血糖(FBG)、空腹胰岛素(FINS)水平;免疫比浊法检测C反应蛋白(CRP)、纤维蛋白原(FIB)水平;高压液相离子交换层析法检测糖化血红蛋白(HbA1c)水平。酶联免疫吸附法检测血清sPD-1水平,仪器使用贝克曼ACCESS全自动微粒子免疫化学发光分析仪(美国贝克曼库尔特有限公司)。
1.3 观察指标
比较两组一般资料,生化指标水平,血清sPD-1水平和颈动脉Crouse积分。颈动脉中各独立斑块的厚度相加之后的数值记为Crouse积分,分值越高代表患者的颈动脉斑块症状越严重[8]。
1.4 统计学方法
采用SPSS 20.0统计学软件进行数据分析,计量资料用均数±标准差(x±s)表示,两组间比较采用t检验;计数资料用百分率表示,组间比较采用χ2检验;血清sPD-1水平和颈动脉Crouse积分的相关性应用Pearson分析法进行分析;logistic回归分析T2DM患者颈动脉粥样硬化斑块形成的影响因素。以P < 0.05为差异有统计学意义。
2 结果
2.1 两组一般资料比较
两组性别、年龄、BMI、舒张压、糖尿病病程比较,差异无统计学意义(P > 0.05);斑块组收缩压水平以及吸烟、饮酒人数占比高于无斑块组,差异有统计学意义(P < 0.05)。见表1。
2.2 两组生化指标比较
斑块组CRP、TG水平高于无斑块组,差异有统计学意义(P < 0.05)。见表2。
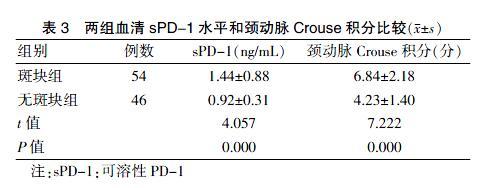
2.3 两组血清sPD-1水平和颈动脉Crouse积分比较
斑块组血清sPD-1水平和颈动脉Crouse积分高于无斑块组,差异有统计学意义(P < 0.05)。见表3。
2.4 Pearson相关分析结果
血清sPD-1水平和颈动脉Crouse积分呈正相关(r = 0.384,P = 0.023)。
2.5 logistic回归分析结果
吸烟、饮酒、CRP、sPD-1水平均为T2DM患者颈动脉粥样硬化斑块形成的独立危险因素(P < 0.05)。见表4。
2.6 ROC曲线结果
sPD-1临界值为1.41 ng/mL,曲线下面积为0.824,敏感度为81.24%,特异性为78.79%(95%CI:0.669~0.979,P = 0.027)。见图1。
3 讨论
T2DM是我国最为常见的内分泌系统疾病之一,主要特点在于胰岛素抵抗以及高胰岛素血症,患者长期处于高血糖状态下易增加全身血管相关并发症的发生风险[9-10]。而颈动脉粥样硬化斑块是血栓形成、发生的基础,继而促进心血管并发症的发生,严重威胁患者的生命健康安全[11-13]。颈动脉粥样硬化斑块每增加0.1 mm,脑卒中的风险增加1.8倍[14-15]。研究发现[16-17],动脉粥样硬化的发生、发展过程可能与局部或全身炎性反应有关,活化的T淋巴细胞存在于动脉粥样硬化的各个阶段。其中共刺激分子主要存在于T细胞、B细胞和APC细胞表面,并在T细胞、B细胞的活化及机体免疫应答过程中起着调节作用。
本研究結果显示,斑块组收缩压水平、吸烟、饮酒人数占比高于无斑块组(P < 0.05),提示收缩压水平、吸烟、饮酒均可能参与了颈动脉粥样硬化斑块形成。有报道显示[18],年龄越大,T2DM患者出现颈动脉粥样硬化斑块的风险越高。本研究结果却显示年龄与T2DM患者颈动脉粥样硬化斑块无明显相关性。原因可能和样本量较少有关。斑块组CRP水平高于无斑块组,这与既往研究高度一致[19],提示炎性反应可能在颈动脉粥样硬化斑块形成的过程中起着重要作用。CRP属于临床上应用较为广泛的炎性反应敏感指标,其表达水平可有效反映机体炎症状态,炎性反应可通过释放多种炎症介质,对机体的免疫功能进行抑制,进而减少淋巴细胞数量,最终促进动脉粥样硬化的进展[20]。
本研究结果显示,斑块组血清sPD-1水平和颈动脉Crouse积分高于无斑块组,且血清sPD-1水平和颈动脉Crouse积分呈正相关(r = 0.384,P = 0.023)。提示sPD-1可能在T2DM患者颈动脉粥样硬化斑块形成的过程中起着至关重要的作用。sPD-1可通过阻断PD-1/PD-L1负性信号通路,减弱PD-1通路的负性调控效用,促使颈动脉斑块形成时负性共刺激信号和正性共刺激信号的失衡,导致T细胞过度激活及促炎因子的增多,最终引起炎症的进展以及斑块不稳定[21-22]。logistic回归分析发现吸烟、饮酒、CRP、sPD-1均是T2DM患者颈动脉粥样硬化斑块形成的独立危险因素。提示上述因素均可能与T2DM患者颈动脉粥样硬化斑块形成密切相关。ROC曲线结果也再次证实了对其及时监测可能有助于更好地诊断患者的临床疾病情况。
综上所述,sPD-1水平在发生颈动脉粥样硬化斑块的T2DM患者血清中表达显著升高,其可能参与颈动脉粥样硬化斑块的形成过程,可能通过检测血清sPD-1水平诊断颈动脉粥样硬化斑块。
[参考文献]
[1] 刘国荣,高素玲,张江,等.老年高血压缺血性脑卒中合并2型糖尿病患者颈动脉粥样硬化程度的分析[J].中华老年心脑血管病杂志,2013,15(6):607-610.
[2] 季翔,张霞.超声心动图评价2型糖尿病患者心脏功能的研究进展[J].临床超声医学杂志,2019,21(10):772-775.
[3] 汤广锋,徐雯,李昉,等.2型糖尿病患者颈动脉粥样硬化斑块形成的危险因素分析[J].安徽医学,2014,23(11):1506-1508.
[4] Wang Y,Pang N,Wang X,et al. Percentages of PD-1+CD4+T cells and PD-L1+DCs are increased and sPD-1 level is elevated in patients with immune thrombocytopenia [J]. Hum Vaccin Immunother,2018,14(4):832-838.
[5] Kruger S,Legenstein ML,R?觟sgen V,et al. Serum levels of soluble programmed death protein 1(sPD-1)and soluble programmed death ligand 1(sPD-L1)in advanced pancreatic cancer [J]. Oncoimmunology,2017,6(5):e1310358.
[6] 中华医学会糖尿病学分会.中国糖尿病防治指南(2017年版)[J].中华糖尿病杂志,2018,10(1):4-67.
[7] 韩超,周梦,杨嘉琦,等.绝经激素治疗对绝经早期女性颈动脉内膜中层厚度的影响[J].中西医结合心脑血管病杂志,2019,17(14):2160-2161.
[8] 刘昌盛,司庆盈,王霞,等.2型糖尿病合并急性脑梗死患者血清sCD40L与颈动脉粥样硬化的相关性[J].山东大学学报:医学版,2010,48(3):27-29.
[9] 周立平,于志坚.联合检测糖代谢及胰岛功能各指标在新诊断2型糖尿病患者诊疗中的价值分析[J].中国医药科学,2018,8(11):133-135,139.
[10] 袁雪红,黄晓新,贾颐,等.颈动脉粥样硬化斑块的超声组织特征对2型糖尿病患者心脑血管事件预测的意义[J].国际脑血管病杂志,2018,26(7):533-537.
[11] 黄娜娜,陈述林.2型糖尿病患者不同部位斑块发生情况及影响因素分析[J].中国医药导报,2017,14(24):81-84.
[12] 曲歌乐,钱玉英,周英智,等.2型糖尿病患者血清同型半胱氨酸与凝血指标致动脉粥样硬化的作用[J].山西医科大学学报,2017,48(1):34-39.
[13] 杨平,廖萍,伍文娟,等.血清同型半胱氨酸、C反应蛋白与2型糖尿病伴脑梗死患者颈动脉粥样硬化的关系[J].中国医药导报,2019,16(5):126-129,141.
[14] 谭安雋,李天荣,李红,等.老年2型糖尿病、糖耐量减低患者CRP、TNF-α与颈动脉粥样硬化及胰岛素抵抗的相关性[J].中国老年学杂志,2015,24(14):3878-3880.
[15] 王彩琴,应鸣翘,薛群,等.可诱导共刺激分子与程序性死亡-1在重症肌无力患者外周血表达的研究[J].中华神经科杂志,2018,51(2):105-110.
[16] 李媛媛,李天艺,焦文君,等.老年2型糖尿病患者骨钙素水平与颈动脉粥样硬化的相关性研究[J].中国糖尿病杂志,2015,23(10):885-887.
[17] Bian B,Fanale D,Dusetti N,et al. Prognostic significance of circulating PD-1,PD-L1,pan-BTN3As,BTN3A1 and BTLA in patients with pancreatic adenocarcinoma [J]. Oncoimmunology,2019,8(4):e1561120.
[18] 孙钧,郑继伟,贾凡,等.2型糖尿病患者血清IL-10水平与颈动脉粥样硬化的关系[J].国际检验医学杂志,2018,39(5):538-551.
[19] 刘晓洁,梅涛,麻红艳,等.单纯2型糖尿病患者颈动脉粥样硬化斑块形成及其稳定性影响因素分析[J].吉林大学学报:医学版,2018,44(2):350-355.
[20] 于婷婷,黄娜娜,苏娇,等.2型糖尿病患者颈动脉粥样硬化斑块与骨密度的相关性分析[J].中国动脉硬化杂志,2019,27(1):45-50.
[21] Chen,付苏.PD-L1通过PD-1受体抑制伤害性感受神经元活动并减轻急慢性疼痛[J].中国疼痛医学杂志,2017, 23(7):506.
[22] 陈栖栖,田娟,张晶,等.类风湿关节炎患者血清IL-37和可溶性PD-1分子的表达水平及临床意义[J].中国免疫学杂志,2017,33(3):422-425.
(收稿日期:2019-10-29 本文编辑:刘明玉)
