基于群体感应的海鲈鱼源杀鲑气单胞菌CS12与水产特定腐败菌的共培养
2020-05-23杨亚茹李婷婷励建荣
杨亚茹,李婷婷,励建荣
(1.渤海大学 食品科学与工程学院 生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心 辽宁省食品安全重点实验室 辽宁省高等学校生鲜食品产业技术研究院,辽宁 锦州 121013;2.大连民族大学 生命科学学院,辽宁 大连 116600)
群体感应(quorum sensing,QS)作为一种细菌之间的交流机制,能够通过密度依赖的方式对细胞内及细胞间的信息交流进行调节,通过分泌一些小分子自诱导物(autoinducer,AI)相互感知[1]。微生物共培养(co-culture)因其更符合细菌生长的自然环境被认为是探究细菌间相互作用的重要形式,研究发现与芽孢杆菌共培养,既能促进嗜热链球菌的生长,也会导致嗜水气单胞菌毒力因子相关基因的表达受抑制[2-3]。在共存体系中,细菌间相互作用相对复杂,或互利共生、或相互竞争。
杀鲑气单胞菌(Aeromonassalmonicida)最早发现于1894年,由Emmerich和Weibel从溪鳟中分离所得,革兰氏阴性菌,呈短杆状,可感染虹鳟、大西洋鲑等鲑科鱼类,引发疖疮病,且寄主范围广泛,同时也是导致鲈鱼、大菱鲆及大黄鱼等水产品致病、致腐的潜在因素[4-7]。研究表明,杀鲑气单胞菌自身可分泌C4-HSL、C6-HSL、C10-HSL等不同酰基高丝氨酸内酯(N-acyl homoserine lactone,AHLs)类信号分子,其毒力因子的表达与细胞密度紧密相关,如α-溶血素、酰基转移酶、蛋白酶等均受QS系统的调控[8-9]。但目前针对杀鲑气单胞菌在水产品致腐的潜在危害及群体感应调控方面更深一步的研究跟探讨相对较少,更多集中于亚种分离、药敏测试、转录组学和组织病理学等方面。
本研究中,笔者从腐败海鲈鱼中分离了1株杀鲑气单胞菌,并对其自身生长、产群体感应信号分子的能力以及与水产品常见特定腐败菌的共培养情况进行分析,旨在为进一步了解杀鲑气单胞菌群体感应调控机制及共培养分析提供研究基础。
1 材料与方法
1.1 材料
1.1.1 原料
鲜活海鲈鱼购于辽宁省锦州市林西水产市场,平均质量(1.50±0.1)kg。
1.1.2 菌株及培养条件
目标菌株:杀鲑气单胞菌CS12(A.salmonicida,CS12),腐败海鲈鱼中分离所得;供试菌株为荧光假单胞菌(Pseudomonasfluorescens,PF03)、嗜水气单胞菌(Aeromonashydrophila,AH11)、温和气单胞菌(Aeromonassobria,AS7)、腐败希瓦氏菌(Shewanellaputrefaciens,SP01)、粘质沙雷氏菌(Serratiamarcescens,SM01)、蜂房哈夫尼亚菌(Hafniaalvei,HA14);报告菌株为紫色杆菌CV026(Chromobacteriumviolaceum,CV026)。上述菌株均保藏于笔者所在实验室。菌株按体积比1∶ 100的比例接种于LB肉汤中,28 ℃、160 r/min摇床振荡培养,CV026活化时需添加20 μg/mL卡那霉素。
1.1.3 试剂与仪器
AHLs信号分子标准品(C4-HSL、C6-HSL、C8-HSL、C10-HSL、C12-HSL、C14-HSL)、卡那霉素,Sigma公司;细菌基因组DNA提取试剂盒、聚合酶链式反应(PCR)引物,生工生物工程(上海)股份有限公司;色谱级甲醇、LB肉汤、LB营养琼脂、铁琼脂、生化鉴定管,青岛海博生物技术有限公司;其他试剂均为市售分析纯。
LDZX-50FBS立式压力蒸汽灭菌器,上海申安医疗器械厂;HZQ-X300C型恒温振荡器、LRH系列生化培养箱,上海一恒科技有限公司;PCR仪,德国Eppendorf公司;Quantity One凝胶成像系统、imark酶标仪,美国Bio-Rad公司;Agilent 7890N/5975气质联用(GC-MS)仪,美国Agilent公司;MS105UD型电子分析天平,瑞士梅特勒-托利多仪器有限公司;Purifier Logic生物安全柜,美国Labconco公司;Biofuge Stratos冷冻高速离心机,美国Thermo公司;精密pH计,美国METTLER TOLEDO公司。
1.2 方法
1.2.1 细菌的分离、鉴定
鲜活海鲈鱼碎冰包埋至休克,4 ℃冷藏无菌包装至货架期终点,参照文献[10]的方法分离,挑取单菌落采用平板划线纯化培养,于LB肉汤中活化并保藏。
16S rDNA测序:利用细菌基因组DNA快速抽提试剂盒提取基因组DNA作为16SrDNA序列扩增反应模板,PCR采用50 μL的反应体系(模板DNA 1 μL,Taq mix 25 μL,引物各2 μL,无菌水20 μL),引物为27 F(5′-A ̄G ̄A ̄G ̄T ̄T ̄T ̄G ̄A ̄T ̄C ̄C ̄T ̄G ̄G ̄C ̄T ̄C ̄A ̄G-3′)和1492 R(5′-A ̄C ̄G ̄G ̄C ̄T ̄A ̄C ̄C ̄T ̄T ̄G ̄T ̄T ̄A ̄C ̄G ̄A ̄C ̄T ̄T-3′),将PCR产物进行0.1%琼脂糖凝胶电泳区分条带,后送至生工生物工程(上海)股份有限公司进行测序,结果与NCBI数据库进行比对,采用MEGA 5.0软件生成系统发育树。利用生化鉴定管进一步分析分离所得目标菌株的生理生化特性[11]。
1.2.2 生长动力学曲线的测定
将目标菌株过夜活化后接种于LB肉汤中,28 ℃培养至96 h,分别于0、1、4、8、12 h及以后每12 h分别测定其OD595及pH并记录,每组3个平行,绘制生长曲线。
1.2.3 生物报告菌法检测AHLs活性
报告平行划线法:参照文献[12]的方法,将报告菌株CV026与目标菌株过夜活化后接种培养,在LB营养琼脂平板上平行划线,以报告菌株为阴性对照,C4-HSL为阳性对照,28 ℃培养18~24 h,观察颜色变化。
报告平板扩散法:参照文献[13]的方法,将报告菌株CV026过夜活化后接种培养,加入冷却至40 ℃的LB营养琼脂中,混匀并倾倒至已放置好无菌牛津杯的平板中,待平板凝固后取出牛津杯,加入200 μL/孔的菌液,以报告菌株为阴性对照,C4-HSL为阳性对照,28 ℃培养24~48 h,观察颜色变化。
1.2.4 GC-MS定性检测AHLs种类
AHLs粗提物制备:参照文献[14]的方法,将目标菌株接种培养至稳定生长期,10 000 r/min离心10 min取上清液,与乙酸乙酯溶液(添加0.1%冰乙酸)等体积混合萃取,收集有机相(加入适量无水硫酸钠),35 ℃ 旋蒸至干后用甲醇溶解,过0.22 μm的无菌滤器,-20 ℃保存备用。
将6种AHLs标准品溶于甲醇中,制备质量浓度为200 μg/mL的混合标品,-20 ℃保存,与目标菌株AHLs粗提液用于GC-MS检测[15]。
1.2.5 群体感应抑制活性菌筛选
采用接触共培养法,将目标菌株CS12与供试菌株PF03、AH11、AS7、SP01、SM01、HA14等过夜活化后接种于10 mL/管的LB肉汤中,分别进行单菌及与目标菌株按数量比为1∶ 1混合共培养,28 ℃ 培养至168 h,每隔24 h分别测定每管菌液的OD595并记录,每组3个平行,分别绘制目标菌株与各供试菌株的生长曲线。观察曲线特征进行报告平板扩散法,观察紫色圈直径的大小,对应AHLs的产生情况。
1.3 数据处理
实验结果采用Excel、MEGA5.0、Origin 8.5软件进行数据统计分析与绘图处理。
2 结果与讨论
2.1 16S rDNA测序结果与系统发育树构建
目标菌株CS12的16S rDNA琼脂糖凝胶电泳图如图1所示,其目的片段在1500 bp左右出现特异性亮带,扩增产物送至生工生物工程(上海)股份有限公司测序。将测序所得16S rDNA序列与NCBI数据库BLAST系统中已知序列进行比对,结果显示CS12与杀鲑气单胞菌B52相似度高达99%,初步将其命名为A.salmonicidaCS12。利用MEGA 5.0软件构建系统发育树,CS12与其他气单胞菌属之间的系统发育关系如图2所示。
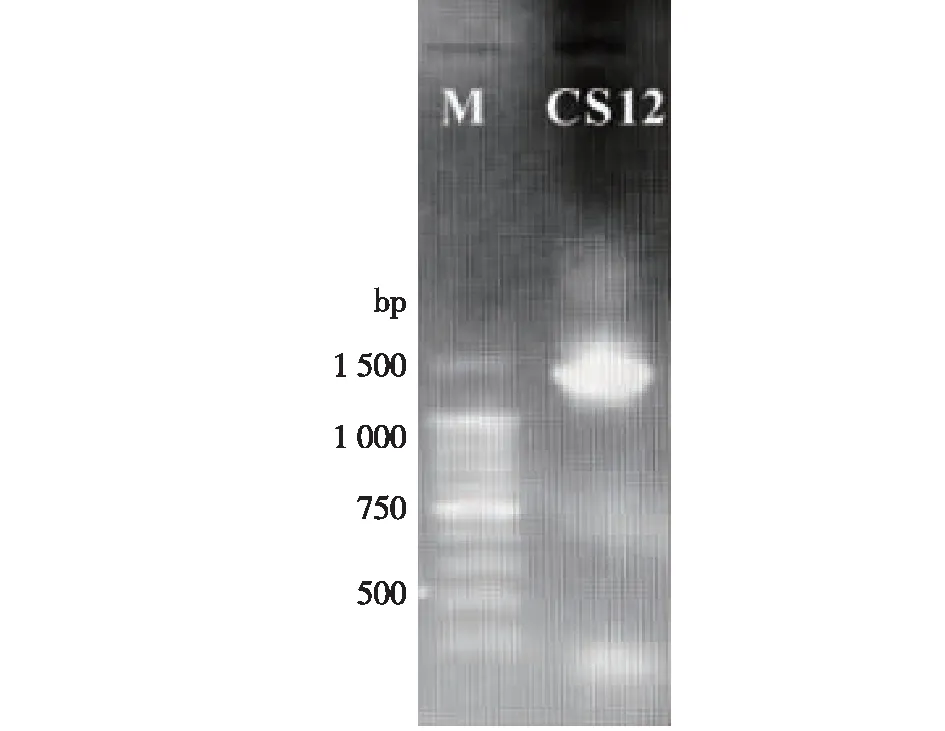
M—Marker;CS12—A.salmonicida CS12图1 菌株CS12的16S rDNA PCR扩增电泳图Fig.1 PCR amplification of16S rDNA of strain CS12

图2 菌株CS12与其他气单胞菌属之间的系统发育关系Fig.2 Phylogenetic relationships of strain CS12 and other Aeromonas sp.
2.2 生长动力学曲线测定及生化鉴定
微生物生长曲线表明细菌在一定的环境条件下群体生长与繁殖的规律。菌株CS12的生长动力学曲线和菌落形态如图3所示。由图3(a)可知,曲线基本呈“S”型,在12 h左右达到对数生长期;pH呈现先下降后上升的趋势,分析可能与杀鲑气单胞菌CS12的生长代谢有关,这一结果与水产品腐败菌致腐能力的分析基本一致[16-17]。图3(b)所示,杀鲑气单胞菌CS12在LB营养琼脂上生长,菌落表面凸起、边缘光滑整齐、呈乳白色;在铁琼脂上生长,菌落为圆形、微白色半透明,部分呈现黑色中心。

图3 菌株CS12的生长曲线和菌落形态Fig.3 Growth curve and colony characteristics of strain CS12
菌株CS12生化鉴定结果见表1。由表1可知:杀鲑气单胞菌CS12在0~37 ℃条件下均可生长,不具运动性,pH≤5.0时不生长,与田会芹等[18]研究发现酸性条件能明显抑制杀鲑气单胞菌的生长结果一致。

表1 菌株CS12的生化鉴定结果Table 1 Physiological and biochemical test results of strain CS12
注:“+”表示阳性;“-”表示阴性;ONPG为2-硝基苯基-β-D-吡喃半乳糖苷;TMAO为氧化三甲胺。
2.4 AHLs活性检测
利用生物报告菌法对杀鲑气单胞菌CS12的AHLs活性进行了初步验证。报告菌株CV026为C.violaceum:mini-Tn5突变体,具有卡那霉素抗性,其自身不产生AHLs和紫色,当外源添加AHLs时能促使紫色杆菌CV026产生特征性的紫色菌素,其对酰基侧链长度为C4~C8的AHLs存在不同程度的敏感[19]。检测结果如图4所示。图4中,平板划线结果显示阳性对照C4-HSL及CS12均能诱导报告菌株CV026产紫色,在其孔径周围也出现紫色圈,且扩散明显,表明杀鲑气单胞菌CS12具有群体感应现象,能够产生AHLs。
采用GC-MS分析[20]检测未知且复杂的AHLs,如图5所示。由图5可见,6种AHLs标准品峰形尖锐且对称,各峰分离良好,从左至右依次为C4-HSL、C6-HSL、C8-HSL、C10-HSL、C12-HSL和C14-HSL,保留时间分别为4.414、6.166、8.133、10.414、12.994和16.244 min。图6为离子监测模式(SIM)下CS12粗提液的GC-MS色谱图。通过比对菌株CS12粗提液与AHLs标准品的色谱图,发现杀鲑气单胞菌CS12所分泌的AHLs以C6-HSL为主,保留时间为6.276 min。

图4 报告菌法检测菌株CS12的AHLs活性Fig.4 Detection of AHLs for strain CS12 by biosensor method

图5 AHLs混合标准品的GC-MS色谱图Fig.5 GC-MS chromatogram of mixture standard AHLs

图6 菌株CS12粗提液的GC-MS色谱图Fig.6 GC-MS chromatogram of extract of cell-free supernatant of strain CS12
2.5 群体感应抑制活性菌的筛选
采用直接接触共培养[21]的方式筛选具有抑制杀鲑气单胞菌CS12群体感应活性的拮抗菌株。图7为单菌及共培养的生长情况,各菌株菌密度自72 h开始基本趋于稳定且情况各异,不影响细菌指数期生长。杀鲑气单胞菌CS12与温和气单胞菌AS7、腐败希瓦氏菌SP01和粘质沙雷氏菌SM01共培养的菌密度与单独培养没有明显差异;与蜂房哈夫尼亚菌HA14共培养时,菌密度略高于两菌株的单独培养;与荧光假单胞菌PF03及嗜水气单胞菌AH11共培养时,菌密度有所降低,培养至120 h后与PF03共培养的菌密度出现下降趋势,可能引起了细胞衰亡。Zhao等[22]基于QS体外评估了荧光假单胞菌PF01-CFS对希瓦氏菌的生长情况,发现共培养对延滞期和指数期的生长速率没有影响,而在稳定期引起细胞衰退,且表示CFS的抑制活性可能与PF分泌的AHL和DKP化合物的竞争效应相关。
通过观察上述结果,选取目标菌株CS12和PF03、AH11、HA14及分别与CS12共培养生长至72 h及168 h的菌液,分别进行CV026报告平板扩散实验,结果如图8所示。由图8可见,培养至168 h,紫色圈直径均有所减小,表示细菌产信号分子能力减弱。比较单菌及共培养情况,发现与PF03共培养紫色圈直径明显变小;与AH11共培养紫色圈直径大小与产信号分子能力较弱者AH11相近;与HA14共培养至72 h紫色圈直径相较单菌偏小,而培养至168 h时紫色圈直径大小介于两单菌之间。因此笔者认为与荧光假单胞菌共培养能有效减弱产信号分子能力。有研究发现荧光假单胞菌是一种重要的植物病害生防菌和根际促生菌,能够产生多种抗生性次级代谢产物[23],因此也可能是存在菌间竞争或窃听行为[24]。
3 结论
从腐败海鲈鱼中分离得到1株杀鲑气单胞菌CS12,不耐酸,pH≤5.0不生长,主要分泌C6-HSL信号分子,与荧光假单胞菌PF03共培养时菌密度及产信号分子能力均有所降低,但不影响指数期的生长速率,表明对杀鲑气单胞菌CS12产生了群体感应抑制作用,自稳定期开始出现。

图7 单菌及共培养的生长情况Fig.7 Growth curves to cultured alone and co-cultivation with strain CS12

图8 报告平板扩散法检测单菌及共培养菌株的AHLs活性Fig.8 Detection of AHLs to cultured alone and co-cultivation with strain CS12 by biosensor method
荧光假单胞菌是水产品的优势腐败菌之一,同时也是重要的病害植物生防菌,自身能够产生多种抗生性的次级代谢产物,共存体系中对沙雷氏菌、希瓦氏菌等具有体外抑制作用,过程受群体感应AHLs调控。目前有关杀鲑气单胞菌及致腐方面的研究报道比较少,荧光假单胞菌的优势作用也未完全得到解析,基于群体感应系统对共培养的探讨以及种间群体感应的作用机制研究仍需深入探讨。
