超声造影联合增强CT诊断不典型肝血管平滑肌脂肪瘤的临床价值
2020-05-25李士英陈金叶
李士英,陈金叶
(重庆市黔江中心医院 放射科,重庆 409000)
肝血管平滑肌脂肪瘤(hepatic angiomyolipoma,HAML)是一种罕见的肝脏良性间叶性肿瘤,由血管、平滑肌细胞和脂肪细胞三种不同比例的组织成分构成[1]。大多数HAML患者在确诊时没有明显症状[2],易被误诊为肝细胞癌、脂肪瘤、脂肪肉瘤等良恶性肝脏疾病[3,4],HAML的最终诊断主要依靠术中组织病理学检查[5]。提高HAML的术前诊断正确率对于HAML的治疗是至关重要的,既往主要应用的影像学诊断方法为强化电子计算机断层扫描(contrast-enhanced computed-tomography,CECT)、磁共振成像(magnetic resonance imaging,MRI)[6,7]、对比增强超声(contrast-enhanced ultrasonography ,CEUS),其在HAML诊断中的应用也逐渐增多[8,9]。但是,由于HAML的组织成分差异较大,导致其在影像学中表现多样且不典型[10],其术前诊断正确率仍较低。目前,联合应用多种影像学方法诊断HAML的研究较少,为此,本研究对HAML在CECT和CEUS上的影像学表现进行分析研究,并探讨二者联合对HAML术前诊断的应用价值。
1 材料和方法
1.1 一般资料
本研究是一项经医院伦理委员会批准的回顾性研究,该研究通过检索我院2011年6月~2017年6月的病理档案系统,发现52例明确诊断为HAML的患者,纳入标准:(1) 经病理学检查明确诊断为HAML;(2) 均进行CECT和CEUS检查;(3) 具有完整的临床资料、影像学信息及病理信息;(4) 病变组织经手术切除。排除标准:(1) 未进行CECT检查(n=3);(2) 未进行CEUS检查(n=4);(3) 只进行了组织活检,未进行手术切除(n=2)。最后纳入研究的患者为43例,其中,男性8例、女性35例,年龄28~65岁,中位年龄43岁,平均年龄(42±10)岁。所有患者的一般资料无统计学差异。
1.2 检查方法
1.2.1超声
超声检查应用东芝彩超aplio500多普勒超声诊断仪。使用多频4C1凸阵探头进行常规超声检查以选取合适的观察角度。应用对比脉冲序列(CPS)成像模式进行CEUS,机械指数<2。将2.4 mL SonoVue造影剂以团注方式注入肘静脉,然后用5 mL生理盐水冲洗。注射造影剂后,连续扫描肝脏病变4 min,包括动脉期(注射造影剂开始0~30 s)、门脉期(注射后31~120 s)和延迟期(注射后121~240 s)。如果病变显示不在相同的扫描平面上,则对同一患者进行第二次CEUS。增强模式根据与相邻肝实质相比占病变面积50%以上的优势强化模式来定义。廓清是指病变在CEUS上动脉期表现出比周围肝实质更高的回声,随后在门静脉或延迟期表现为低回声。
1.2.2CT
腹部CT采用MDCT 64层多层螺旋CT进行。首先进行非增强扫描,在使用动力注射器以4.0 mL/s的速率经肘静脉注入100~120 mL优维显370造影剂后,进行对比增强扫描。注射造影剂后30 s开始动脉期扫描,60 s开始门脉期扫描,延迟期采集序列起始时间为180 s。增强模式根据与邻近肝实质相比占病变面积50%以上的主要强化模式来定义。廓清是指病变在CECT上动脉期表现为高密度,随后在门脉期或延迟期表现为低密度。
1.3 观察指标
1.3.1CEUS观察指标
(1)病变的非增强超声特征,如位置、大小、形状、边缘和回声等特征;(2)增强超声检查时,动脉期、门脉期、延迟期的不同增强强度(超增强、等增强、低增强)和不同模式(不均匀,周边边缘状,结节状,均匀)。上述观察结果由两名有丰富肝脏超声检查经验的资深医生进行评估并作出诊断。
1.3.2CECT观察指标
(1)病变在CT平扫下的特征,如病变位置、大小、形状、边缘和密度;(2)增强CT检查时,动脉期、门脉期、延迟期的不同强化强度(高强化、等强化、低强化和无强化)和不同模式(不均匀、周边边缘状、结节状、均匀)。上述观察结果由两名有丰富肝脏放射学经验的放射科医生进行评估并作出诊断。
1.4 HAML诊断标准
HAML CEUS诊断标准[8]:基线US上清晰、明显的高回声结节(不均匀或均匀),周围没有低回声晕;CEUS上动脉期的高强度强化(不包括最初的周边结节强化和轮辐动脉),并在晚期保持超增强或等强化。
HAML CECT诊断标准[11]:CECT上显示病变内的脂肪成分;中心或周围大血管的存在;明显不均匀的早期和持续增强;缺乏包膜;静脉血栓形成。
1.5 HAML组织病理学检查
(1) 对大体切除标本进行评估,评估指标包括肿瘤的大小、位置、边缘、肿瘤包膜的存在或不存在、坏死、出血、囊性变性、脂肪和钙化的存在和程度;(2) 大体切除组织用福尔马林固定,常规石蜡包埋。记录病变组织的组织学特征,包括肿瘤的三种组织成分(血管、平滑肌细胞和脂肪细胞)的大致比例,以及肿瘤生长模式;(3) HAML的病理诊断基于黑素细胞标记HMB-45染色阳性、CD63染色阳性,以及泛角蛋白标记KL 1和AE1/AE3染色阴性[12,13];HAML分型包括:混合型、肌瘤型、脂肪瘤型和血管瘤型[10]。
1.6 统计数据
应用 SPSS 22.0 统计软件进行统计分析,计数资料以例数n(%)表示,用卡方检验或Fisher确切概率法来比较两种检查方法间的差异。以α=0.05为检验水准,P<0.05被认为差异具有统计学意义。
2 结果
2.1 患者HAML的一般特征
43例患者中有37例为单发病灶,6例患者同时存在2个病灶,共49个病灶,HAML的平均大小为(5.9±4.3) cm,范围为1.6~23.0 cm(中位数6.7 cm)。其中,32个病灶位于肝右叶(65.31%),17个病灶位于肝脏左叶。所有病例均无门静脉和肝静脉血栓形成。所有HAML患者的影像学和病理检查均未发现包膜。经大体标本和组织切片诊断,49例HAML中,混合型24例(48.98%)、脂肪型10例(20.41%)、肌瘤型12例(24.49%)、血管型3例(6.12%)。
2.2 超声检查结果
2.2.1HAML的常规超声表现
不同类型HAML在常规超声中的回声分布如表1所示。不同病理类型的HAML回声表现如下:22例脂肪型(91.67%)、8例混合型(80.0%)、7例(58.33%)肌瘤型,以及2例(66.67%)血管型HAML表现为高回声,其余为低回声。49个HAML病灶均光滑,轮廓清晰。其中,34例(69.39%)病灶显示为不均匀高回声,5例(10.20%)为均匀高回声,6例(12.24%)为不均匀低回声,4例(8.16%)为均匀低回声。
2.2.2HAML的CEUS表现
CEUS上不同时相病变的动态增强如表2所示。其中,动脉期46个(98.1%)病变显示高增强,3个病变显示低增强。门脉期,35个(71.43%)病灶显示高增强,7个病灶显示等增强,7个病灶显示等增强。延迟期,32个(65.31%)病灶显示高增强,7个病灶显示等增强,10个病灶显示低增强。

表1 常规US和非增强CT上HAML的影像特征(n)
a.与肌瘤型、血管瘤型相比,P<0.05

表2 CEUS上HAML的影像特征(n)
不同病理类型的HAML的CEUS增强特征如表3所示。动脉期除了2个脂肪型HAML显示为低增强,其余47个(95.92%)病灶均显示为高增强。8个病灶(16.33%)在延迟期出现廓清,此外,肌瘤型(41.67%)发生廓清的频率显著高于混合型(8.33%,P=0.017)。
2.3 CT检查结果
2.3.1HAML的非增强CT平扫表现
不同类型HAML在非增强CT中的密度如表1所示。HAML在非增强CT上表现为肝脏内边界清楚的低密度区域,其中37个为不均匀低密度团块、12个为均匀团块。在31个病灶的非增强CT平扫中检测到脂肪(63.27%)。在所有脂肪型、20个混合型(83.33%)、1个肌瘤型HMAL(8.33%)中检测到脂肪,在血管瘤型HAML中未检测到脂肪。脂肪的检出率在不同类型的HAML中有显著差异(P<0.05)。
2.3.2HAML的CECT表现
CECT上不同时相的增强模式如表4所示。由表4可知,动脉期,29个病灶(59.18%)表现为高增强、20个病灶(40.82%)表现为低增强。门脉期,18个病灶显示高增强、6个病灶显示等增强、25个病灶显示低增强。延迟期,9个病灶显示高增强、5个病灶显示等增强、35个病灶显示低增强。
不同病理类型的HAML的CECT增强特征如表5所示。动脉期,肌瘤型高强化的频率显著(90.91%)多于脂肪瘤型(10.00%,P<0.001);混合型HAML动脉高强化的频率(52.94%)也显著多于脂肪型(10.00%,P=0.026)。在增强CT的延迟期,21个病灶(42.86%)出现廓清。肌瘤型廓清(83.33%)的频率显著多于脂肪瘤型(10.00%,P<0.001),此外,CECT上HAML的廓清率显著高于CEUS(P=0.004)。
2.4 诊断HAML的准确性
CECT、CEUS、CECT联合CEUS诊断HAML的准确性如表6所示。术前经CECT准确诊断HAML者有17例(34.69%),经CEUS准确诊断HAML者有28例(57.14%),而二者联合准确诊断HAML者有38例(77.55%),准确性显著高于单独应用CECT或CEUS(P<0.05)。

表3 CEUS上不同病理类型的HAML影像特征(n)
a.与混合型HAML相比,P<0.05
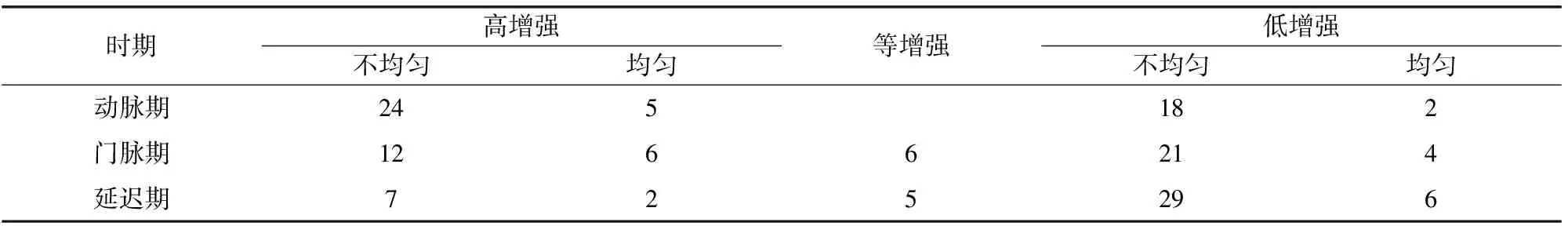
表4 CECT上HAML的影像特征(n)

表5 CECT上不同病理类型的HAML影像特征(n)
a.与混合型、肌瘤型HAML相比,P<0.05;b.与脂肪瘤型HAML相比,P<0.001

表6 不同病理类型术前诊断的准确性(n)
3 讨论
血管平滑肌脂肪瘤是一种良性间叶性肿瘤,最常发生在肾脏,少见于肝脏,大多数发生在肝脏的AML是孤立存在的[14]。根据组织成分比例不同,HAML可分为4种亚型:混合型、脂肪瘤型(≥70%脂肪)、肌瘤型(<10%脂肪)和血管瘤型[10],其中最常见的亚型是混合型,由平滑肌上皮细胞、脂肪细胞和异常血管组成。脂肪型主要由脂肪细胞组成,肌瘤型主要由平滑肌上皮细胞组成。肌瘤型在肝脏比在肾脏更常见。血管瘤型的主要构成为粗大的厚壁血管,这在影像学检查中可能被误认为是肝内动脉瘤。此外,血管瘤型HAML含有较少的脂肪组织(<10%)[15]。
HAML在女性中的患病率高于男性,患者通常起病隐匿,没有明显的症状[14,16]。本研究中男性患者8例、女性35例,女性明显多于男性(P<0.001),且43例患者中37例为单发病灶,6例患者同时存在2个病灶,孤立HAML的患者明显多于多发者(P<0.001),这与Yen等[14]及Petrolla等[16]的研究结果一致。
由于HAML组成成分差别较大,诊断较为困难,易被误诊为肝细胞癌、脂肪瘤、脂肪肉瘤等肝脏良恶性肿瘤。增强CT在鉴别肝脏良性结节和恶性肿瘤方面具有优势[17],然而,一些回顾性研究认为CT对HAML诊断不敏感[4]。此外,也有报道多普勒超声和对比增强超声(CEUS)在诊断HAML中的应用[18]。检查方法的单一性导致HAML的术前正确诊断率较低,约为25%~52%[3]。不正确的诊断增加了后续治疗的难度。
多种成像方法,包括超声、CT等已经被用来描述HAML的不同影像表现[19,20]。脂肪成分是CT平扫中诊断HAML的依据,在非增强CT扫描上密度<-20 HU表明病变中存在脂肪成分[6]。但是不同种类HAML的脂肪构成比例差别较大,大约1/3的HAML脂肪含量小于10%[21],这导致CT诊断HAML的难度增加。本研究中,有63.27%的HAML检测到脂肪,脂肪的检出率在不同类型的HAML中有显著差异(P<0.05)。在所有脂瘤型和大多数混合型HAML(83.33%)中检测到脂肪,但在肌瘤型HAML(8.33%)中很难检测到脂肪,未在何血管瘤型HAML中检测到脂肪,这与徐少真等的研究一致[22]。此外,HAML在CT平扫中通常表现为低密度肿瘤[1],本研究中 49个病灶均表现为低密度肿瘤,这与Nonomura等的研究结果一致。HAML由于其高脂肪含量,通常在常规超声检查上表现为高回声[1]。本研究中,79.59%病灶在常规超声中表现为高回声,显著多于低回声病灶,这也与Nonomura 等的研究结果一致。此外,也有研究认为HAML在非增强超声下的回声不仅受病变中脂肪含量的影响,而且还受肿瘤中脂肪、平滑肌细胞和血管分布模式的影响。因此,一些在非增强CT中未检测到脂肪的HAML,可在在非增强超声中显示为高回声[11]。然而,在非增强超声中,HAML的高回声表现很难与其他肝脏肿瘤高回声表现鉴别开来[23],导致非增强超声术前诊断HAML的难度也较大[4]。
研究表明,血管成分是诊断HAML的依据,约57.1%~100%的HAML在CECT上表现为动脉期高增强[6,24]。本研究中,约59.18%的HAML表现为动脉期高增强,与上述研究结果一致。廓清通常被认为是动态增强成像方式上显示肝脏局灶性病变恶性程度的一个重要特征,据报道,约50%~100%的HAML在CECT上表现为廓清[24,25],本研究中42.86%的HAML在CECT延迟期表现为廓清,稍低于上述研究结果,这可能与不同的研究中样本数量以及HAML病理类型不同有关。
在先前的多项研究中,HAML在CEUS上通常表现为持续高增强,即在动脉期表现为高增强,在延迟期或门脉期表现为高增强或等增强[8,9,26]。在本研究中,约95.92%的HAML在CEUS上显示动脉期高增强,与上述研究结果一致。此外,仅有16.33%的HAML在CEUS上表现为延迟期廓清,比CECT上出现廓清的HAML少,可能是CEUS与CECT的造影剂药代动力学不同导致了上述差异[26]。
CEUS诊断HAML主要依据是非增强超声上清晰、明显的高回声结节,周围无低回声影;动脉期超增强,并在延迟期保持超增强或等增强[8]。CECT诊断HAML主要依据是病变内的脂肪成分、血管、无包膜、无静脉血栓形成等[11]。本研究中,术前经CECT准确诊断HAML者有34.69%,经CEUS准确诊断HAML者有57.14%,二者联合准确诊断HAML者有77.55%,联合诊断的准确性显著高于单独应用CECT或CEUS(P<0.05)。
CECT上显示的病灶高廓清频率可能会增加HAML误诊为恶性肿瘤的机率,而大多数HAML在CEUS上表现出持续的增强模式,即动脉期的高增强和晚期的持续高增强或等强化[10,27,28],持续增强是实体良性肝脏肿瘤的典型模式[29-31],有助于排除恶性肿瘤的诊断。此外,CT对脂肪成分的检测敏感性有助于HAML的诊断[10]。因此,两者结合可以提高HAML诊断正确率。
综上所述,由于HAML组织成分的比例存在差异,导致其影像学表现各异,但HAML在CECT和CEUS上的表现也有一定的特征性,因此,二者联合应用可以提高HAML诊断正确率,具有较高的临床推广价值。
