干酪乳杆菌发酵对发芽薏米营养组成和生物活性的影响
2020-05-25王清爽朱灵灵王晓乐陈晓明
王清爽 高 珊 朱灵灵 王晓乐 陈晓明 徐 磊
(淮阴工学院生命科学与食品工程学院,淮安 223003)
薏米(Coixlachryma-jobiL.),又名薏苡仁或薏仁米,一年生或多年生草本植物,是我国南方传统经济作物。薏米富含蛋白质、脂类、多糖、多酚、黄酮类等生物活性成分[1],具有降血糖、缓解高尿酸血症、抑制癌细胞增殖等多种药理活性[2,3]。作为一种药食两用资源,薏米具有较高的营养保健功能和药用价值,相关产品在中国、韩国、日本等国家已经得到开发。
发芽作为一个有效且廉价的处理手段,已被广泛用于谷物和豆类理化特性的改善和营养品质的提升[4, 5]。谷物和豆类在发芽过程中,蛋白酶、纤维素酶等内源酶被激活,可有效改善谷物和豆类的蒸煮特性,促进活性物质释放,降低抗营养物质的含量[6]。同时,发芽过程中还可大量产生γ-氨基丁酸、多酚等生物活性物质[7]。研究表明薏米在发芽后淀粉、蛋白质发生显著降解,γ-氨基丁酸、总酚、总黄酮含量显著提高,抗氧化活性显著增强[8, 9]。此外,研究还发现薏米发芽后其水提取液营养组成发生显著变化,生物活性显著提高[10]。
发酵是谷物深加工的一种重要方式,利用对人体有益的微生物对谷物进行发酵,不仅可以改善谷物的风味和质构特性,还可以降低谷物中抗营养物质水平,提高生物活性。Rocchetti等[11]研究发现乳酸菌发酵藜麦和荞麦可显著提高两种谷物的总酚含量和抗氧化活性。Liang等[12]利用裂蹄木层孔菌对薏米和大米进行固态发酵,增加了两种谷物的非挥发性呈味物质含量。此外,Sripriya等[13]研究发现,将发酵和发芽结合可有效降低小米中抗营养物质水平,提高消化性。Lee等[14]利用戊糖乳杆菌发酵发芽黑豆,发现其水提取液对巨噬细胞具有免疫刺激活性。目前对发酵薏米的研究较少,对发芽薏米进行发酵处理国内外则鲜见报道。因此,利用干酪乳杆菌(Lactobacilluscasei)发酵不同发芽时间的薏米,研究不同发芽时间的薏米在发酵后蛋白质、多肽、氨基酸、总酚、抗氧化活性、黄嘌呤氧化酶和酪氨酸酶抑制活性的变化,以期为基于薏米的健康功能食品、化妆品的研发提供技术参考。
1 材料与方法
1.1 材料与仪器
薏米:兴仁小白壳,2018年产于贵州省;干酪乳杆菌(1011CFU/g);ABTS、TPTZ、酪氨酸酶、黄嘌呤氧化酶、奎诺二甲基丙烯酸酯(Trolox);其他试剂均为分析纯。
DYJ-B03T1型豆芽机;SPX-250B-Z型生化培养箱;FD-2C型冷冻干燥机;GJP-250D型立式振荡培养箱;5810R型台式高速大容量冷冻离心机;PHS-3C型pH计;LC-20AT 型高效液相色谱仪。
1.2 方法
1.2.1 发芽薏米的制备
称取挑选好的籽粒饱满的薏米150 g,经去离子水冲洗后用0.5%(V/V)NaClO浸泡消毒30 min,然后用去离子水冲洗3次,将其置于发芽机苗盘上,采用去离子水浸泡发芽。设置浸泡时间为12 h,每24 h更换去离子水一次。在25 ℃下恒温培育0、30、60 h后取样(分别记做G0、G30和G60),冷冻干燥,磨粉过60目筛后备用。
1.2.2 发酵发芽薏米的制备
分别称取发芽0、30、60 h的薏米粉20 g于100 mL烧杯中,加入20 mL去离子水和0.04 g干酪乳杆菌菌粉,搅匀、封口,然后在37 ℃下分别发酵24、48 h,取样冷冻干燥,磨粉过100目筛后备用。
1.2.3 发酵薏米水提取液的制备
准确称取3 g发酵薏米冻干粉于100 mL锥形瓶中,加入30 mL去离子水,25 ℃振荡提取2 h,然后将提取液3 500 g离心10 min。收集上清液,备用。
1.2.4 基本组成及总酚含量测定
采用凯氏定氮法测定蛋白质含量,参照GB/T 5009.5─2010;采用Megazyme试剂盒法测定淀粉含量,参照AACC 76─13;采用3,5-二硝基水杨酸(DNS)法[15]测定水提取液中还原糖的含量;采用福林-酚比色法[16]测定水提取液中总酚的含量,结果以没食子酸当量表示(μg GAE/mL)。
1.2.5 蛋白质分子质量分布测定
称取0.1 g发酵薏米样品,用4 mL 0.05 mol/L磷酸钠缓冲溶液(pH6.8,含有2% SDS)25 ℃旋转提取12 h,10 000 g离心15 min后,取上清液过0.45 μm的微孔滤膜后进行高效液相色谱分析:采用Shodex Protein KW-804凝胶色谱柱;流动相为含0.2% SDS的磷酸钠缓冲溶液;流速0.7 mL/min,检测波长214 nm。
1.2.6 多肽分子质量分布测定
0.5 g发酵薏米样品用5 mL 20%(V/V)乙腈25 ℃提取过夜,10 000 g离心15 min后,取上清液取过0.45 μm的微孔滤膜后进行高效液相色谱分析:采用TSK gel 2000 SWXL凝胶柱(300 mm×7.8 mm);流动相为含0.1%(V/V)三氟乙酸的10%(V/V)乙腈;流速0.5 mL/min,检测波长220 nm。
1.2.7 游离氨基酸含量测定
游离氨基酸含量测定参照GB/T 30987—2014。
1.2.8 铁离子还原能力(FRAP)及ABTS·+清除能力测定
FRAP的测定根据Benzie等[17]的方法并稍作修改。取2.7 mL FRAP试剂,90 μL上述水提取液,270 μL去离子水,涡旋混匀后室温避光反应30 min,在593 nm处测定吸光值。以Trolox绘制标准曲线,结果以μmol TE/mL计。
ABTS·+清除能力的测定根据Erel等[18]的方法并稍作修改。吸取0.2 mL水提取液加入3.9 mL ABTS·+工作液,涡旋混匀后室温避光反应15 min,在734 nm处测定吸光值。以Trolox绘制标准曲线,结果以μmol TE/mL计。
1.2.9 酪氨酸酶和黄嘌呤氧化酶抑制活性测定
酪氨酸酶抑制活性的测定参考傅佳愈等[19]的方法并稍作修改。将水提取液1 mL,酪氨酸酶液1 mL(250 U/mL),磷酸钠缓冲溶液3 mL(50 mmol/L,pH 6.5)依次加入10 mL离心管中,于37 ℃恒温箱中温育10 min。然后加入底物L-DOPA 0.5 mL(1.5 mg/mL)启动反应,立即在475 nm处记录吸光值,记录5 min,每隔30 s检测一次。
黄嘌呤氧化酶抑制活性的测定参考杨道茂等[20]的方法并稍作修改。将水提取液1 mL,黄嘌呤氧化酶液1 mL(0.05 U/mL)依次加入10 mL离心管中,在37 ℃恒温箱中温育10 min。然后加入底物黄嘌呤3 mL(0.42 mmol/L)启动反应,立即在295 nm处记录吸光值,记录5 min,每隔30 s检测一次。
1.3 数据处理与分析
试验数据采用SPSS 20.0软件进行方差及显著性分析,采用Origin 2018作图。
2 结果与分析
2.1 基本组成和总酚含量
薏米发酵过程中基本组成的变化如表1所示。薏米具有较高的蛋白质含量,发芽和发酵处理对薏米蛋白质含量没有显著影响。薏米发芽处理降低了淀粉含量,在发酵处理后淀粉含量进一步降低,发酵48 h后,G0、G30和G60淀粉含量分别降低了3.94%、5.00%和7.94%。在发酵前24 h,发芽薏米还原糖含量迅速增加,G0、G30和G60分别增长了5.17、3.88 mg/mL和13.74 mg/mL,而在发酵后24 h,还原糖含量都略有降低。
多酚类物质是薏米中的重要抗氧化物质,由表1可以看出,发芽处理提高了薏米总酚含量,在发芽薏米发酵后总酚含量随着发酵时间的延长显著增加。在前24小时,总酚含量增长速度较快,G0、G30和G60增长量分别为18.29、27.89 μg和35.41 μg GAE/mL;24 h后,增长速度显著减小,G0、G30和G60在24~48 h之间增长量分别为8.49、9.00 μg和13.21 μg GAE/mL。薏米中的酚类物质以结合态和游离态两种形式存在[3],干酪乳杆菌发酵过程中产生的多种酶可能导致结合酚释放,从而造成水提取液中总酚含量的上升。龚小洁等[21]以干酪乳杆菌发酵龙眼果肉,研究发现发酵导致发酵液的总酚含量明显增加,与本实验结果一致。
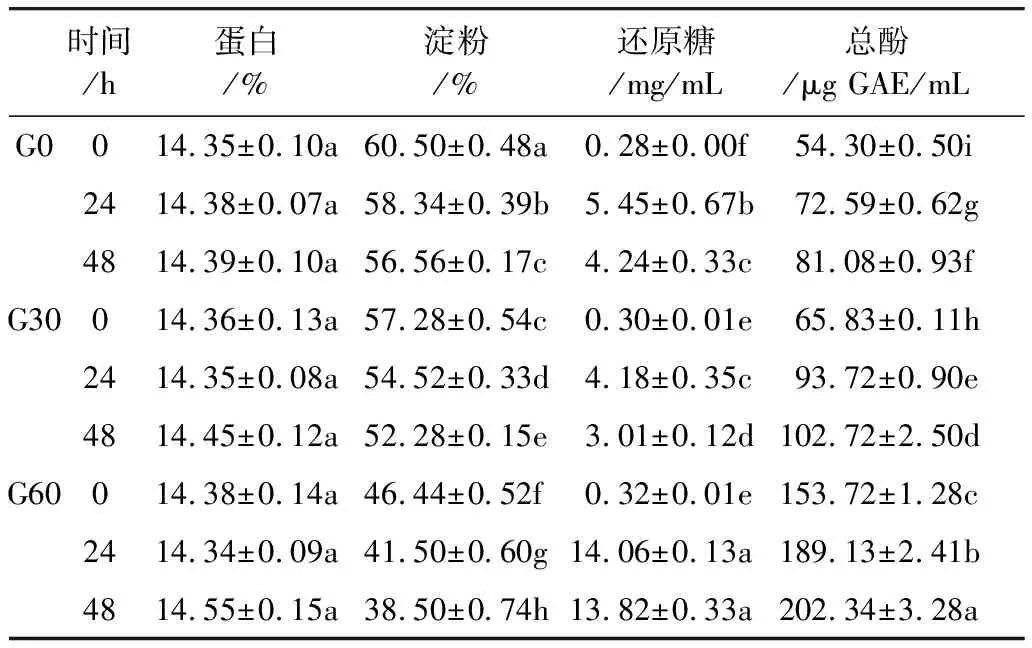
表1 发酵对发芽薏米基本组成和总酚含量的影响
2.2 蛋白分子质量分布
高效分子排阻色谱已被证实是一种可以对宽分子质量蛋白进行定性和定量分析的有效方法,具有检测灵敏度高、速度快等特点[22]。在发酵过程中发芽薏米蛋白分子质量分布的变化如图1所示,可将整个色谱图大致可分为F1(高分子质量蛋白质,MW>97.4 ku)、F2(低分子质量蛋白质,97.4 ku >MW>20.0 ku)和F3(肽和氨基酸,MW<20.0 ku)三个区域。研究发现薏米蛋白主要集中在F2区域,此与Ottoboni等[23]的研究结果一致。位于F1区域的高分子质量蛋白,G0在发酵后其面积显著增加,G30在发酵过程后其面积基本不变,而G60在发酵后面积显著减少,这主要是由于薏米发芽过程中已经逐渐将部分SDS不溶蛋白变为SDS可溶的高分子质量蛋白,再继续发酵则导致高分子质量蛋白被降解成低分子质量蛋白。位于F2区域的部分峰在发酵过程中面积显著降低,而部分靠近F1区域的峰面积显著提高,表明在发酵过程中存在F1区域的高分子质量蛋白部分被降解成F2区域的低分子质量蛋白,同时F2区域的部分低分子质量蛋白也被降解为F3区域的肽和氨基酸。位于F3区域的肽和氨基酸,在发酵过程中随着发酵时间的延长面积都显著提高。研究结果表明,发酵处理可以进一步降解发芽薏米蛋白质。
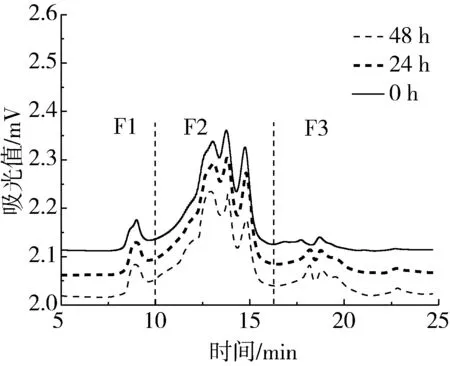


图1 发酵对发芽薏米蛋白分子质量分布的影响
2.3 多肽分子质量分布
由表2可以看出,发酵处理对多肽的分子质量分布可产生显著的影响,在发芽薏米发酵后绝大部分的多肽分子质量小于2 ku。G0随着发酵时间的延长,分子质量大于2 ku的多肽比例显著减小,而分子质量小于2 ku的多肽比例显著增大;分子质量大于5 ku的多肽面积显著减小,而分子质量小于5 ku的多肽面积显著增大。G30随着发酵时间的延长,分子质量大于5 ku的多肽比例显著减小,而分子质量小于5 ku的多肽比例显著增大;发酵后所有分子质量范围的多肽的面积都有显著提高。G60随着发酵时间的延长,分子质量大于10 ku的多肽比例显著减小,分子质量位于5 000~500 u的多肽比例显著增大,而分子质量<500 u的多肽比例略有降低;发酵后所有分子质量范围的多肽的面积都有显著提高。上述结果主要是由于不同发芽阶段的薏米在发酵过程中,由于干酪乳杆菌酶系的作用,薏米蛋白质会被酶解成不同分子质量的肽,同时大分子质量的肽也会被降解成小分子质量的肽。与本研究结果类似,Masahiro等[24]在研究乳酸菌发酵荞麦芽时发现,发酵处理可产生大量具有功能活性的多肽。

表2 发酵对发芽薏米多肽分子量分布的影响
2.4 游离氨基酸组成
发芽薏米在发酵过程中游离氨基酸的变化如表3所示。薏米发芽后游离氨基酸含量显著提高,在发酵处理后发芽薏米的所有游离氨基酸含量都随着发酵时间的延长而进一步增加。发芽薏米游离氨基酸含量在发酵前24 h增长最为显著,而后24 h增长速度降低,G0、G30和G60发酵48 h后总游离氨基酸增长量分别为6.31、11.53 mg/g和17.02 mg/g。在发芽薏米中,谷氨酸含量最高,发酵48 h后,G0、G30和G60中谷氨酸分别增加了1.09、2.62 mg/g和2.49 mg/g。在发芽薏米发酵过程中,亮氨酸增长最为显著,G0、G30和G60发酵48 h后分别提高了8.8、11.1和8.8倍,而半胱氨酸和丝氨酸增长则较为缓慢。Sripriya等[13]在研究发芽小米发酵过程中也报道了显著增长的游离氨基酸含量。
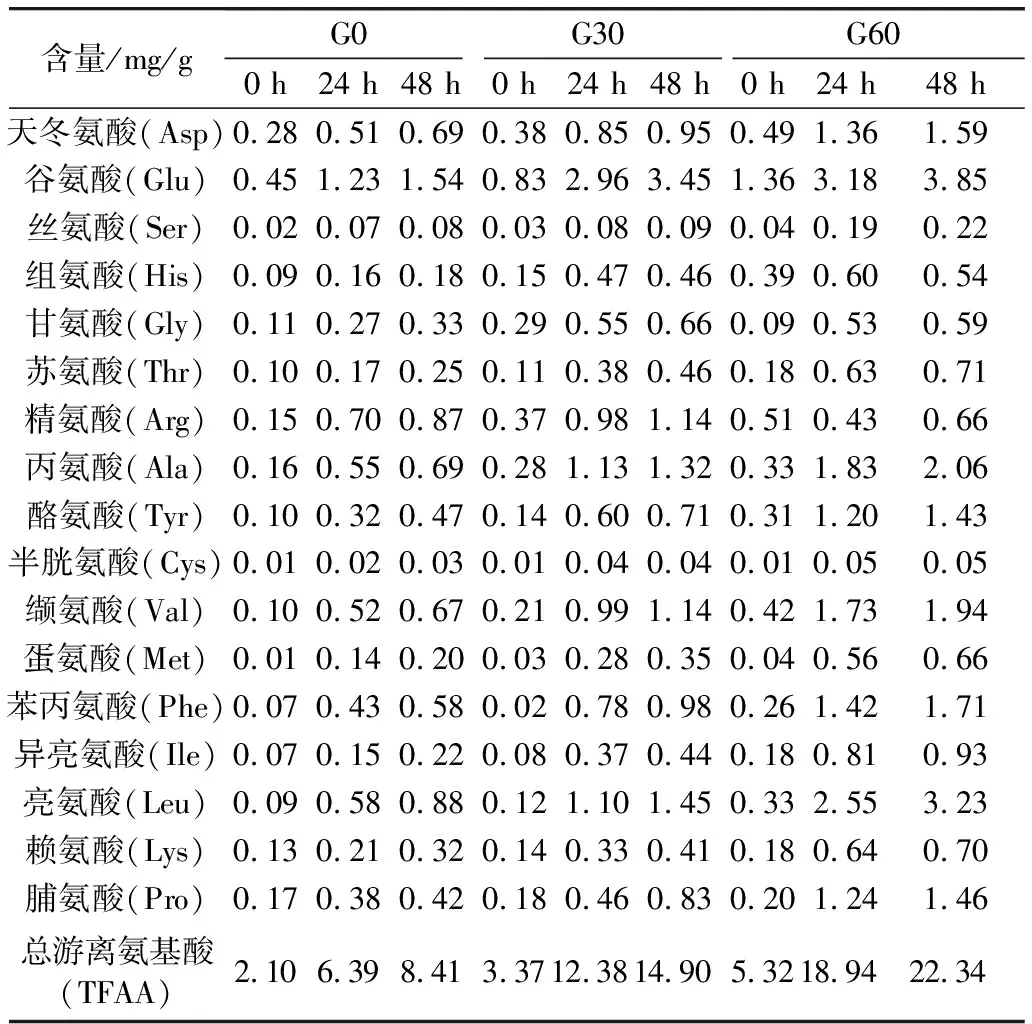
表3 发酵对发芽薏米游离氨基酸组成的影响
2.5 抗氧化活性
由图2可见,不同发芽阶段的薏米在干酪乳杆菌发酵后其水提取液抗氧化活性显著增加。FRAP在前24 h增长速度较快,G0、G30和G60分别增加了0.030、0.065 μmol和0.037 μmol TE/mL;而后24 h增长速度减小,G0、G30和G60增加值为0.021、0.014 μmol和0.032 μmol TE/mL。ABTS·+清除能力的变化趋势与FRAP相同,前24 h增长速度较快,G0、G30和G60分别增加了0.077、0.110、0.050 μmol TE/mL;而后24 h增长速度减小,G0、G30和G60增加值为0.014、0.017、0.026 μmol TE/mL。多酚是薏米中主要的抗氧化物质,发酵处理提高了发芽薏米水提取液中总酚含量,因此发酵后其抗氧化活性显著提高。Hiran等[25]在研究发酵和发芽联合处理玉米籽粒时发现,联合处理可显著提高玉米籽粒的抗氧化活性,与本实验结果一致。

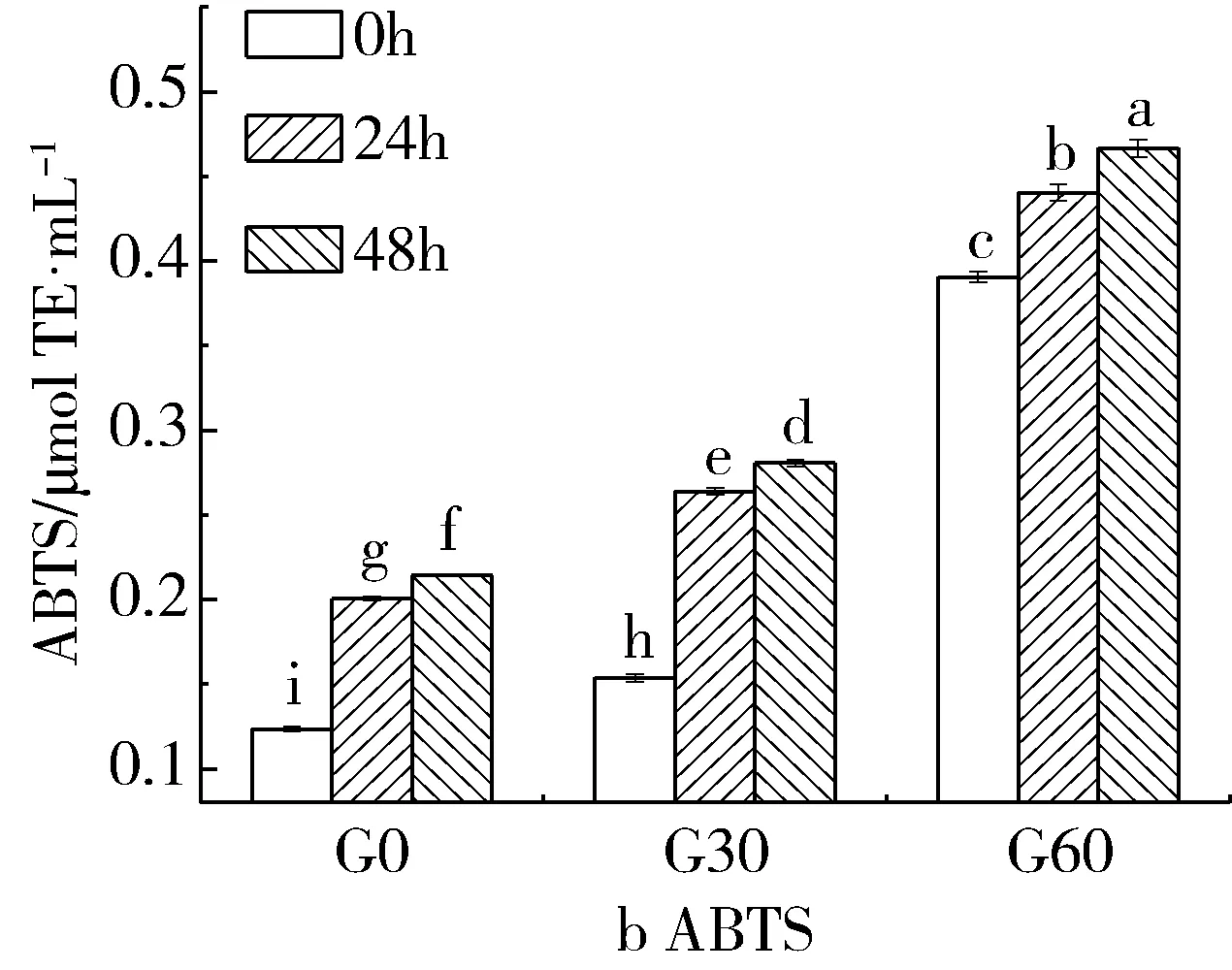
图2 发酵对发芽薏米水提取液FRAP和ABTS·+清除能力的影响
2.6 黄嘌呤氧化酶和酪氨酸酶抑制活性
黄嘌呤氧化酶是生物体内控制尿酸形成的关键酶,其活性较高易导致高尿酸血症,引发包括肥胖、糖尿病在内的多种代谢性疾病[26]。由图3可知,在发芽后薏米水提取液的黄嘌呤氧化酶抑制活性显著提高,而发芽薏米在干酪乳杆菌发酵后水提取液的抑制活性进一步提高。发酵48 h后,G0、G30和G60水提取液的抑制率分别提高了18.2%、19.0%和20.1%。
酪氨酸酶是生物体内催化黑色素形成反应的关键限速酶,其活性的过量表达可诱发黑色素沉着性疾病[27]。由图3可知,发芽处理显著提高了薏米水提取液的酪氨酸酶抑制活性,而在干酪乳杆菌发酵后发芽薏米水提取液的抑制活性进一步提高。发酵48 h后,G0、G30和G60水提取液的抑制率分别提高了22.3%、33.1%和8.0%。研究发现,多酚、多肽类物质都具有显著的黄嘌呤氧化酶和酪氨酸酶抑制活性[3, 28],发芽薏米发酵过程中水提取液显著增加的多肽和总酚含量可能导致黄嘌呤氧化酶和酪氨酸酶抑制活性的提高。与本研究结果类似,金一琼等[29]发现米曲霉发酵大米提取液可有效抑制酪氨酸酶活性,而郎充等[30]发现豆乳乳酸菌发酵后黄嘌呤氧化酶抑制活性显著提高。


图3 发酵对发芽薏米水提取液黄嘌呤氧化酶和酪氨酸酶抑制活性的影响
3 结论
研究表明,不同发芽时间的薏米在干酪乳杆菌发酵后,营养组成和生物活性都发生显著变化。干酪乳杆菌发酵后,发芽薏米蛋白质发生显著降解,低分子量多肽比例和面积显著提高,游离氨基酸含量显著增加。发芽薏米水提取液总酚含量、FRAP及ABTS·+清除能力随着发酵时间增加显著提高。干酪乳杆菌发酵48 h后,G0、G30和G60水提取液的黄嘌呤氧化酶抑制活性分别提高了18.2%、19.0%和20.1%,酪氨酸酶抑制活性分别提高了22.3%、33.1%和8.0%。本研究为薏米的精深加工提供了参考。
