大西洋鲑贮藏过程中微生物生长预测系统的构建
2020-05-25于祝祝王静雪
于祝祝,林 洪,王静雪*
(中国海洋大学食品科学与工程学院,山东 青岛 266003)
三文鱼是世界上最重要的商品鱼类之一,其中最具代表性的是大西洋鲑,由于其丰富的营养价值及鲜嫩的生食口感广受消费者青睐。近年来,随着生活水平的提高以及膳食结构的转变,人们对大规格、高品质的冷鲜三文鱼块的需求逐年上升[1-2],这就对其品质监测及保质期的延长提出了更高的要求。但是,切割后的鱼体表面存在大量的微生物,会在贮藏过程中分解鱼肉中的蛋白质等营养物质,导致鱼肉的腐败变质,影响产品品质及货架期。Gram等认为食物腐败可能是由化学反应和物理损害引起的,但是食物腐败的主要原因是微生物生长和代谢导致形成胺、硫化物、醇、醛、酮和有机酸等,这些物质产生令人不愉快和不可接受的异味,微生物是大多数水产品腐败的主要原因[3]。Jääskeläinen等认为鱼体死后的第一次变化(ATP、蛋白质分解)是由内源酶引起的[4],但微生物活动仍是鲜鱼腐败的主要原因[5]。
GB 10136—2015《食品安全国家标准 动物性水产制品》[6]中规定,生食制的动物性水产制品的菌落总数最高限量为105CFU/g。现有的三文鱼研究中,通常测得的三文鱼初始微生物数量在102~104CFU/g之间[7-10],随贮藏时间的延长,菌落数量逐渐增多,在临近腐败时微生物数量达到107CFU/g左右。而在众多微生物中,特定腐败菌被认为是食品腐败的主导者[11]。目前对于三文鱼的研究结果表明,三文鱼在大多数贮藏过程中的特定腐败菌为假单胞菌,它与三文鱼的腐败情况有着极高的相关性[7,12-13]。与此同时,刘娜娜的研究表明,希瓦氏菌与水产品的三甲胺、挥发性盐基氮等腐败物质的产生有关[14]。因此,在三文鱼生产、流通及贮藏过程中,对菌落总数、假单胞菌数量以及希瓦氏菌数量的监控尤其重要。
利用传统方法进行微生物培养、计数往往需要2~3 d的时间,不利于流通环节中对三文鱼的品质进行监测和预判。预测微生物学将微生物学、数学及计算机技术等相结合,用数学方法描述微生物数量与外界环境之间的响应关系,可以完成对微生物生长动力学的预测,从而能够很好地对微生物生长进行监控、预测产品货架期,极大降低食品腐败风险[15]。张新林等将荧光假单胞菌接种于无菌三文鱼块和三文鱼汁中,建立了不同温度条件下三文鱼中荧光假单胞菌的生长预测模型,发现修正的Gompertz方程拟合所得的各温度下货架期方程更优[16],Powell等开发了用于预测冷藏温度(0~10 ℃)气调包装贮存的大西洋鲑鱼中细菌的生长预测模型[9]。丁婷等研究了不同冷藏温度下三文鱼片中菌落总数、明亮发光杆菌、乳酸菌、假单胞菌以及产H2S细菌的生长情况,发现Baranyi and Roberts模型能更好地描述冷藏三文鱼片中微生物的生长,Belehradek方程能很好地预测三文鱼片的剩余货架期[17]。但是,目前已有研究大都停留在拟合获得参数、建立模型公式的阶段,用户仍需学习基础模型的使用并且通过计算仅能获得时间点的信息,缺乏对未来生长趋势的直观认识。ComBase是目前已有的预测微生物学信息数据库,可以在线预测不同生长条件下多种微生物的生长情况[18],但所得数据大多基于培养基条件,与三文鱼本身作为生长基质、多种微生物自然生长的状态有所不同。因此,如何将三文鱼贮藏过程中微生物的生长模型生成软件、更好地应用模型指导生产仍是目前需要解决的问题。
本实验通过测定不同贮藏温度(4、10、25 ℃)下大西洋鲑鱼片的菌落总数、假单胞菌和希瓦氏菌的数量,发现大西洋鲑鱼肉上不同微生物的生长规律。通过一级模型建立恒温贮藏过程中微生物数量与贮藏时间的关系,通过二级模型建立贮藏温度与微生物生长延滞时间、最大比生长速率的关系,进而完成对0 ℃以上条件贮藏大西洋鲑中微生物生长过程的预测。在公式拟合的基础上通过Visual Basic语言的编写,将更多公式和计算过程由计算机后台承担,实现用户仅需输入初始微生物数量、温度、贮藏时间,即可获得当前微生物数量以及微生物生长曲线,达到简化预测模型应用的目的。
1 材料与方法
1.1 材料与试剂
大西洋鲑样品购自东方海洋科技股份有限公司烟台三文鱼养殖场。
平板计数琼脂培养基 北京陆桥技术股份有限公司;铁琼脂培养基、假单胞选择性培养基、假单胞选择性培养基添加剂 青岛高科园海博生物技术有限公司。
1.2 仪器与设备
SW-CJ-2FD洁净工作台 苏州安泰空气技术有限公司;HN-08拍击式无菌均质机 上海汉诺仪器有限公司;HH-BH电热恒温培养箱 上海跃进医疗器械厂;Axz-260B光照培养箱 宁波江南仪器厂。
1.3 方法
1.3.1 样品处理
活鱼捕捞后在加工车间按照正常售前处理方式进行清洗、去皮、切块、包装,以层鱼层冰的形式放入保温箱中运往实验室,在超净工作台中进行切块,每块约25 g,采用无菌均质袋包装,放入恒温培养箱中进行贮藏,温度分别为4、10 ℃及25 ℃。贮藏过程中选择适合的时间间隔取样测定。
1.3.2 微生物数量测定
在特定的贮藏时间间隔取出装有鱼肉的均质袋放入超净工作台中,在装有25 g鱼肉的无菌均质袋中倒入225 mL无菌生理盐水,采用无菌均质机拍击3 min制成样品匀液,菌落总数的测定方法参照GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》[19]进行。假单胞菌数的测定采用假单胞选择性培养基进行平板计数,梯度稀释操作过程同菌落总数的测定,在培养基冷却至50 ℃左右、未倾注平板前加入假单胞选择性培养基添加剂,晃动锥形瓶使其混合均匀,然后倾注平板,待平板凝固后翻转,(30±1)℃下培养(48±2)h。希瓦氏菌数量测定采用铁琼脂培养基,(25±1)℃下培养(48±2)h,培养后对黑色菌落进行计数[20-21]。每次测定3~4 组样品。
1.3.3 微生物生长模型拟合
将大西洋鲑在4、10 ℃和25 ℃贮藏过程中测得的各项微生物数量分别采用修正的Gompertz模型[16,22]和Baranyi and Roberts模型[17,23]进行拟合,得到不同温度下微生物数量与大西洋鲑贮藏时间的关系,即为微生物生长的一级模型,选择最优公式拟合结果进行二级模型的建立。
修正的Gompertz模型见式(1)。
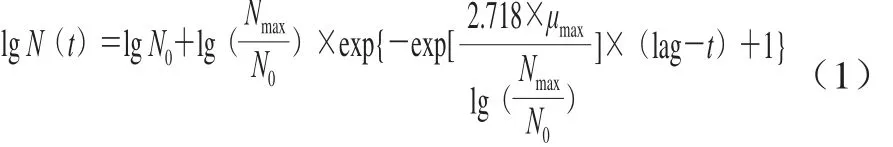
式中:t表示时间/h;N0表示最初菌落数(lg(CFU/g));Nmax表示最大菌落数(lg(CFU/g));lag表示生长延滞时间/h;μmax表示最大比生长速率/h-1。
Baranyi and Roberts模型见公式(2)。

式中:ymax表示微生物数达到稳定时的最大值(lg(CFU/g));μmax、μ0分别表示最大比生长速率/h-1、比生长速率/h-1,当ymax>>y0时,μmax=μ0;h表示适应因素;t表示时间/h。
在一级模型的基础上,采用Belehradek方程(平方根模型)[24]作为二级模型反映温度和微生物生长速率以及生长延滞时间之间的关系,具体见公式(3)、(4)。
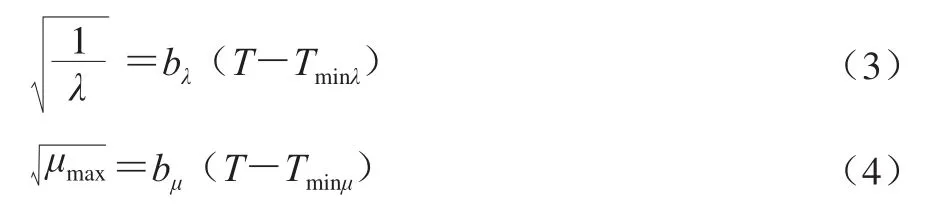
式中:bλ、bμ为方程系数;λ表示微生物生长延滞时间/h;T代表贮藏温度/℃;Tmin是一个假设的概念,指的是微生物没有代谢活动时的温度,或者是最大比生长速率时的温度。Tmin通过延长回归线与温度轴相交得到,此时最大比生长速率为0。
1.4 数据处理与分析
实验数据采用Excel 2003软件和OriginPro 8.0软件分别进行数据处理和作图,并选择合适的模型对数据进行回归分析。选用Visual Basic(VB6 Mini)软件作为微生物生长预测程序编写工具。
2 结果与分析
2.1 恒温贮藏过程中大西洋鲑菌落总数、假单胞菌及希瓦氏菌生长预测方程

图 1 修正的Gompertz模型(A)和Baranyi and Roberts模型(B)拟合大西洋鲑25 ℃贮藏期间微生物数量变化情况Fig. 1 Evolutionary curves of microorganism counts on Atlantic salmon stored at 25 ℃ fitted to modified Gompertz model (A) as well as Baranyi and Roberts models (B)
利用修正的Gompertz模型和Baranyi and Roberts模型对25 ℃贮藏过程中大西洋鲑的菌落总数、假单胞菌数量和希瓦氏菌数量随时间的变化情况进行拟合,结果如图1所示。两种模型拟合曲线相似度较高,其中,修正的Gompertz模型拟合曲线从生长期进入平台期的过程更为平缓。拟合所得具体参数如表1所示,不同模型的拟合效果可由决定系数(R2)反映,R2越接近1,说明公式与微生物生长情况拟合程度越好。结果显示修正的Gompertz模型和Baranyi and Roberts模型都能够较好地拟合三类微生物的生长情况,但修正的Gompertz模型在拟合25 ℃贮藏大西洋鲑的假单胞菌生长延滞时间时出现负值,不符合已知微生物生长规律,Baranyi and Roberts模型拟合结果能够更好地反映25 ℃贮藏大西洋鲑中的微生物生长情况。
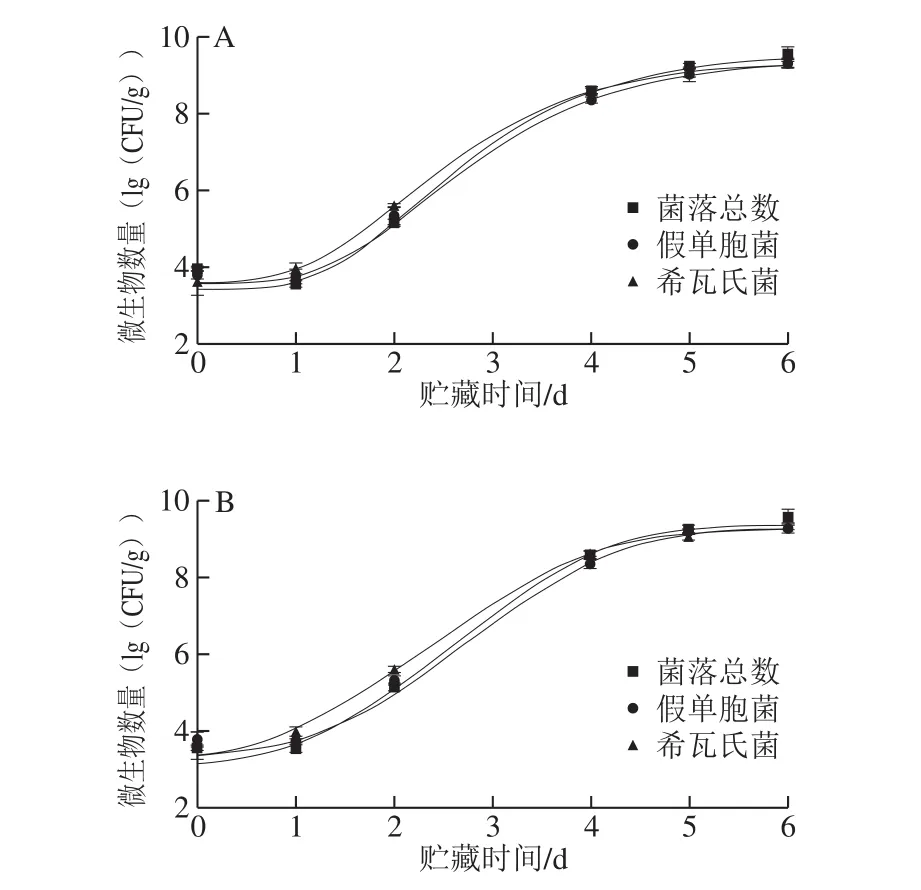
图 2 修正的Gompertz模型(A)和Baranyi and Roberts模型(B)拟合大西洋鲑10 ℃贮藏期间微生物数量变化情况Fig. 2 Evolutionary curves of microorganism counts on Atlantic salmon stored at 10 ℃ fitted to modified Gompertz model (A) as well as Baranyi and Roberts models (B)
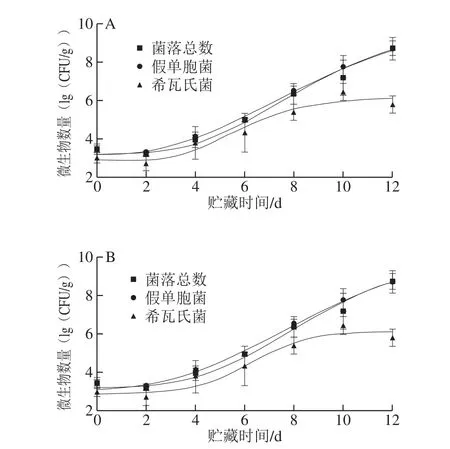
图 3 修正的Gompertz模型(A)和Baranyi and Roberts模型(B)拟合大西洋鲑4 ℃贮藏期间微生物数量变化情况Fig. 3 Evolutionary curves of microorganism counts on Atlantic salmon stored at 4 ℃ fitted to modified Gompertz model (A) as well as Baranyi and Roberts models (B)
10 ℃和4 ℃贮藏过程中大西洋鲑的菌落总数、假单胞菌数量和希瓦氏菌数量随时间的变化情况拟合结果分别如图2、3所示,修正的Gompertz模型和Baranyi and Roberts模型拟合曲线基本一致。因此,结合25 ℃拟合结果,更适合反映微生物数量与大西洋鲑贮藏时间关系的一级模型为Baranyi and Roberts模型。
结合3 个温度两种模型拟合所得参数(表1),可以看出温度对微生物的延滞期以及最大比生长速率影响显著。随着贮藏温度的下降,微生物生长的延滞期延长,最大比生长速率下降:25 ℃贮藏时微生物的生长延滞时间都在7 h以内,最大比生长速率均在0.1 h-1以上;10 ℃贮藏时微生物的生长延滞时间约在20~35 h之间,最大比生长速率在0.08 h-1左右,4 ℃贮藏时微生物生长延滞期均在60 h以上,最大比生长速率在0.03 h-1左右。与丁婷[25]的研究结果相比,本实验拟合所得微生物生长延滞期更长,最大比生长速率更小,推测原因为本实验所用大西洋鲑为活鱼处理,新鲜程度更高,初始菌落总数相较于丁婷等的研究结果减少了1(lg(CFU/g))以上。Teleken等研究了Richards模型拟合鱼肉中假单胞菌的生长,结果同样发现鱼肉的初始假单胞菌数量和最终假单胞菌数量在不同贮藏温度下差别不大,温度主要影响微生物的最大比生长速率与延滞期[26],所得结果与本实验较为接近。

表 1 不同贮藏温度下微生物生长参数拟合结果Table 1 Fitting parameters for microbial growth at different storage temperatures
2.2 大西洋鲑贮藏过程中微生物生长二级模型拟合
Baranyi and Roberts模型较为准确地拟合出了4、10、25 ℃贮藏过程中大西洋鲑的菌落总数、假单胞菌数量以及希瓦氏菌数量变化情况,但是无法反映其他温度下3 类微生物的生长,因此需要建立微生物生长参数与温度之间的关系,采用Belehradek方程(平方根模型)进行大西洋鲑贮藏温度与微生物生长延滞时间、最大比生长速率之间的关系拟合。

表 2 Belehradek方程拟合大西洋鲑贮藏过程中微生物生长参数Table 2 Parameters for microbial growth on Atlantic salmon during storage fitted to Belehradek equation
从表2可以看出,Belehradek方程拟合不同温度下大西洋鲑贮藏过程中的菌落总数、假单胞菌、希瓦氏菌生长参数的结果较好,具体方程分别见式(5)~(7),决定系数R2均大于0.9。

2.3 大西洋鲑贮藏过程中微生物生长预测模型的验证结果

表 3 大西洋鲑贮藏过程中微生物生长预测模型验证Table 3 Verification of microbial growth prediction model for Atlantic salmon during storage
为贴近实际应用,以GB 10136—2015中规定的生食制的动物性水产制品的菌落总数最高限量附近测定结果进行验证,比较预测值与实测值,计算相对误差[27-28]。验证温度除4、10、25 ℃外,还加入了在模型建立过程中未使用的15 ℃,以验证模型在未知温度下预测结果的准确性。验证结果如表3所示,菌落总数在不同温度下的预测值与实测值之间相对误差较小,均在10%以内,表明该预测模型能够较好地预判大西洋鲑在物流及贮运过程中微生物的生长情况[29]。假单胞菌和希瓦氏菌数预测值和实际值之间的相对误差在20%以内,略高于菌落总数,推测原因为不同贮藏温度对假单胞菌和希瓦氏菌生长的影响较大[30],而菌落总数为大量微生物累积结果,受温度影响较小。
2.4 大西洋鲑贮藏过程中微生物生长预测系统建立
三级模型基本上是微生物生长预测模型的最终形式,是一个或多个一级、二级模型整合而成的应用程序,模型最终会并入计算机软件的功能当中,使得用户无需了解建模技术或基础的一级和二级模型,从而使其成为一种在食品工业和研究中更容易获取和使用的工具[15]。本研究选用Visual Basic软件作为大西洋鲑贮藏过程中微生物生长预测软件的程序编写工具,设定软件基本界面及算法后生成应用程序,方便使用。

图 4 大西洋鲑贮藏过程中微生物生长预测软件使用界面Fig. 4 Operation interface of the microbial growth prediction software
软件使用的界面如图4所示,设定可预测微生物种类为“菌落总数”、“假单胞菌”和“希瓦氏菌”,可在combo下拉框中选择想要预测的微生物种类,填写贮藏温度/℃、贮藏时间/h及初始微生物数量/(CFU/g)后,单击“当前微生物数量及生长趋势”,即可在图4中右方看到该贮藏温度下微生物的生长曲线。曲线中红色圈出点为该贮藏时间点微生物数量(目标预测点),且数值会出现在文本框中,不仅帮助用户得知微生物数量,也通过生长曲线的呈现方便用户整体感知该贮藏温度下微生物的生长情况,完成对未来生长态势的预判,以采取相应的措施。该软件程序部分已完成计算机软件著作权登记。
3 结 论
对4、10、25 ℃贮藏过程中大西洋鲑的菌落总数、假单胞菌数量及希瓦氏菌数量进行测定,利用修正的Gompertz模型和Baranyi and Roberts模型进行变化趋势的非线性拟合,发现Baranyi and Roberts模型拟合准确度较高且符合实际情况,有利于二级模型的搭建,因此选择Baranyi and Roberts模型作为反映恒温贮藏过程中微生物数量与时间关系的模型,不同温度下3 类微生物的拟合结果的R2达到0.9以上。
为了预测不同贮藏温度下微生物的生长情况,利用Belehradek方程(平方根模型)进行大西洋鲑贮藏温度与微生物生长延滞时间、最大比生长速率之间的关系拟合,获得了大西洋鲑贮藏温度与微生物生长参数之间的计算公式,从而完成对4~25 ℃区间内不同贮藏温度下3 类微生物的生长预测。
通过Visual Basic软件编写大西洋鲑贮藏过程中微生物生长预测程序,将Baranyi and Roberts模型和Belehradek方程拟合所得的参数带入相应公式,获得了不同贮藏温度下大西洋鲑中3 类微生物的生长模型,用Visual Basic语言进行编写、生成程序,可以达到用户输入基本贮藏条件后即可获得微生物数量及生长曲线的目标。
