磁性Fe3O4/壳聚糖复合微球的制备及其对苹果汁有机酸的吸附
2020-05-25姜飞虹雷欢庆任婷婷孟掉琴岳田利
姜飞虹,雷欢庆,任婷婷,孟掉琴,岳田利,*
(1.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;2.农业农村部农产品质量安全风险评估实验室(杨凌),陕西 杨凌 712100;3.国家杨凌农业综合试验工程技术研究中心,陕西 杨凌 712100)
中国是苹果生产大国,2017年我国苹果种植面积250.96万 hm2,产量4 548.40万 t,均居世界首位[1]。苹果汁是有机酸的天然来源之一,有机酸含量丰富[2-4],特别是L-苹果酸含量最高[5],有机酸具有改善记忆[6]、抗氧化、抗疲劳、促进药物吸收[7]等众多功能。因此可以利用丰富的苹果资源来提取天然有机酸。传统的有机酸提取方法一般为钙盐沉淀法[8]与有机溶剂萃取法[9-10],这两种方法均引入外加试剂,后续处理复杂,有机酸回收成本高。近年来有学者利用离子交换树脂[11-13]、壳聚糖[14-16]等材料来吸附分离溶液中的有机酸,取得一定的进展。目前关于苹果汁有机酸吸附分离的报道较少,仅有学者利用树脂型吸附剂来吸附分离苹果汁中的有机酸[11-12]。但树脂型吸附剂对有机酸的吸附量以及吸附选择性不高、吸附剂回收以及重生困难、操作繁琐。壳聚糖是一种天然可降解的碱性多糖,价廉易得、无毒无害、生物相容性好,在水处理[17-18]、固定化酶[19]、多酚吸附[20]、重金属吸附[21]、药物载体[22-23]等方面都有广泛的应用。壳聚糖富含氨基,可以用来吸附有机酸[14]。但是壳聚糖在酸性溶液中易流失,且与溶液分离困难,难以直接利用。因此考虑将壳聚糖与磁性材料相结合,通过反相悬浮交联法制成磁性壳聚糖复合微球,使之既可以利用壳聚糖层的氨基基团发挥吸附作用,又能兼具良好的磁响应性能,磁性壳聚糖复合微球具有操作简便、分离快速、分离效率高等众多优点,可以弥补一般传统分离方法的不足。本实验旨在制备一种磁响应强的磁性Fe3O4/壳聚糖复合微球,用于吸附分离苹果汁中的有机酸,并且微球洗脱之后可以反复使用,为建立一种新型环保的有机酸吸附分离方法提供理论依据与技术支持。
1 材料与方法
1.1 材料与试剂
70 °Brix浓缩苹果汁购自陕西省海升果业有限公司。壳聚糖(脱乙酰度90%以上)购自西安沃尔森生物技术有限公司。
六水合氯化铁(FeCl3·6H2O)、四水合硫酸亚铁(FeSO4·4H2O)、冰乙酸(体积分数99.7%)、质量分数5%~28%的氨水、体积分数25%的戊二醛溶液、体积分数33%的浓盐酸、氢氧化钠、六偏磷酸钠等均为国产分析纯;液体石蜡、失水山梨醇脂肪酸酯(Span80)、石油醚(沸程60~90 ℃)、丙酮等均为国产化学纯。
1.2 仪器与设备
GS2B-B电子恒温搅拌器 上海安亭电子仪器厂;HH-6恒温水浴器 上海福玛实验设备有限公司;KO-600DB型数控超声波清洗器 昆山市超声波仪器有限公司;JEM1230透射电子显微镜 日本JEOL公司;JSM-6360LV扫描电子显微镜 日本电子公司;D8 ADVANCE X射线衍射仪(X-ray diffractometer,XRD)、傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪 德国Bruker公司;TA-60WS+DTG-60A差热热重同步分析仪 日本岛津公司;MPMS-XL-7超导量子干涉磁测量系统 美国Quantum Design公司;iMark Microplate Reader 美国Bio-Rad公司。
1.3 方法
1.3.1 Fe3O4纳米颗粒的制备
利用化学共沉淀法[24-25]制备Fe3O4纳米颗粒,其反应方程式如式(1)所示。

将0.05 mol/L FeSO4与0.1 mol/L FeCl3的混合溶液,在氮气保护下搅拌,用氨水调节pH值至10[26]。80 ℃水浴熟化30 min,冷却至室温后,用磁铁收集,并用蒸馏水洗涤至中性备用。
1.3.2 磁性Fe3O4/壳聚糖复合微球的制备
取质量分数4%的壳聚糖醋酸溶液置于烧杯中,将制备好的Fe3O4纳米颗粒与壳聚糖按质量比3∶4混合均匀后,缓缓加入到均匀的油相(40 mL Span 80、300 mL液体石蜡、300 mL石油醚)中。于室温下1 200 r/min搅拌30 min,加入10 mL体积分数6.25%戊二醛,反应1 h,再次加入10 mL 体积分数6.25%戊二醛继续反应2 h。产物依次用石油醚、丙酮、0.1 mol/L NaOH溶液、去离子水洗涤至中性,真空冷冻干燥备用[27]。
1.3.3 磁性Fe3O4/壳聚糖复合微球的表征
将制备好的Fe3O4磁流体稀释后,滴加到铜网上,室温自然晾干,然后用透射电子显微镜观察颗粒的形态与粒径。将干燥后的磁性Fe3O4/壳聚糖复合微球用导电胶固定后溅金,喷金条件为:40 mA、80 s,利用扫描电子显微镜对微球的形貌进行表征;将干燥后的微球用蒸馏水溶解,加入数滴质量分数0.3%的六偏磷酸钠助分散剂,在350 W条件下超声10 min,利用激光粒度仪在淀粉模式下对磁性Fe3O4/壳聚糖复合微球的粒径与分布进行测定;利用具有Cu Kα放射源(λ=0.154 nm)的XRD测定Fe3O4纳米颗粒、磁性Fe3O4/壳聚糖复合微球的晶体结构;在室温环境下,采用KBr压片处理,对Fe3O4纳米颗粒、壳聚糖、磁性Fe3O4/壳聚糖复合微球进行FTIR测定,分辨率4 cm-1、扫描次数32 次、扫描范围400~4 000 cm-1;利用热重分析仪对磁性Fe3O4/壳聚糖复合微球中Fe3O4的含量进行测定,分别取Fe3O4纳米颗粒、壳聚糖、磁性Fe3O4/壳聚糖复合微球3 种样品,在气流流速50 mL/min的氮气环境下,将样品从25 ℃以10 ℃/min的升温速率加热至800 ℃;利用超导量子干涉磁测量系统对壳聚糖包埋前后的Fe3O4纳米颗粒进行磁滞回线的测定分析,测量环境条件为室温,磁场强度的变化范围为±20 000 Oe。
1.3.4 磁性Fe3O4/壳聚糖复合微球的可回收性评价
磁性Fe3O4/壳聚糖复合微球的可回收程度决定了所制备的微球今后的应用领域及应用前景。在室温条件下,将Fe3O4纳米颗粒和磁性Fe3O4/壳聚糖复合微球置于1 T磁场下,对其在不同时间及不同pH值条件下的可回收程度进行评价。用去离子水(pH 7)配制不同质量浓度的Fe3O4纳米颗粒及磁性Fe3O4/壳聚糖复合微球,研究在同一磁场不同作用时间下两种颗粒的回收率,其中磁场作用时间范围为10 s~5 min。同时,为了更好地了解不同pH值环境对Fe3O4纳米颗粒和磁性Fe3O4/壳聚糖复合微球可回收程度的影响,将两种颗粒加入到不同pH值的溶液中,磁场作用10 s分别测定其回收率。回收率计算公式见式(2)。
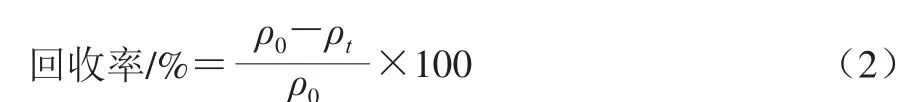
式中:ρ0为磁性材料的初始质量浓度/(mg/mL);ρt为t时刻磁性材料质量浓度/(mg/mL)。
Fe3O4质量浓度的测定采用分光光度法[28-29],取样100 mL于96 孔板中,加入30 mL浓盐酸溶液,60 ℃保温箱中充分消化2 h至颜色澄清透亮。再加入10 mL 1.5 mg/mL的过硫酸钾溶液使溶液中的Fe2+被氧化为Fe3+。最后加入60 mL 0.1 mol/L的硫氰酸钾溶液至上述溶液中,与Fe3+生成血红色的硫氰酸铁离子[Fe(SCN)n]3-n(n=1~6)络合物,静置反应10 min。利用iMark Microplate Reader在490 nm波长处检测吸光度。通过已知浓度的FeCl3·6H2O溶液建立铁离子在相同条件下的标准曲线。
1.3.5 磁性Fe3O4/壳聚糖复合微球吸附苹果汁有机酸的重复利用评价
精确称取0.500 0 g磁性Fe3O4/壳聚糖复合微球,加入30 mL一定浓度(有机酸质量浓度为2.32 mg/mL)的苹果汁,25 ℃、150 r/min条件下振荡吸附不同时间,磁分离后,对不同吸附时间样品的质量浓度进行测定,并计算吸附量。吸附后的微球用蒸馏水洗涤4 次后,置于质量分数4%的氨水中振荡不同时间,磁分离,对洗脱液进行真空旋蒸,计算不同解吸时间下的解吸量。此过程重复3 次,考察磁性Fe3O4/壳聚糖复合微球吸附苹果汁有机酸的重复利用情况。吸附量、解吸量以及有机酸回收率分别按公式(3)~(5)计算。

式中:V为样品体积/mL;ρ0为苹果汁的初始有机酸质量浓度/(mg/mL);ρt为t时刻苹果汁中的有机酸质量浓度/(mg/mL);m为磁性Fe3O4/壳聚糖复合微球的加入质量/g。

式中:V为解吸液体积/mL;ρt为t时刻解吸液中有机酸质量浓度/(mg/mL);m为磁性Fe3O4/壳聚糖复合微球的加入质量/g。

1.4 数据处理与分析
采用SPSS Statistics 21统计分析软件进行方差分析(analysis of variance,ANOVA),邓肯氏多重域检验确定数据间的差异,显著水平设为P<0.05,每个样品重复测定3 次,取其平均值。采用Origin 9.0软件进行相关图表的绘制。
2 结果与分析
2.1 形貌与粒径分布


图 1 磁性Fe3O4的透射电子显微镜照片(a)及粒径统计分布(b)Fig. 1 Transmission electron micrograph (a) and particle size distribution (b) of pure Fe3O4 nanoparticles

图 2 磁性Fe3O4/壳聚糖复合微球的扫描电子显微镜照片(a)和激光粒度仪粒径分布(b)Fig. 2 Scanning electron microscopic image (a) and malvern size distribution diagram (b) of magnetic Fe3O4/chitosan microspheres
壳聚糖分子链上含有大量的自由氨基,这些氨基可以通过戊二醛交联剂的两个醛基互相交联,最终包裹Fe3O4纳米颗粒形成磁性壳聚糖微球。在壳聚糖层交联和硬化的过程中,自由水被挤压出微球,同时壳聚糖层的交联度也随之增加。图1是磁性Fe3O4纳米颗粒的透射电子显微镜照片和粒径频率统计分布图。从图1b中可以看出,磁性Fe3O4纳米颗粒的粒径分布范围为8~19 nm,小于室温条件下磁性Fe3O4纳米粒子具有超顺磁性的临界尺寸;同时由图1a的透射电子显微镜照片可以看出磁性Fe3O4纳米颗粒的分散性较差,存在明显的物理聚集现象。产生这种现象的原因,一方面与磁性Fe3O4纳米颗粒之间磁力的相互作用有关;另一方面,颗粒本身非常小的纳米粒径以及较高的比表面能也会引起Fe3O4纳米颗粒产生非常明显的物理聚集[30]。由图2a扫描电子显微镜照片可以看出,制备的复合微球为微米级,呈现规则球形,分散性较好,表面光滑或有核桃状褶皱。因为磁性Fe3O4/壳聚糖微球采用真空冷冻干燥,大部分颗粒在干燥后能保持较完整的原始表面形态,但仍有小部分微球因为冷冻不到位,导致在干燥过程中迅速失水而皱缩,产生核桃状褶皱。由图2b可知,复合微球激光粒度仪粒径主要分布在22~158 µm,d(0.1)为36.765 µm,即有10%的微球粒径小于36.765 µm;d(0.5)为72.987 µm,为微球的中值粒径,即50%的微球粒径小于或者大于72.987 µm;d(0.9)为124.786 µm,即90%的微球粒径小于124.786 µm。结果表明实验制备的磁性Fe3O4/壳聚糖复合微球为微米级,分散状态良好,基本服从正态分布,且分布带较窄,可以最大程度保证不同批次反应的同质性。
2.2 XRD衍射分析结果
为了确认所制备的Fe3O4纳米颗粒以及磁性Fe3O4/壳聚糖复合微球中包含的Fe3O4纳米颗粒是否为纯Fe3O4,对两种样品分别进行了XRD分析。由图3可知,Fe3O4纳米颗粒和磁性Fe3O4/壳聚糖复合微球的XRD图谱在衍射角30.373°、35.742°、43.325°、53.983°、57.338°、62.911°等处分别出现衍射峰,分别对应Fe3O4220、311、400、422、511、440等晶面方向的衍射,与国际衍射数据中心提供的Fe3O4标准卡(PDF No. 65-3107)中的XRD图谱的特征峰吻合,由此可确认磁性Fe3O4/壳聚糖复合微球中包埋的Fe3O4纳米颗粒是具有反相尖晶石型结构的纯Fe3O4
[31]。而Fe3O4纳米颗粒与磁性Fe3O4/壳聚糖复合微球的XRD图谱分析结果具有一致性,表明在磁性Fe3O4/壳聚糖复合微球的制备过程中,壳聚糖对Fe3O4纳米颗粒的包埋过程不会造成Fe3O4晶体结构的改变。

图 3 Fe3O4纳米颗粒和磁性Fe3O4/壳聚糖复合微球XRD图谱Fig. 3 XRD patterns of naked Fe3O4 nanoparticles and magnetic Fe3O4/chitosan composite microspheres
根据Fe3O4纳米颗粒的XRD图谱,利用Debye-Scherrer公式[31](式(6)),可推算Fe3O4纳米颗粒的粒径。

式中:D为Fe3O4纳米颗粒垂直于各晶面方向上晶粒的厚度/nm;K为Debye-Scherrer常数;λ为入射波长/nm;β为半峰宽/rad;θ为布拉格角/(°)。
根据公式可以计算出各个晶面衍射方向对应的厚度分别为9.1 nm(220)、8.1 nm(311)、8.8 nm(400)、8.3 nm(422)、11.6 nm(511)、9.1 nm(440),求得Fe3O4纳米颗粒的平均粒径为9.1 nm,其粒径小于室温条件下超顺磁的临界粒径,因此可以证明Fe3O4纳米颗粒具有超顺磁性。
2.3 FTIR分析结果

图 4 Fe3O4纳米颗粒、壳聚糖和磁性Fe3O4/壳聚糖复合微球的FTIR分析图谱Fig. 4 FTIR spectra of Fe3O4, chitosan and magnetic Fe3O4/chitosan composite microspheres
为了确认壳聚糖已经包埋在Fe3O4纳米颗粒的表面,形成了磁性Fe3O4/壳聚糖复合微球,对Fe3O4纳米颗粒、壳聚糖和磁性Fe3O4/壳聚糖复合微球进行了FTIR分析,结果如图4所示。Fe3O4纳米颗粒FTIR图谱显示586 cm-1处存在一个强烈的伸展吸收峰,这个特征吸收峰是Fe3O4纳米颗粒所特有的Fe-O-Fe基团。壳聚糖FTIR图谱显示在1 651 cm-1和1 599 cm-1处出现特征吸收峰,分别对应酰胺I带峰C=O的伸缩振动和酰胺II带峰N—H面内弯曲振动[32];此外,1 381 cm-1附近是CH3的C—H的变形振动吸收峰,这是壳聚糖没有完全脱乙酰所致。1 076 cm-1处对应的是壳聚糖主链仲羟基C—O的伸缩振动吸收峰[33]。由磁性Fe3O4/壳聚糖复合微球的FTIR光谱结果可知,Fe-O-Fe基团的特征吸收峰偏移到了582 cm-1处,在1 638 cm-1处对应的是戊二醛与壳聚糖发生反应形成Schiff碱的特征吸收峰[32,34],结果表明Fe3O4纳米颗粒成功地被交联壳聚糖层包埋形成了磁性Fe3O4/壳聚糖复合微球。
2.4 热重分析结果
为了能够确定Fe3O4/壳聚糖复合微球中Fe3O4、壳聚糖的质量,利用热重分析仪对Fe3O4纳米颗粒、壳聚糖、磁性Fe3O4/壳聚糖复合微球进行热重分析,结果如图5所示。整个升温过程中Fe3O4纳米颗粒质量损失不明显,由物理水分蒸发造成的损失率仅为2.12%[35]。由图5曲线b、c可以看出,在温度升高至100 ℃时,壳聚糖粉末和磁性Fe3O4/壳聚糖复合微球分别有5.34%和4.03%的质量损失,这些损失是样品中物理水分的移除所造成的。磁性Fe3O4/壳聚糖复合微球比壳聚糖裂解时间早,分别在200 ℃和260 ℃进入快速裂解过程,这可能是因为微球壳聚糖层经过戊二醛交联形成的Schiff碱比壳聚糖粉末的主链更容易发生断裂,使得复合微球热稳定性下降,这种现象与张海真[36]的研究结果一致。
此外,壳聚糖粉末在温度从260 ℃升高至400 ℃的过程中,热分解持续快速进行,质量损失45.52%。400 ℃以后,降解速率逐渐放缓,此时样品的质量损失可能是残留壳聚糖或壳聚糖降解中间化合物的缓慢降解引起的。而磁性Fe3O4/壳聚糖复合微球的降解过程从200 ℃一直持续到700 ℃,此过程质量损失率达到51.45%。通过计算样品800 ℃时的质量损失率,可以得知Fe3O4约占磁性Fe3O4/壳聚糖复合微球总质量的38.66%,这与化学计算方法[36]得出的结果基本一致。

图 5 Fe3O4纳米颗粒、壳聚糖和磁性Fe3O4/壳聚糖复合微球的热重分析曲线Fig. 5 Thermogravimetric curves of naked Fe3O4, chitosan and Fe3O4/chitosan composite microspheres
2.5 磁滞回线分析结果

图 6 Fe3O4纳米颗粒和磁性Fe3O4/壳聚糖复合微球的磁滞回线Fig. 6 Hysteresis loops of naked Fe3O4 and magnetic Fe3O4/chitosan composite microspheres
图6为Fe3O4纳米颗粒和磁性Fe3O4/壳聚糖复合微球的磁滞回线,Fe3O4纳米颗粒与磁性Fe3O4/壳聚糖复合微球的磁滞回线基本通过原点,没有磁滞现象,没有发现剩余磁化强度和矫顽力,表明制备的Fe3O4纳米颗粒在室温下是超顺磁的,被壳聚糖包埋后也没有改变其超顺磁性质[19,32,37]。Fe3O4纳米颗粒和磁性Fe3O4/壳聚糖复合微球的饱和磁化强度分别为78.16 emu/g和35.98 emu/g。复合微球较Fe3O4纳米颗粒的饱和磁化强度有所下降,这是两种样品相同质量下Fe3O4磁性物质的含量不同[32]造成的。根据热重分析的结果,Fe3O4约占磁性Fe3O4/壳聚糖复合微球总质量的38.66%,换算成相同质量的Fe3O4时,磁性Fe3O4/壳聚糖复合微球的饱和磁化强度约为93.07 emu/g,反而高于相同质量的Fe3O4纳米颗粒。这是因为Fe3O4纳米颗粒在空气中会部分氧化成Fe2O3,导致磁性下降;而经过壳聚糖的包埋后,磁性Fe3O4/壳聚糖复合微球中的Fe3O4纳米颗粒不容易被氧化,反而会具有比较高的饱和磁化强度。
2.6 回收率分析结果
磁性Fe3O4/壳聚糖复合微球的磁分离在实际应用中是非常重要的环节,直接决定了所制备材料的可回收性能。实验中对Fe3O4纳米颗粒以及磁性Fe3O4/壳聚糖复合微球在实际外加磁场(1 T)下不同回收时间和不同pH值的回收率进行了测定。图7是中性条件(pH 7.0)下,回收时间对Fe3O4纳米颗粒和磁性Fe3O4/壳聚糖复合微球回收率的影响。可以看到相同质量浓度、相同时间下,磁性Fe3O4/壳聚糖复合微球比Fe3O4纳米颗粒更容易回收,这是因为如果换算成相同质量的Fe3O4,磁性Fe3O4/壳聚糖复合微球的饱和磁化强度要高于Fe3O4纳米颗粒;同时微球中包埋的磁性纳米颗粒很多,表现出的磁响应特性是所有Fe3O4纳米颗粒的总和,所以磁性Fe3O4/壳聚糖复合微球表现出的磁响应性更强,回收率更高。质量浓度为5 mg/mL的Fe3O4纳米颗粒在5 min时可以达到99.99%的回收率,而3 mg/mL与1 mg/mL的Fe3O4纳米颗粒在5 min时分别可以达到99.98%和99.96%的回收率。磁性Fe3O4纳米颗粒高质量浓度比低质量浓度回收率高,是因为磁性Fe3O4纳米颗粒在溶液中极易团聚,质量浓度越高,团聚越明显,经过团聚的磁性Fe3O4颗粒,其磁化强度要高于单一的Fe3O4纳米颗粒;因此在磁场作用下,回收速率更快,回收率更高。不同质量浓度的磁性Fe3O4/壳聚糖复合微球磁场作用10 s的回收率均可达到99.9%以上,随着回收时间的延长,其回收率也随之增加,2 min以后回收率基本可达到100%(比色法无法检测到残留),且随着回收时间的延长,回收率不再发生明显变化。
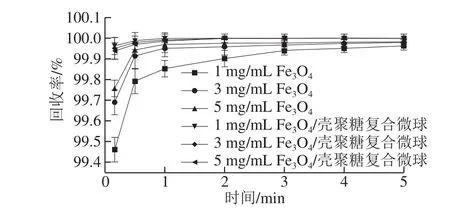
图 7 回收时间对Fe3O4纳米颗粒和磁性Fe3O4/壳聚糖复合微球回收率的影响Fig. 7 Effect of recovery time on recovery rate of naked Fe3O4 and magnetic Fe3O4/chitosan microspheres
图8是不同pH值对Fe3O4纳米颗粒和磁性Fe3O4/壳聚糖复合微球回收率的影响(质量浓度均为5 mg/mL,回收时间10 s),可以看到,在不同pH值下,磁性Fe3O4/壳聚糖复合微球的回收率均高于Fe3O4纳米颗粒,且受pH值影响不明显。当pH值低于8时,Fe3O4纳米颗粒的回收率随着pH值的增加而显著增大(P<0.05);pH值高于8时,随着pH值的增加,回收率又显著减小(P<0.05)。产生这种结果的原因可能与Fe3O4纳米颗粒在不同pH值下携带的表面电荷量不同有关[38]。在中性条件下,Fe3O4纳米颗粒的表面电位接近于零,而在酸性或者碱性环境下会分别带正电荷与负电荷,这些电荷间的相互作用可能会抵消一部分磁场作用,使得酸性或者碱性环境下Fe3O4纳米颗粒的回收率相较中性环境低。磁性Fe3O4/壳聚糖复合微球在pH 3~11范围内回收率没有显著性差异(P>0.05),10 s时的回收率均达到99.9%以上;pH值为2时显著低于其他pH值下的回收率(P<0.05)。这可能是由于极端pH值下,壳聚糖上的氨基基团在酸性溶液中易于阳离子化而存在Fe3O4纳米颗粒的增溶现象[37]。可回收程度评价结果表明,磁性Fe3O4/壳聚糖复合微球的回收率因回收时间不同而存在差异,同时由于表面壳聚糖层的存在,大幅减小了pH值对微球回收率的影响,扩大了磁性Fe3O4/壳聚糖复合微球的应用范围。良好的磁响应特性和足够高的可回收程度保证了实验中制备的磁性Fe3O4/壳聚糖复合微球在水环境(或苹果汁)分离系统中具有切实可行的应用前景。
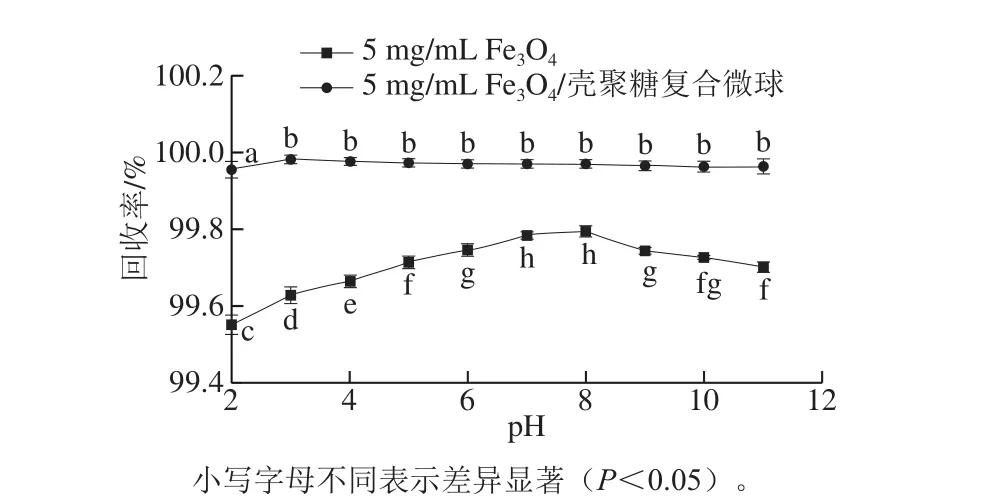
图 8 pH值对Fe3O4纳米颗粒和磁性Fe3O4/壳聚糖复合微球回收率的影响Fig. 8 Effect of pH on recovery rate of naked Fe3O4 and Fe3O4/chitosancomposite microspheres
2.7 磁性Fe3O4/壳聚糖复合微球吸附苹果汁中有机酸的可重复性评价结果

图 9 磁性Fe3O4/壳聚糖复合微球对苹果汁有机酸的吸附与解吸评价Fig. 9 Adsorption and desorption of organic acids from apple juice using magnetic Fe3O4/chitosan microspheres
图9为磁性Fe3O4/壳聚糖复合微球吸附苹果汁中有机酸的可重复性评价结果。苹果汁初始有机酸质量浓度为2.32 mg/mL,微球加入量0.5 g,吸附与解吸温度均在25 ℃下进行。有机酸的解吸过程是在4%氨水溶液中完成的。
磁性Fe3O4/壳聚糖复合微球吸附苹果汁有机酸的具体反应原理为微球表面壳聚糖层所携带的氨基与有机酸电离出的氢离子形成质子化胺,质子化胺带正电,有机酸电离的羧酸根带负电,由于正负电的互相吸引而产生吸附作用[14]。加入碱性溶液后,微球表面的氨基基团将产生去质子化,引起微球表面壳聚糖层与有机酸分子之间的静电作用变弱,从而使有机酸分子从微球上解吸下来[39],这样达到饱和吸附的磁性壳聚糖复合微球就可以再生而反复利用。基于此反应原理,使得磁性Fe3O4/壳聚糖复合微球具有一定的吸附选择性,在复杂的苹果汁基质中,只会选择吸附能够解离出氢离子与羧酸根离子的有机酸,而对苹果汁中存在的葡萄糖、果糖等其他物质很难产生吸附作用。式(7)、(8)为磁性Fe3O4/壳聚糖复合微球表面壳聚糖层吸附与解吸苹果汁中有机酸的原理方程式。

式中:HA代表吸附质;MCMs-NH2代表吸附剂。
从图9可以看出,整个过程包括3 个周期。每个周期分别包括一个90 min的吸附过程和一个20 min的解吸过程。对第一个周期,在吸附的初始阶段,磁性Fe3O4/壳聚糖复合微球对苹果汁中有机酸的吸附量随着时间的延长而增大,在70 min时吸附基本达到平衡状态,随着时间的延长,吸附量不再发生显著性变化(P>0.05),最终平衡吸附量达到了111.54 mg/g;吸附结束后,进入解吸过程,用4%的氨水溶液对吸附完毕的磁性Fe3O4/壳聚糖复合微球进行解吸,测得解吸时间不同,有机酸回收量也不同。前15 min内,有机酸回收量随着解吸时间的延长而显著增大(P<0.05),15~20 min有机酸回收量略有下降,但并没有产生显著性差异(P>0.05)。由此可知解吸时间并不是越长越好,解吸15 min,回收得到的有机酸含量为97.00 mg/g,有机酸回收率为86.97%。解吸液中的有机酸并不能被完全回收,一方面是因为旋转蒸发过程中会造成部分挥发性酸的损失;另一方面是实验条件下氨气并不能100%从解吸液中完全蒸出,会有微量残留,中和一部分有机酸,使有机酸回收结果偏低。利用再生后的磁性Fe3O4/壳聚糖复合微球对苹果汁中有机酸进行第二次吸附与解吸过程,吸附量与回收率会有微弱下降,但并没有产生显著性差异(P>0.05)。第3次吸附与解吸过程中有机酸吸附量与回收率分别为109.92 mg/g、86.86%,有机酸吸附量较第一次吸附显著下降(P<0.05),但回收率却没有产生显著性变化(P>0.05)。第3次吸附量明显减少是因为每次解吸并不能做到100%释放出所有的吸附位点,所有的吸附与解吸过程都存在动态平衡;解吸不彻底,导致仍有少量吸附位点被占用,重复利用次数越多,累积占用的位点就越多,会导致有机酸吸附量慢慢降低,但这种变化是缓慢的,第3次吸附过程也只是降低到首次吸附量的98.55%。因此对磁性Fe3O4/壳聚糖复合微球吸附苹果汁有机酸的可重复性评价结果可知,所制备的磁性微球可以完全满足进一步的再生和重复利用要求。相较于传统的有机酸提取分离方法,磁性Fe3O4/壳聚糖复合微球在吸附苹果汁有机酸时,不必额外引入外加试剂,在磁场作用下可以快速实现固液分离,不会对被分离物造成破坏。并且解吸之后可以循环多次利用,最大程度地简化操作工艺,节约生产成本。
3 讨 论
苹果汁中含有苹果酸、草酸、柠檬酸、乳酸等多种有机酸[4],每一种有机酸均可以电离生成H+,与磁性Fe3O4/壳聚糖复合微球上的氨基结合形成质子化胺,质子化胺带正电,羧酸根带负电,由于正负电荷的互相吸引而产生吸附作用,因此磁性Fe3O4/壳聚糖复合微球不能选择性吸附某一种单一成分的有机酸,只能吸附总有机酸。解吸后得到的有机酸是所有组分的混合物,如果想要得到单一组分的有机酸还需要经过分离纯化等后续处理,操作过程复杂繁琐。因此后续研究可以考虑在磁性Fe3O4/壳聚糖复合微球的基础上,采用分子印迹技术直接对单一组分的有机酸进行吸附分离。有研究者合成了基于磁性壳聚糖微球的分子印迹聚合物,能够选择性识别与快速分离氯霉素靶分子[40],杜春燕等[41]利用磁性分子印迹材料来分离富集水中的双酚A。因此,可以将磁性壳聚糖微球作为支撑载体结合表面分子印迹技术来分离苹果汁中的L-苹果酸、柠檬酸等单一有机酸,同时也可以将其应用范围进一步扩大到其他单一天然产物的分离提取中。
4 结 论
利用反相悬浮交联法制备磁性Fe3O4/壳聚糖复合微球,所得微球呈规则球形,粒径为22~158 µm,饱和磁化强度35.98 emu/g,具有超顺磁性,Fe3O4质量约占微球质量的38.66%,壳聚糖包埋过程并未改变其晶体结构。磁性Fe3O4/壳聚糖复合微球在特定磁场下的回收率受pH值的影响较Fe3O4纳米颗粒小,磁场作用10 s就可以达到99.90%以上的回收率,且随着回收时间的延长,回收率会继续增大,2 min后回收率基本趋向于100%。磁性Fe3O4/壳聚糖复合微球对苹果汁有机酸的吸附量随着吸附时间的延长而增大,70 min达到吸附平衡,平衡吸附量为111.54 mg/g;15 min解吸完全,有机酸回收率86.97%。反复使用3 次后,磁性Fe3O4/壳聚糖复合微球对有机酸的回收率并未显著下降。
