哀牢山森林环境对铁载体子囊菌分布的影响
2020-05-25梁宇鹏赵江源杨佩文文孟良李铭刚
梁宇鹏,赵江源,杨佩文,何 翔,文孟良,李铭刚
(1.云南大学云南省微生物研究所,云南 昆明650091;2.云南省农业科学院农业环境资源研究所,云南 昆明 650205)
铁是地球绝大多数生命形式主要甚至必需的营养元素,参与了微生物包括三羧酸循环及核酸生物合成等重要生理过程[1-2]。微生物通过铁载体化合物来摄取环境中的铁,并由此带来多元化的生态效应。已有研究发现,特定结构类型的铁载体可促进环境样本中特定类群微生物的生长[2-5],微生物行为学研究进一步揭示了微生物还可通过铁载体为介导,在群体间产生竞争、互利、合作或其它相互适应性行为[6-7],对土壤微生物群落结构产生影响,并进一步影响到土壤的生态功能。土壤微生物铁载体化学多样性、分布规律和土壤矿物质营养作用研究表明[8-9],微生物铁载体是土壤根际微生物生长代谢的重要影响因素[10]。这些产铁载体微生物可对植物矿物质营养的吸收代谢做出重要贡献[11],甚至有人提出可以应用微生物铁载体来行使化肥的功能[12]。总之,微生物铁载体在矿物质元素释放和生物地质循环过程中发挥了不可替代的作用[13-14]。铁载体化合物及其产生菌在环境修复和农业生产领域具有广阔的应用前景。
微生物群落功能是连接微生物多样性与相应生态系统的重要桥梁。对功能微生物群落结构进行解析,可以回答“谁,做了什么?”这一微生物生态领域问题。扩增子高通量测序可以解答环境有“谁”存在的问题,宏基因组学可以解答“做了什么”的问题,但要对微生物多样性的特定功能进行辨识,这些方法可提供的信息还不够[15]。因此,需要建立更多以功能为导向的微生物群落研究方法。本研究以云南省哀牢山国家级自然保护区低海拔河谷森林和高海拔原始森林土壤样本为研究材料,采用纯培养筛选、分离土壤中的产铁载体微生物,结合高通量扩增子测序,对环境样本中的功能性可操作分类单元(operational taxonomic units, OTU)进行定位,考察功能类群与采样环境之间的关系,分析其内在原因,研究结果可为铁载体真核微生物资源定向发掘和群落功能结构研究工作提供参考数据和方法借鉴。
1 材料与方法
1.1 土样采集
2017年12月,在云南省哀牢山国家级自然保护区(东经100°49′~101°53′,北纬23°95′~24°17′)内,从低海拔河谷灌木林及次生林区域到高海拔原始森林区域进行采样,共81个样地,采样海拔500~2 600 m。在不同植被带设置坡度、坡向相近的5个20 m×20 m的样地(取样时记录采样环境地貌及经纬度信息),每个样地用直径2 cm的土壤取样器以“十”字型分别采集5钻同一深度土层样品(采样深度为10 cm),混合为1个土样后用无菌自封袋装好并编号。
1.2 培养基配制
上层培养基为无铁察氏培养基,其配方为蔗糖30 g,NaNO33 g,K2HPO4·3H2O 1.0 g,KCl 0.5 g,MgSO4·7H2O 0.5 g,琼脂15~20 g,去离子水1 000 mL。
铬天青S(chrome azurol S,CAS)检测液:称取CAS 60.5 mg,溶解于50 mL去离子水中,加入10 mL Fe3+溶液(1 mmol·L-1FeCl3·6H2O,10 mmol·L-1HCl),搅拌混匀,记为A液;称取72.9 mg十六氨基烷基溴化铵溶解于40 mL去离子水中,加热使其充分溶解,记为B液;将A液与B液缓慢混合摇匀。
CAS下层琼脂显色检测培养基配制:当水琼脂培养基灭菌后温度下降到60 ℃时,按250∶15比例添加CAS检测液(0.22 μm滤膜过滤),充分混匀,并趁热倒入无菌平皿中,凝固后制备成下层平板备用(呈蓝色)。当上层培养基灭菌后温度下降到60 ℃时,倒至已制备好的下层平板上,凝固后制备成双层平板备用。
1.3 产铁载体功能菌株筛选、分离与鉴定
1.3.1 菌株筛选和分离 将土样稀释涂布双层平板,28~32 ℃下倒置培养5~7 d。铁载体因螯合CAS-Fe3+-CTAB复合物中的Fe3+,使复合物解体而使CAS双层平板显现出CAS原有的红色[16],因此,可根据双层平板显色圈的颜色和大小来判断菌株的产铁载体的能力。
1.3.2 活性菌株的分子鉴定 活性菌株进行内转录间隔区(internal transcribed spacer, ITS)序列测序(测序范围:ITS1~ITS4)。扩增引物序列为:ITS1 F 5′-TCCGTAGGTGAACCTGCGG-3′;ITS4 R 5′-TCCTCCGCTTATTGATATGC-3′。测序结果序列经美国国立生物技术信息中心(National Center for Biotechnology Information, NCBI)的BLAST引擎搜索后获取相关种属的ITS序列,用Clustal X 1.8软件进行排列对齐,排除碱基缺失位点,用邻接法(neighbor-joining)构建系统发育树。
1.4 代表性土样的选择与理化性质分析
将活性菌株来源土样作为后续分析的代表性土样。每个样点各自另取10 g土样,烘干后计算样品的含水量并记录。另外称取10 g土样,加入25 mL蒸馏水,在150 r·min-1的摇床上充分混匀5 min,静置30 min后,用pH计测定土壤pH值。按照土壤有机质测定方法[17]进行土壤有机质含量测定,采用原子吸收分光光度法[18]进行铁含量测定。
1.5 代表性土样真核微生物DNA提取与生物信息学分析
1.5.1 高通量测序DNA的提取与扩增 称取2 g各代表性土样,采用土壤基因组提取试剂盒MOBIO PowerSoi®DNA Isolation Kit进行土壤总DNA提取。高通量测序(测序范围:ITS3~ITS4)聚合酶链式反应(polymerase chain reaction, PCR)的引物为:ITS3 F 5′-GCATCGATGAAGAACGCAGC-3′;ITS4 R 5′-TCCTCCGCTTATTGATATGC-3′。扩增样本须经质量检查合格后才可测序,免培养模型每个样品预计测序量为10 000条。将模糊碱基、单碱基高重复区以及长度过短的序列去除,得到供精准分析的优化序列,对序列进行去噪,用UPARSE 7.1软件进行聚类分析,以97%的相似性生成OUT。每个OTU代表1个物种。
1.5.2 代表性土样生物信息学分析 采用RDP classifier贝叶斯算法(http:∥rdp.cme.msu.edu/)对UNITE ITS数据库中每个ITS基因序列进行分类分析,分类置信度阈值70%,利用Mothur V.1.30.1软件进行α多样性分析[19],采用Shannon、Simpson和Coverage指数评估群落多样性,使用I-Sanger云平台(上海美吉生物医药科技有限公司)进行微生物差异与环境因子相关性分析,采用Canoco 5软件进行冗余分析。本研究高通量测序数据已上传到NCBI-SRA(Sequence Read Archive)数据库(http:∥www.ncbi.nlm.nih.gov/sra/ PRJNA592046),登录号为:PRJNA592046。
2 结果与分析
2.1 代表性土壤理化指标分析
铁载体高活性菌株来源于8个代表土样,编号为1_1、1_5、2_5、2_6、2_8、2_14、2_54和2_75,其中,1_1、1_5土样来源于低海拔河谷灌木林及次生林区域;其余土样来源于高海拔原始森林区域(2_5、2_6、2_8和2_14为常绿阔叶和针叶林;2_54和2_75为常绿阔叶林)。通过分析这些代表性土样的理化性质,发现土壤有机质含量、土壤质量含水量、海拔、铁元素含量和pH值是影响微生物群落结构和分布的重要理化因子,结果如表1所示。高海拔原始森林(2_5、2_6、2_8、2_14、2_54及2_75)土壤有机质含量和土壤质量含水量普遍较高,而土壤pH值和铁元素含量普遍较低;低海拔河谷灌木林及次生林土样(1_1及1_5)的理化性质则与之相反。
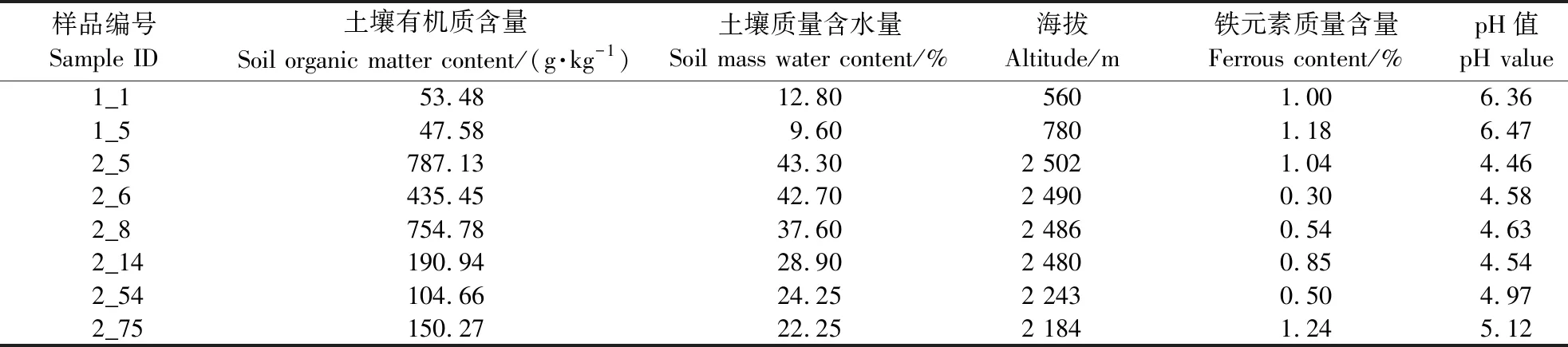
表1 采样地基本概况
2.2 土壤环境对可操作分类单元的总体影响
2.2.1 土壤环境对可操作分类单元多样性的影响 利用高通量测序技术,经序列过滤去除嵌合体序列,8个代表性土样最终得到可用于后续分析的优质序列399 042条,质控后序列长度在230~460 bp之间,平均长度342 bp,满足序列分析要求。进一步采用Qiime软件,在97%的相似度下将其聚类为可用于物种分类的OTU。8个样品共获得1 550种OUT信息(含7门24纲73目161科316属)。各样本测序深度指数均大于99.7%,测序已覆盖测试样品中的大部分物种,可以真实展示土壤中的绝大多数真菌。所测土壤样本真菌数量及多样性分析如表2所示。高海拔原始森林(2_5、2_6、2_8、2_14、2_54及2_75)土壤真菌OUT数量、群落丰富度和多样性总体不及低海拔河谷灌木林及次生林区域土样(1_1与1_5),高海拔原始森林土样的香农指数偏低,而辛普森指数偏高,这表明高海拔原始森林土壤环境对其中生存的微生物存在选择性影响。
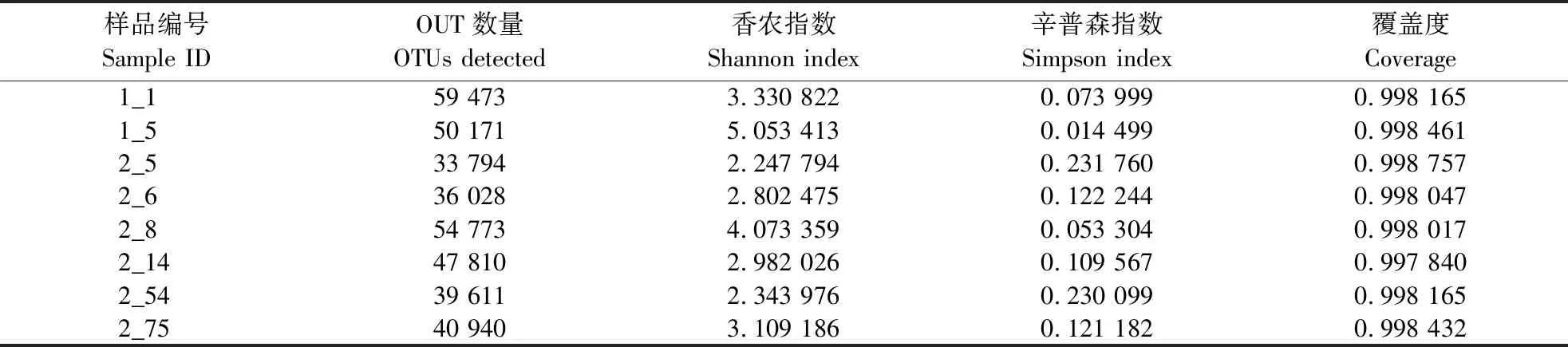
表2 土壤样本真菌可操作分类单元数量及多样性分析
2.2.2 土壤环境对可操作分类单元组成的影响 高通量测序所有OTU数据均经过抽平后,采用距离算法对8个土样的代表性物种OUT进行Average样本层级聚类分析[图1(a)],发现来源于低海拔河谷样本与高海拔原始森林样本有显著不同,分别聚于不同的分支。典型相关分析(canonical correlation analysis, CCA)结果[图1(b)]进一步表明,环境因子对样本OTU组成有重要影响。土壤铁含量(ferrous content, FEC)与pH值对低海拔河谷样本OTU组成影响较大;而土壤质量含水量(soil mass water content, SWC)、土壤有机质含量(soil organic matter content, SOM)和海拔(altitude, ALT)对高海拔原始森林土样OTU的组成影响较大。
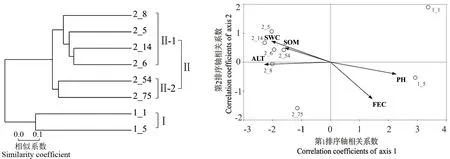
(a)聚类分析 Clustering analysis (b)典型相关分析CCA
2.3 土壤环境对铁载体子囊菌功能类群分布的影响
2.3.1 活性菌株与可操作分类单元对应关系分析 活性菌株-OTU定位聚类图如图2所示,所有活性菌株均为子囊菌门微生物。从图2可以看出,1-1F1、1-5F1和1-5F2分别与ATCC1022、CBS113365及ATCC16903曲霉属(Aspergillus)典型菌株相似度最高,初步鉴定为曲霉属微生物。2-75F1与ARSEF2107绿僵菌属(Metarhizium)典型菌株相似度最高,确定为绿僵菌属微生物。1-5F3、2-5F1、2-6F1、2-8F1、2-14F1、2-54F1与NRRL2011、NRRL908、CBS223.66、CBS340.48、ATCC18323及CBS117192青霉属(Penicillum)典型菌株相似度最高,确定为青霉属微生物。2-8F2与ARSEF3405白僵菌属(Beauveria)典型菌株相似度最高,确定其为白僵菌属微生物。2-8F3、2-5F2、2-14F2均与木霉属(Trichoderma)典型菌株CBS121219相似度最高,为木霉属微生物。2-6F2与CBS314.59篮状菌属(Talaromyces)典型菌株相似度最高,为篮状菌属微生物。为分析纯培养活性菌株与环境因子的相互关系,将铁载体活性菌株(及其相似标准菌株)的ITS序列与土壤高通量测序相应属的代表性OTU序列进行聚类分析,从OTU水平对相应的菌株进行定位。曲霉属活性菌株1-1F1、1-5F2与OTU658最为类似,曲霉属活性菌株1-5F1则与OTU516较为接近[图2(a)],绿僵菌属活性菌株2-75F1可定位为OTU1134[图2(b)],青霉属活性菌株2-6F1、2-14F1、2-8F1、2-5F1可定位为OTU1076,2-54F1及1-5F3可分别定位为OTU1017及OTU475[图2(c)]。白僵菌属活性菌株2-8F2与OTU852最接近[图2(d)]。木霉属活性菌株2-8F3、2-5F2及2-14F2则可定位为OTU1270[图2(e)]。篮状菌属活性菌株2-6F2与OTU1175较为类似[图2(f)]。通过该工作,将定位后OTU称为活性OTU,所有活性菌株与特定OUT均可以一一对应或多一对应,用于后续分析。

注:进化树分支上的数值表示置信度。Note: the value on the branch of the phylogenetic tree represents the confidence.
图2 活性菌株-可操作分类单元定位聚类图
Figure 2 Active strains-OTUs location clustering tree
2.3.2 土壤环境对活性可操作分类单元分布的影响 依据2.3.1活性菌株与OTU的定位结果,对这些OTU的分布情况进行调查分析,结果如表3所示。源于曲霉属的OTU516及OTU658主要集中分布于低海拔河谷灌木林及次生林区域土样;源于青霉属、白僵菌属、绿僵菌属、木霉属及篮状菌属的活性OTU则在所有土样中均有分布,但源于青霉属的OTU1017及源于木霉属的OTU1270绝大部分存在于高海拔原始森林土样中。
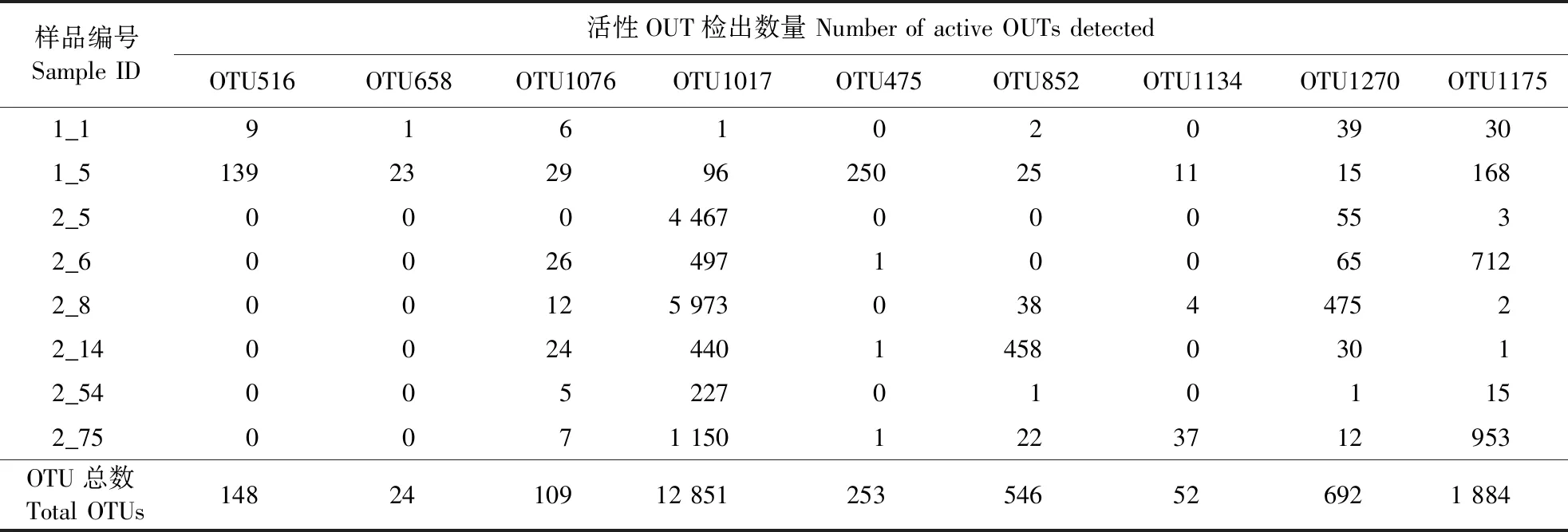
表3 土壤样品中活性可操作分类单元检出数量
活性OTU分布与环境因子相关性分析结果如表4所示,海拔对源于曲霉属的OTU516及OTU658的分布有一定负影响,而土壤pH值则对其有正效应。土样有机质含量对源于青霉属的OTU1017的分布有极显著的正影响。同时,土样有机质含量对源于木霉属的OTU1270的分布也有明显的促进效应。
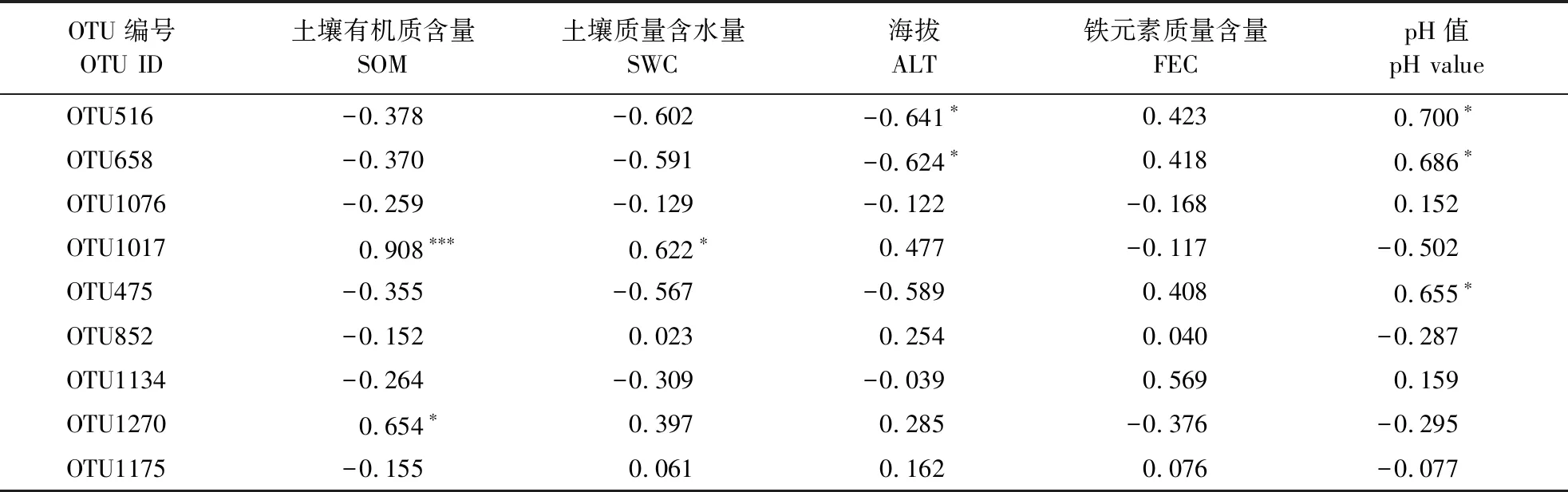
表4 活性可操作分类单元分布与环境因子相关性分析
注:***表示P<0.01,显著相关;*表示0.05 2.3.3 土壤环境对子囊菌功能类群分布的影响 为进一步验证2.3.2活性OTU分布情况的分析结果,对高通量测序结果中相关属的所有代表性OTU进行了综合分析,活性菌株相关属OTU分布与环境因子的相关性分析结果如表5所示:曲霉属受pH值(正相关,P<0.05)、海拔影响较大(负相关,P<0.05),与土壤质量含水量有一定负相关关系;青霉属则与土壤有机质含量呈极显著正相关(P<0.01);另外,白僵菌属、绿僵菌属与pH值有一定正相关关系(P<0.1)。木霉属及篮状菌属与所有环境因子的相关性均不显著。曲霉属、青霉属OTU的总体分析结果与活性OTU分析结果比较吻合。 表5 活性菌株相关属可操作分类单元分布与环境因子的相关性分析 注:***表示P<0.01,极显著相关;* *表示P<0.05,显著相关;*表示0.05 土壤环境对微生物的组成具有重要的影响。高海拔原始森林土样与其它土样相比,土壤有机质含量更高(高海拔原始森林土样平均为403.87 g·kg-1;低海拔河谷灌木林及次生林土样平均为50.53 g·kg-1);而铁元素含量则更低(高海拔原始森林土样平均为0.745%;低海拔河谷灌木林及次生林土样平均为1.09%)。从低海拔河谷灌木林及次生林区域到高海拔原始森林区域,土壤质量含水量呈增加趋势,而土壤pH值则呈下降趋势。 结合土样中优势活性OTU分布情况分析可以看出,有机质含量对代表青霉属的OTU1017和木霉属的OTU1270均有正效应,而铁含量和pH值则为负效应,这可能与微生物活动导致的腐殖质形成和伴生的铁元素利用有关。青霉属和木霉属子囊菌都是自然界很重要的纤维降解微生物[20-23],受高海拔原始森林凋落物(主要成分为纤维素和木质素)的长期驯化,这些微生物对腐殖质的形成产生了重要的影响,而腐殖质的增加必定会提高土层的保水能力;同时,它们分泌的酸性铁载体类化合物(真菌的铁载体绝大部分为异羟肟酸型)也导致了土壤pH值和土壤中铁元素含量的降低。在这种条件下,森林土壤就会进一步对其中生存的微生物产生选择性,比如受pH值正影响的曲霉属OTU绝大部分源自低海拔河谷灌木林及次生林土样,并促进具有相似功能的微生物形成特定结构的微生物功能群落[24],因此,高海拔原始森林土壤中真核微生物的多样性和丰富度要低于低海拔河谷灌木林及次生林土样。高铁载体活性菌株获取铁元素的能力强,在铁的争夺竞争中均处于优势地位,其对铁含量的变化不敏感,因此,铁元素含量与活性OTU关系不显著。 通过纯培养结合ITS扩增子高通量测序的方法,只能间接或部分揭示铁载体产生菌在环境中的分布状态及其与环境之间的关系。受限于纯培养条件,图2展示的许多OTU的功能仍无法确定。如何直观、全面地反映一个环境样本中铁载体功能类群的结构及其与环境之间的联系,还需要设计新的考察方法。 特定标示基因的筛选是研究产铁载体真菌群落的基础,对于产铁载体真菌而言,由于绝大多数物种产异羟肟酸型铁载体,且涉及铁载体的合成基因(sidA,sidC及sid2)、调节基因(urbs1、sreA、sreP及bir1)及转运蛋白基因(mirA及mirC等)都存在一定的保守性[25-26],在今后的工作中,从这些铁载体功能基因入手来筛选标示基因或许是一种可行的方案。 原始森林土样中的真核微生物在土壤有机质转化和土壤矿物质利用良性循环过程中发挥了重要的作用,其中的产铁载体真核微生物是一类值得深入挖掘的重要功能性资源。云南有着我国集中存在的原始森林资源,其在水源涵养、土壤保育及构建西南生态安全屏障方面起到了关键作用[27],可以预测,其中的土壤微生物对这样一种生态系统的形成和维持发挥了重要作用。通过开展云南原始森林土壤子囊菌功能类群资源发掘工作,可以充分利用该地区在地理、气候及植被上的优势,获得多样性丰富、功能明确的微生物种质资源,为持续深入开展功能微生物的保护和利用奠定基础。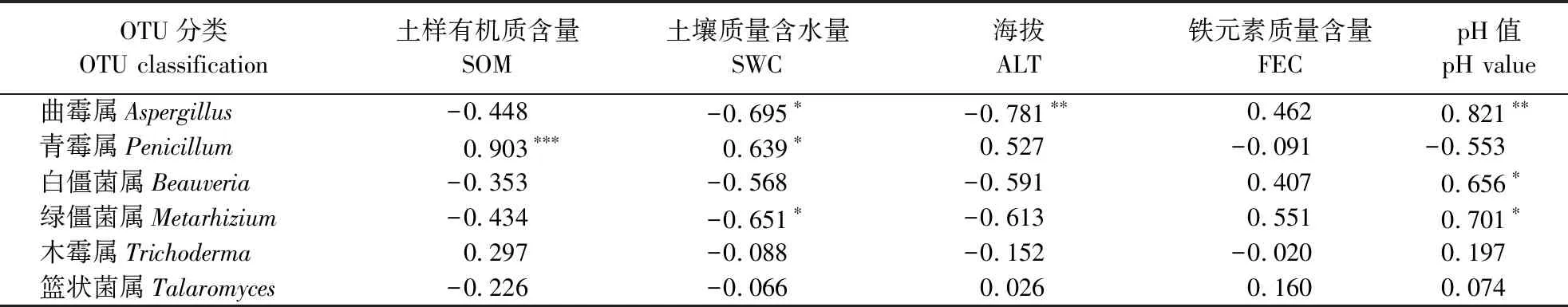
3 讨论与结论
