福建省樟树溃疡病病原菌的分离与鉴定
2020-05-24张晓阳王美鑫韩森汇陈全助
张晓阳,吴 松,王美鑫,韩森汇,宋 漳,陈全助
(1.福建农林大学林学院,福建 福州 350002;2.福建农林大学金山学院,福建 福州 350002)
樟树[Cinnamomumcamphora(L.) Presl],又名香樟、芳樟,属樟科(Lauraceae)樟属(Cinnamomum)常绿乔木,是国务院1999年8月4日批准的国家Ⅱ级重点保护野生植物之一[1]。樟树材质致密美观,含有特殊香气,耐湿,抗腐防虫,是造船、家具等行业的上等用材。樟树植株全身皆可提取樟脑和芳香油,广泛应用于化工、医药,是重要的特用经济林[2]。随着人们对樟树资源潜在价值认识的深入及开发利用技术的提高,全国各樟树适生区开始大面积种植樟树[3]。樟树自然分布于中国南方各省、越南以及日本等地[4-6],亚洲东部、大洋洲和太平洋诸岛也都有分布。2015年以来,福建省全省林业有害生物普查发现,福州、三明、龙岩和南平等地均有樟树溃疡病的分布,其中仅南平市顺昌县受害面积便高达20 hm2,为樟树种植产业的发展敲响了警钟,摸清该病害的病原菌也成了迫在眉睫的任务。
樟树溃疡病1994年首次在湖南发现,郭立中等[7]初次鉴定病原为囊孢壳菌(Physalosporasp.),有性态为大茎点霉(Macrophomasp.);随后邓先琼等[8]调整鉴定病原有性态为葡萄座腔菌(Botryosphaeriadothidea),无性态为七叶树壳梭孢(Fusicoccumaesculi)。在2019年翟立峰等[9]对重庆樟树溃疡病进行了分离和系统鉴定,前期的研究范围主要集中在湖南[7-8]、江苏[10]和上海[11]等地,目前关于福建省樟树溃疡病的研究鲜见报道。鉴于此,本研究通过采集福建省内樟树溃疡病样本进行病原菌纯化,根据病原菌的形态学特征、致病性以及对核糖体基因内转录间隔区(internal transcribed spacer of ribosome gene,ITS)、翻译延伸因子(translation elongation factor,EF-1α)、RNA聚合酶Ⅱ大亚基(RNA polymerase Ⅱ large subunit,RPB2)和β-微管蛋白(β-tubulin,BT)基因序列进行扩增和测序,对病原菌进行系统的鉴定,从而填补福建省樟树溃疡病研究这一空缺。
1 材料与方法
1.1 供试菌株
样本采集自福建省福州市仓山区、三明市明溪县、南平市建阳区和顺昌县,现由福建农林大学森林保护研究所保存。
1.2 病原菌分离与纯化
采用常规病组织分离法[12]。取病健交界处表皮,剪成5 mm×5 mm的组织块,用体积分数75%的酒精浸泡30 s,再用质量分数0.1%的升汞浸泡1 min后,用无菌水漂洗3遍,置于滤纸上吸干水分,将组织块呈梅花状置于先前倒好的马铃薯葡萄糖琼脂(potato dextrose agar,PDA)平板上。28 ℃恒温培养箱黑暗培养,待组织块周围长出菌丝后,挑取菌丝移至新的PDA平板中继续培养,根据菌落的颜色以及形态特征编号。
1.3 致病性测定
根据柯赫氏法则,采用活体针刺和无伤接种法进行致病性测定。将菌饼接种在健康且长势基本一致的2年生樟树幼苗枝干上,对照组接种空白PDA,每个处理重复3次,用湿润的脱脂棉包扎,最外面使用医用胶带固定,将接种的幼苗置于温室30 ℃保湿培养,逐日测量病斑的长度与宽度,并利用椭圆面积公式计算病斑扩展面积。取接种发病后的部位进行组织分离、镜检观察和ITS序列比较,确定病原菌,将具有致病性的菌株保存备用。
1.4 病原菌形态学鉴定
将病原菌接种到PDA培养基上,28 ℃黑暗培养,观察记录菌落形态[13],并在接种的枝干上每日观察枝干表面子实体形成的情况,子实体形成后采用冷冻切片和压片的方法在显微镜下观察菌株的子实体和孢子形态,显微镜拍照并测量孢子大小。
1.5 病原菌分子鉴定
将菌株接种在PDA平板上,28 ℃黑暗培养3 d后刮取新鲜的菌丝,采用SP Fungal DNA Kit试剂盒,提取病原菌脱氧核糖核酸(deoxyribonucleic acid, DNA),分别对ITS、EF-1α、RPB2和BT基因序列进行聚合酶链式反应(polymerase chain reaction, PCR)扩增[14-15]。反应参数为:94 ℃预变性2 min,94 ℃变性30 s,52~55 ℃退火45 s,72 ℃延伸1 min;35个循环;72 ℃延伸5 min,4 ℃保存10 min。将扩增好的DNA条带,使用EasyPure Quick Gel Extraction Kit试剂盒进行DNA回收,之后将DNA片段连接到载体pMD18-T上,转化至大肠杆菌DH5α感受态细胞中,经过阳性验证后,将菌液送至北京擎科生物科技公司测序。
1.6 系统进化树的构建
将得到的序列在美国国立生物技术信息中心(National Center for Biotechnology Information, NCBI)里初步比对,然后整理自己的序列和下载的对比序列,按照ITS、EF-1α、RPB2、BT的顺序建立一个文本,利用MEGA 7.0软件进行对齐分析,将输出的文件使用Sequence Matrix软件进行4个基因的串联拼接,用数据分析模型和邻接法(neighbor-joining)构建系统进化树,自展支持值(bootstrap)为1 000。
1.7 数据处理
采用SPSS 21.0软件对病斑扩展数据进行分析,以Duncan′s新复极差法进行差异显著性检验。测量孢子大小得出的数据采用Excel 2007软件进行分析。
2 结果与分析
2.1 樟树溃疡病病害症状
樟树枝干溃疡病从3月份开始出现,该病害最初在枝干、枝丫出现近圆形黑褐色病斑,随着病斑的扩展枝干开始凹陷,在枝干表皮开始有黑色子实体产生,如图1(a)所示,随着病斑扩展形成梭形病斑,并且颜色加深;后期发病处树皮开裂甚至肿大形成瘤状物,如图1(b)所示;病斑以上的枝条和叶片逐渐坏死,如图1(c)所示。该病害在林间扩展迅速,短时间内可形成大面积的枝干枯死,危害巨大。

(a)枝干上的子实体Fruit bodies on the branch (b)枝干开裂Cracked branches (c)顶端枯萎Apical blight
图1 樟树溃疡病症状
Figure 1 Symptoms of camphor tree canker disease
2.2 病原菌的致病性测定
采用活体接种的方式将不同地区分离到的75份菌株在盆栽的樟树幼苗上进行致病性测定。结果显示,在接种JY-1、JY-2、JY-3、JY-4、JY-5、JY-6、FZ-1、MX-5和SC-1菌株的樟树枝干上出现溃疡症状,接种2 d后开始有浅褐色近圆形的病斑出现,其中JY-5、MX-5、SC-1菌株有少量菌丝产生。随着病斑的扩展,形成近椭圆或梭形的褐黑色病斑;7 d后枝干病斑内周开始产生黑色子实体,并且病斑开始轻微凹陷;接种病原菌21 d的病斑形态如图2所示,后期病斑逐渐环绕,病斑上部的枝干开始出现枯死。

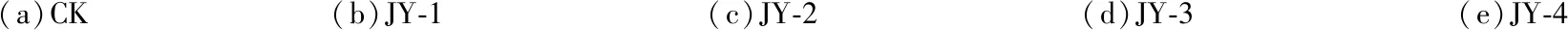
(a)CK(b)JY-1(c)JY-2 (d)JY-3 (e)JY-4


(f)JY-5(g)JY-6(h)FZ-1(i)MX-5(j)SC-1
图2 接种病原菌21 d的病斑形态
Figure 2 Speckle morphology of trees after 21 days of inoculation
对发病的枝条进行再分离,所得病原菌与原接种病菌形态一致,并且ITS序列相同。对不同致病菌株接种樟树幼苗后21 d的病斑面积进行差异性显著分析,结果如图3所示:不同菌株之间致病性差异显著,其中JY-5菌株致病性最强,病斑面积达340.17 mm2,JY-2菌株的致病性最弱,病斑面积为51.94 mm2。

注:不同小写字母表示在0.05水平上差异显著。Note: the different lowercase letters indicate the difference at level 0.05.
图3 不同致病菌株对樟树幼苗的致病性测定
Figure 3 Pathogenicity of different pathogenic strains on camphor seedlings
2.3 病原菌的形态学特性
从不同地区共采集到樟树溃疡病样品75份,经过组织分离,致病性测定,最后得到43株具有葡萄座腔菌属真菌特征的菌株。根据在PDA上的菌落形态和孢子特征分为4个类型,分别为Ⅰ型(JY-5、JY-8、JY-13、JY-34、JY-35、MX-5、MX-7、MX-8、MX-11、MX-21、SC-1、SC-4、SC-7),Ⅱ型(JY-1、JY-2、JY-4、JY-6、JY-9、JY-22、JY-23、JY-40、MX-2、MX-3、MX-9、MX-23、MX-24、MX-25、MX-37、SC-9、SC-10、FZ-6),Ⅲ型(JY-3、JY-15、JY-17、MX-1、MX-15、FZ-4),Ⅳ型(FZ-1、FZ-2、FZ-3、FZ-12、FZ-13、FZ-33)。
代表菌株JY-5的菌落特征和分生孢子形态与小新壳梭孢(N.parvum)相似,小新壳梭孢形态学特征如图4所示。从图4可以看出,在PDA平板上,菌落为白色,气生菌丝较为密集,2 d后菌落气生菌丝变成灰白色,菌落背部开始出现橄榄绿色,后期菌落上部为一些白色气生菌丝,下部的菌丝变成黑色,菌落背部为深灰色或者黑色。分生孢子器着生在樟树枝干表面,黑色、近球形、单腔。分生孢子器壁褐色,由致密、厚壁的角质化组织构成。分生孢子梗无色透明,着生在分生孢子器的内壁上,短棒状、尖端略尖,产生分生孢子。分生孢子单孢,近椭圆形至纺锤形,薄壁、无隔、无色透明,且内有油球,大小为(11.90~18.90) μm×(5.34~7.29) μm。


(a)前期和后期的菌落正面The front of the colony in the early and later stages(b)分生孢子器Pycnidium(c)子囊Ascus


(d)分生孢子Conidia(e)萌发的分生孢子Germinated conidia(f)萌发的分生孢子Germinated conidia
图4 小新壳梭孢形态学特征
Figure 4 Morphological characteristics ofN.parvum
根据代表菌株JY-3的菌落特征和分生孢子形态初步判定为假可可毛色二孢(L.pseudotheobromae),其形态学特征如图5所示。从图5可以看出,在PDA平板上,菌落气生菌丝较为稀疏,颜色呈白色,菌落背部也呈白色。菌落后期菌丝变密,颜色呈灰黑色,菌落背部也呈灰黑色;分生孢子器,单腔,大小不一致,在分生孢子器内组织形成分生孢子梗,从而形成分生孢子。该菌株会形成2种类型分生孢子,初期分生孢子无色透明,棒状或者近椭圆形,无隔膜,内含油球,大小为(20.65~29.10) μm×(11.06~17.51) μm,壁厚达(1.04±0.02) μm;成熟孢子颜色呈褐色,出现横膈膜,并且有纵纹产生,大小为(20.83~30.96) μm×(12.46~16.19) μm。
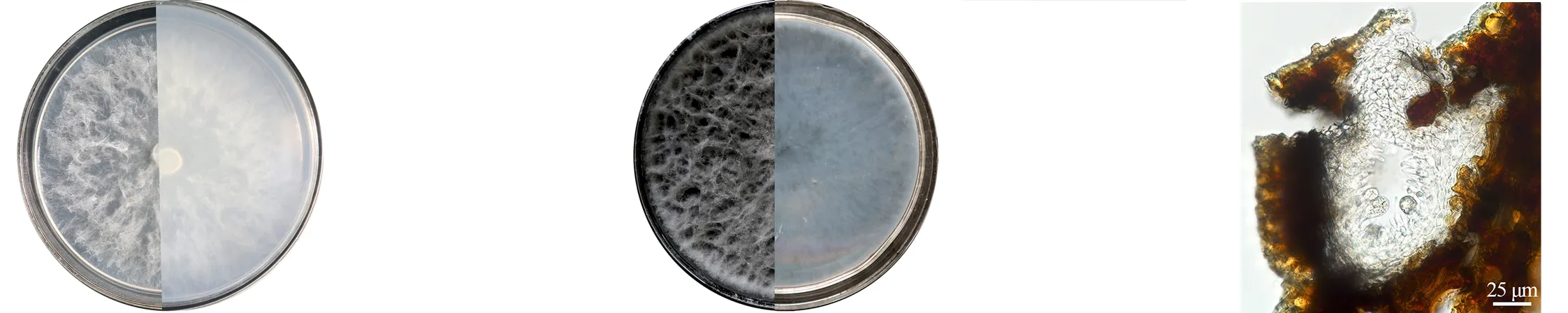

(a)前期菌落形态(正面和反面)Early colony morphology(front and back)(b)后期菌落形态(正面和反面)Late colony morphology(front and back)(c)分生孢子器和分生孢子梗Pycnidium and conidiophore


(d)分生孢子Conidia(e)萌发的孢子Germinated conidia(f)成熟的分生孢子Mature conidia
图5 假可可毛色二孢形态学特征
Figure 5 Morphological characteristics ofL.pseudotheobromae
根据代表菌株JY-6的菌落特征和分生孢子形态初步判定为可可毛色二孢(L.theobromae),其形态学特征如图6所示。从图6可以看出,菌落正面气生菌丝较为密集,颜色呈白色,菌落背部也呈白色。菌落后期菌丝颜色呈灰黑色,菌落背部呈灰黑色。分生孢子器,单腔,大小不一致,在分生孢子器内组织形成分生孢子梗,从而形成分生孢子。该菌株会形成2种类型分生孢子,初期分生孢子无色透明,近椭圆形,无隔膜,内含油球,大小为(17.64~29.72) μm×(11.28~18.38) μm,壁厚达(0.94±0.01) μm;成熟孢子颜色呈褐色,出现横膈膜,颜色较深并且有纵纹产生,大小为(19.92~27.83) μm×(12.11~15.14) μm。


(a)前期菌落形态(正面和反面)Early colony morphology(front and back)(b)后期菌落形态(正面和反面)Late colony morphology(front and back)(c)分生孢子器Pycnidium
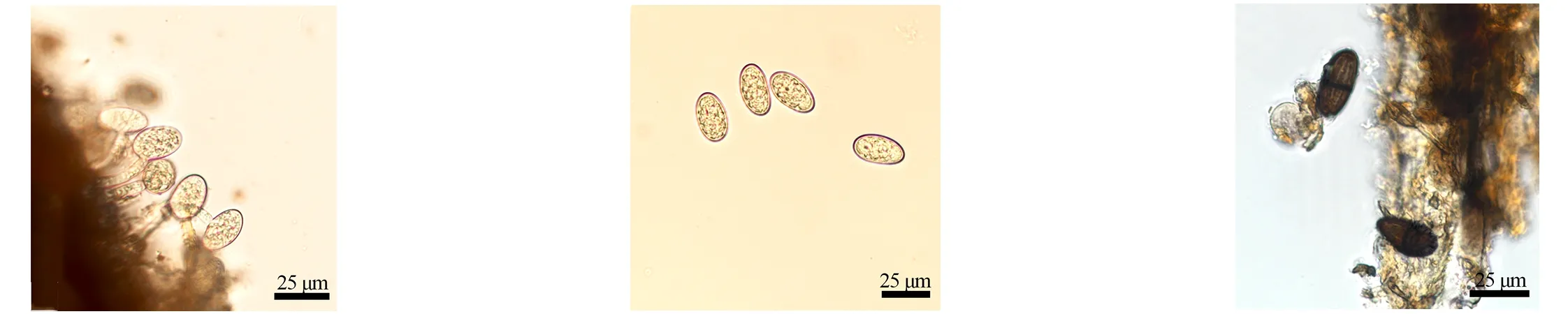

(d)分生孢子梗Conidiophore(e)早期的分生孢子Early conidia(f)成熟的分生孢子Mature conidia
图6 可可毛色二孢形态学特征
Figure 6 Morphological characteristics ofL.theobromae
根据代表菌株FZ-1的菌落特征和分生孢子形态初步判定为L.iranensis,其形态学特征如图7所示。从图7可以看出,菌落正面气生菌丝较为密集,颜色呈白色,菌落背部也呈白色。菌落后期菌丝颜色呈灰黑色,菌落背部呈灰黑色。分生孢子器,单腔,大小不一致,直径可达228.57 μm。在分生孢子器内组织形成分生孢子梗和侧丝,侧丝较为明显,分生孢子梗上产生分生孢子。该菌株会形成2种类型分生孢子,初期分生孢子无色透明,近椭圆形或者棒状,无隔膜,内含油球,大小为(21.62~31.23) μm×(11.46~16.19) μm,壁厚达(1.32±0.02)μm;成熟孢子颜色呈褐色,出现横膈膜,颜色较深并且有纵纹产生,大小为(19.30~26.25) μm×(11.65~14.91) μm。


(a)前期菌落形态(正面和反面)Early colony morphology(front and back)(b)后期菌落形态(正面和反面)Late colony morphology(front and back)(c)分生孢子器Pycnidium


(d)分生孢子梗Conidiophore(e)早期的分生孢子Early conidia(f)成熟的分生孢子Mature conidia
图7L.iranensis形态学特征
Figure 7 Morphological characteristics ofL.iranensis
2.4 病原菌的系统发育分析
经过对9个代表菌株的ITS、EF-1α、RPB2和BT序列进行扩增和测序,对得到的序列进行串联分析,最后构建进化树,结果如图8、图9所示,SC-1、JY-5、MX-5这3个代表菌株都与N.parvum聚在同一组群上。JY-3菌株聚在L.pseudotheobromae上,与菌株CBS 116459相似性达97%,FZ-1菌株聚在L.iranensis上,与菌株CBS 124710相似性达99%,其他4个菌株都聚在L.theobromae这一组群上。
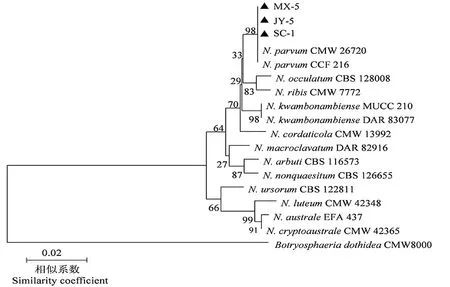
注:进化树分支上的数值表示置信度。Note: the value on the branch of the phylogenetic tree represents the confidence.
图8 新壳梭孢属代表菌株的系统进化树
Figure 8 Phylogenetic tree of the representing strains of the genusNeofusicoccum

注:进化树分支上的数值表示置信度。Note: the value on the branch of the phylogenetic tree represents the confidence.
图9 毛色二孢属代表菌株的系统进化树
Figure 9 The phylogenetic tree of the representing strains of the genusLasiodiplodia
3 讨论与结论
毛色二孢属(Lasiodiplodia)和新壳梭孢属(Neofusicoccum)[16-17]都属于葡萄座腔菌科(Botryosphaericeae)无性阶段的菌物,有性态属于葡萄座腔菌属(Botryosphaeria)。它们的寄主广泛,能够侵染多数的果树和经济树种。对于溃疡病已报道的有桉树溃疡病[18]、核桃溃疡病[19]、胡桃木茎溃疡病[20]和澳大利亚松树溃疡病[21]等。本研究在国内首次发现了小新壳梭孢的有性态孢子,其形态为具有棒状子囊,子囊内含有8个不规则排列的子囊孢子,子囊孢子和分生孢子形态相似。对于毛色二孢菌暂未发现有性态,故在本研究中,对于病原菌的命名统一使用无性态来命名。
对福建省内樟树枝干溃疡病样本分离,经形态学鉴定后结合ITS、EF-1α、RPB2和BT串联基因序列进行分子鉴定,最终确定4种类型菌株,分别为小新壳梭孢(代表菌株JY-5、MX-5、SC-1),假可可毛色二孢(代表菌株JY-3),可可毛色二孢(代表菌株JY-2、JY-2、JY-4、JY-6),L.iranensis(代表菌株FZ-1)。樟树溃疡病首次在湖南发现[7]后经邓先琼等[8]调整鉴定为B.dothidea,以及在2019年翟立峰等[9]的研究中将可可毛色二孢(有性态:B.dothidea)和小新壳梭孢(有性态:B.parva)作为病原菌进行了报道,以上报道与本研究结果一致;与赵桂华[10]、王明生等[11]的研究结果有所偏差,其原因可能是地理位置的差异,使得植物和真菌均呈现出不同于其他地区的生长特性,且毛色二孢属和新壳梭孢属的菌株更易受温湿度的影响。此外,本研究首次发现樟树溃疡病病原菌也包含假可可毛色二孢和L.iranensis这2种类型菌株。
通过对致病性的研究表明,各种菌株之间的致病性差异明显,其中小新壳梭孢最强,L.iranensis最弱,但是所有致病菌株在无伤接种的情况下并不发病,这也为防治樟树溃疡病提供了一定的思路,在野外为樟树修剪枝条时,除了要在合适的时期进行,修剪完后可以喷洒化学试剂,起到保护作用,避免因为修枝制造的伤口导致溃疡病爆发。
