CysC、α1-MG及β2-MG在慢性阻塞性肺疾病患者的检测价值及与缺氧所致肾损伤的相关性
2020-05-24李海燕
李海燕
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是以呼吸气流不完全可逆受限的肺部疾病[1-2],严重威胁患者生命健康,预计未来5年将成为全世界第3 位导致死亡的病因[3]。随着COPD 病情发展,最终可出现多器官功能衰竭,其中COPD 早期肾损伤是近年来研究的热点[4]。由于COPD 患者长期缺血缺氧,肾有效循环血量锐减,肾实质灌注不足,肾小球滤过率降低,最终形成肾功能损伤[5]。而长期慢性缺氧所致的肾实质损伤近年来得到广泛关注。因此,早期识别肾功能改变情况是评估COPD 并发肾损伤的关键所在。目前对于早期反映肾损伤的指标已有相关报道,本实验将探讨血清胱抑素C(Cystatin C,CysC)、α1 微球蛋白(α1-microglobulin,α1-MG)及β2 微球蛋白(β2-microglobulin,β2-MG)在COPD 检测价值及与缺氧所致肾损伤的相关性。现将研究过程及结果汇报如下。
1 资料与方法
1.1 一般资料
选取2013年1月至2016年8月在本院呼吸内科救治的206例COPD 患者。其中男性121例,女性85例。年龄55~75 岁,平均年龄为(61.76±8.45)岁。所有患者按照氧分压分度[6]分为3 组,即轻度缺氧组64例(80 mmHg≥SPO2>60 mmHg)、中度缺氧组86例(60 mmHg≥SPO2>40 mmHg)及重度缺氧组56例(SPO2≤40 mmHg);另外同期选择门诊健康体检者50例作为正常对照组。其中男性28例,女性22例,平均年龄在(58.44±6.98)岁;以上四组患者在年龄、性别、体重等方面差异均无统计学意义(P>0.05),具有可比性。所纳入206例COPD患者入组标准:①所有患者均符合中华医学会呼吸病学关于COPD 诊治指南的诊断标准[7];②未曾行COPD 规范化治疗;③患者或家属知情同意。排除标准:继发性肾病如高血压性肾病、原发性肾病、上尿路感染等、糖尿病肾病或使用肾毒性药物等;合并有多器官功能衰竭者;患者神志及精神异常等。
1.2 方法
对入院第二天清晨空腹静脉抽血3 mL 行CysC、α1-MG、β2-MG、Scr、BUN 等相关生化指标检测,其中CysC、α1-MG、β2-MG 均采用免疫比浊法,CysC 试剂盒购自北京利德曼生化有限公司,α1-MG、β2-MG 试剂盒购自德国西门子公司;同时Scr、BUN 采用苦味酸尿素法测定,试剂盒由天津医学生物工程有限公司提供,以上相关指标均由我院引进的日立7600 型全自动生化分析仪进行检测,严格按照相关说明进行操作。
1.3 统计学方法
采用SPSS 17.0 软件进行统计分析;符合正态分布的计量资料采用()表示,两组间比较采用单独样本t检验,多组均数间比较用单因素方差分析;两变量间的相关关系采用Pearson 相关分析;运用ROC 曲线下面积(area under ROC curve,AUC)评价相关指标对COPD 早期肾损伤的预测价值。均行双侧检验,以P<0.05 为差异具有统计学意义。
2 结果
2.1 COPD 组与对照组CysC、α1-MG、β2-MG、Scr、BUN 的比较
COPD 组CysC、α1-MG、β2-MG 水平均高于正常对照组(P<0.05),而两组间Scr、BUN 水平差异无统计学意义(P>0.05),见表1。
2.2 4组间CysC、α1-MG、β2-MG、Scr、BUN的比较
与对照组比较,轻、中及重度组CysC 水平以及中、重度组α1-MG、β2-MG 水平均明显升高,差异有统计学意义(P<0.05);与轻度组比较,中、重度组CysC 水平及重度组α1-MG、β2-MG 水平均升高,差异有统计学意义(P<0.05);与中度组比较,重度组CysC 水平明显升高,差异有统计学意义(P<0.05),见表2。
表1 两组相关指标比较(±s)Table1 Comparison of related indicators between the 2 groups(±s)

表1 两组相关指标比较(±s)Table1 Comparison of related indicators between the 2 groups(±s)
组别对照组COPD 组t 值P 值n 50 206 Scr(μmol/L)76.01±15.76 83.36±34.39 1.318 0.231 BUN(mmol/L)5.84±1.43 6.43±3.12 1.562 0.128 CysC(mg/L)1.14±0.22 1.69±0.53 4.472 0.013 α1-MG(mg/L)8.84±1.56 13.63±4.35 5.124 0.004 β2-MG(mg/L)1.64±0.26 2.63±1.15 4.115 0.021
表2 4 组间相关指标比较(±s)Table2 Comparison of related indicators between the 4 groups(±s)
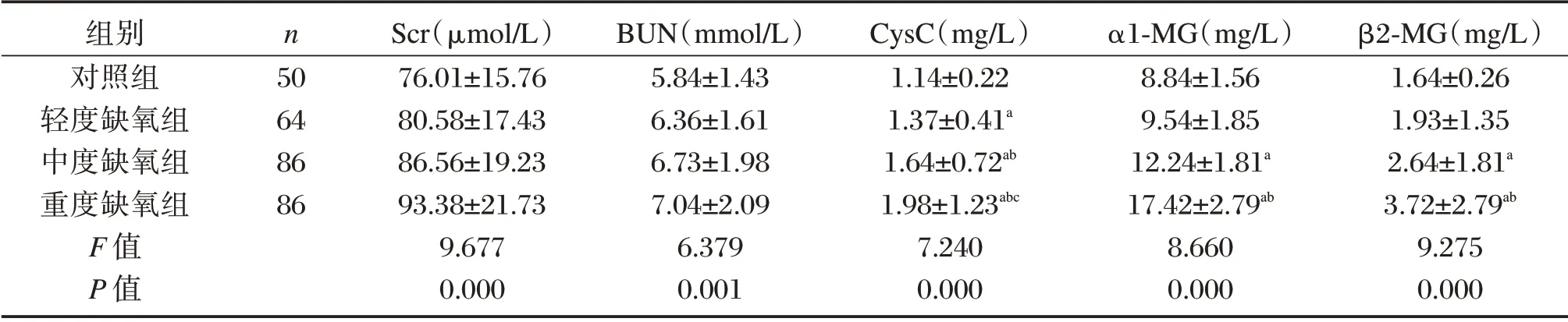
表2 4 组间相关指标比较(±s)Table2 Comparison of related indicators between the 4 groups(±s)
组别对照组轻度缺氧组中度缺氧组重度缺氧组F 值P 值n 50 64 86 86 Scr(μmol/L)76.01±15.76 80.58±17.43 86.56±19.23 93.38±21.73 9.677 0.000 BUN(mmol/L)5.84±1.43 6.36±1.61 6.73±1.98 7.04±2.09 6.379 0.001 CysC(mg/L)1.14±0.22 1.37±0.41a 1.64±0.72ab 1.98±1.23abc 7.240 0.000 α1-MG(mg/L)8.84±1.56 9.54±1.85 12.24±1.81a 17.42±2.79ab 8.660 0.000 β2-MG(mg/L)1.64±0.26 1.93±1.35 2.64±1.81a 3.72±2.79ab 9.275 0.000
2.3 CysC、α1-MG、β2-MG预测COPD的ROC曲线
ROC 曲 线 分 析 显 示:CysC 预 测COPD 的 曲线下面积为0.810,最佳阈值为1.74 mg/L 时,其预测COPD 早期肾损伤的敏感度为0.806,特异度为0.795;α1-MG 曲线下面积为0.743,最佳阈值为12.22 mg/L 时,其预测COPD 早期肾损伤的敏感度为0.726,特异度为0.705;β2-MG 曲线下面积为0.812,最佳阈值为2.34 mg/L 时,其预测COPD 早期肾损伤的敏感度为0.794,特异度为0.782,3 者联合检测的曲线下面积为0.915,敏感度为0.903,特异度为0.897,见图1。
2.4 CysC、α1-MG、β2-MG、BUN 与Scr 的相关性分析
Pearson 分析显示,CysC(r=0.672,P=0.011)、α1-MG(r=0.415,P=0.031)、β2-MG(r=0.550,P=0.029)BUN(r=0.023,P=0.436)均 与COPD 患者Scr 水平成显著正相关,差异具有统计学意义(P<0.05)。

图1 CysC、α1-MG、β2-MG 预测COPD 的ROC 曲线Figure1 ROC curves of CysC,α1-MG,β2-MG for COPD prediction
2.5 CysC、α1-MG、β2-MG 预测COPD 早期肾损伤的ROC 曲线
ROC 曲线分析显示:CysC 曲线下面积为0.856,最佳阈值为1.62 mg/L 时,其预测COPD 早期肾损伤的敏感度为0.824,特异度为0.786;α1-MG曲线下面积为0.722,最佳阈值为12.08 mg/L 时,其预测COPD 早期肾损伤的敏感度为0.816,特异度为0.774;β2-MG 曲线下面积为0.812,最佳阈值为2.58 mg/L 时,其预测COPD 早期肾损伤的敏感度为0.808,特异度为0.762,三者联合检测的曲线下面积为0.936,敏感度为0.914,特异度为0.903,见图2。

图2 CysC、α1-MG、β2-MG预测COPD早期肾损伤的ROC曲线Figure2 ROC curves of CysC,α1-MG,β2-MG predicting early renal injury in COPD
3 讨论
COPD 作为一种慢性缺氧性疾病,最终可使全身器官受累,但是COPD 合并肾损伤的研究较少[8]。因长期缺氧致肾毛细血管内皮功能障碍,肾有效灌注不足,最终使肾功能受损[9-10]。故早期检测能反映肾功能敏感及特异性指标,对减少肾功能进一步恶化及制定治疗方案至关重要。CysC 为半胱氨酸蛋白酶抑制剂超家族2 中的成员之一,其浓度不受肌肉组织、年龄、性别等的影响,研究认为CysC 与COPD 的发生发展及COPD 并发心血管疾病、肾损伤等密切相关。α1-MG 为肾小管功能损伤的敏感标志物、β2-MG 反映了肾小球的滤过功能。本研究结合COPD 患者肾功能损伤结果推测,COPD 患者病情越严重,肺功能逐渐恶化,气流受限程度呈进行性加重,机体缺氧也越重,导致各器官累及明显,引发肾损伤逐步加重。
近年来通常以Scr 用于反映肾功能改变情况,但易受患者性别、年龄、饮食习惯及身体状况等诸多方面影响,故在早期反映肾功能变化不够灵敏。CysC、α1-MG、β2-MG 属于小分子物质,在体内水平较稳定,不受外界环境影响,主要在肾小管上皮细胞吸收并降解随尿液排出,当肾小管受损时,三者重吸收减少,而在损伤早期患者血液中含量即上升[11],与王会卿等[12]研究结果相符。本实验发现,随着COPD 病情加重,CysC、α1-MG、β2-MG 随之升高,而Scr 升高不明显,因Scr 在早期反映肾功能方面上升较为延迟,仅当肾功能明显受损时Scr 才发生变化。而CysC、α1-MG、β2-MG 对肾功能的变化较Scr 敏感,早期可出现升高,与赵素芝等[13]研究结论相一致。
本研究结果表明,可以用CysC、α 1-MG、β2-MG 来替代Scr 用于反映早期肾功能改变情况。另外本研究通过CysC、α1-MG、β2-MG 预测COPD早期肾损伤的ROC 曲线发现3 者联合检测对检出COPD 早期肾损伤具有较好的诊断价值。
综上所述,联合检测CysC、α1-MG、β2-MG 对于预测COPD 患者疾病程度和预防缺氧所致肾损伤并发症的发生具有良好价值。
