黄鳝atrogin-1蛋白表达及细胞定位研究
2020-05-23王兆广刘泽军夏中曦范玉顶钟其旺
王 雨,王兆广,刘泽军,夏中曦,范玉顶,钟其旺
(1.江西农业大学 生物科学与工程学院/江西省农业微生物资源开发与利用工程实验室,江西 南昌 330045; 2.中国水产科学研究院 长江水产研究所,湖北 武汉 430223)
黄鳝(Monopterusalbus)属硬骨鱼纲、合鳃目、合鳃科、黄鳝属,其肉质鲜美,具有一定的药用价值以及较高的营养价值,是我国名优经济鱼类之一[1]。目前,黄鳝主要是网箱养殖[2],饲养环境过度拥挤,进食受限,活动空间过小,使得部分黄鳝生长状况不佳,肌肉的质量下降[3]。不仅如此,冬季低温以及疾病也会使黄鳝体质量下降。鱼类肌肉的生长过程受多种转录因子以及环境因素影响,其中atrogin-1作为E3泛素连接酶参与蛋白质泛素化降解[4],通过调节肌肉生长相关的转录因子来控制肌肉的质量,是参与肌肉萎缩的关键酶之一[5-6]。目前,国内对于黄鳝肌肉生长的生理机制研究甚少,因此对黄鳝肌萎缩基因atrogin-1的深入研究尤为重要。
atrogin-1(又称MAFBX,Fbxo32)是F-box家族的成员之一,该家族的蛋白质均包含1个约40个氨基酸的基序,即F-box。F-box是泛素蛋白连接酶复合物SCF(SKP1-cullin-F-box)的4个亚基之一,具有磷酸化依赖性泛素化作用[7-8]。在正常情况下,atrogin-1主要受生长因子IGF-1和胰岛素抑制,这2种生长因子通过AKT/FoxO以及AKT/mTOR通路发挥调节作用[9]。在饥饿、炎症情况下,机体内IGF-1和胰岛素含量下降[10],糖皮质激素含量升高,atrogin-1被激活,发挥泛素连接酶的作用,识别目的蛋白,使其发生泛素化降解[11]。目前,对atrogin-1基因的研究主要集中在骨骼肌和心肌中[12]。有研究表明,atrogin-1基因在斑马鱼及大西洋鲑其他组织中也有表达[13]。
为研究黄鳝atrogin-1蛋白的功能及细胞内定位,分别构建了atrogin-1的原核以及真核表达载体。重组蛋白在大肠杆菌中表达分为可溶性表达和非可溶性表达,真核生物的基因在原核表达过程中很容易形成包涵体,这种包涵体就是非可溶性表达[14]。由于包涵体无生物活性,因此分离纯化之后要对其进行复性处理,过程繁琐,且复性后的蛋白质折叠可能发生改变[15]。为了避免包涵体的形成,使用冷休克表达载体,以有效促进蛋白质的可溶性,并优化重组菌株的表达条件,旨在为atrogin-1蛋白的功能研究奠定基础。
1 材料和方法
1.1 材料
研究所用健康黄鳝购自江西瑞洪养殖场,置于实验室水族箱中养殖数周,使黄鳝稳定,每日喂食,水温(25±1)℃,每天用曝气自来水换水一次。
大肠杆菌DH5α购自生工生物工程(上海)股份有限公司,Transetta(DE3) 感受态细胞购自北京全式金生物技术有限公司。293T细胞、pEGFP-N1质粒、pET28a (+) 质粒、pGEX6P-1质粒和pCold-TF质粒由本实验室保藏。
1.2 主要试剂
SanPrep柱式DNA胶回收试剂盒、SanPrep柱式PCR产物纯化试剂盒、无水乙醇、DEPC、氨苄青霉素钠等均购自生工生物工程(上海)股份有限公司;DNaseⅠ、Prime STAR Max高保真酶、T4 DNA连接酶均购自宝生物工程(大连)有限公司;限制性内切酶EcoRⅠ、BamHⅠ、HindⅢ均购自Promega公司;动物组织总RNA提取试剂盒、RNA纯化试剂盒等购自天根生化科技(北京)有限公司;LipoD293TMDNA体外转染试剂盒购自SignaGen公司;Hoechst 33342购自Sigma公司。
1.3 RNA提取及 cDNA合成
利用动物组织总RNA提取试剂盒提取黄鳝肌肉总RNA,DNaseⅠ去除基因组DNA,并用RNA纯化试剂盒纯化,1%琼脂糖电泳检测,NanoDrop 2000测定RNA浓度及纯度。取纯化后的RNA进行反转录获得cDNA。反转录步骤:取1 μg左右的RNA、2 μL 60 μmol/L oligo dT,加无核酸酶水至10 μL。混匀后于70 ℃处理5 min,立即冰浴5 min,10 000×g离心1 min。加入5×M-MLV Buffer 5 μL、dNTP(2.5 mmol/L)2.5 μL、RNA酶抑制剂(40 U/μL)0.7 μL、M-MLV(200 U/μL)1 μL,加无核酸酶水至25 μL。42 ℃ 反应60 min,95 ℃ 变性5 min,-20 ℃保存。
1.4 atrogin-1基因的克隆
在GenBank数据库中搜索黄鳝atrogin-1基因(登录号:XM_020596809.1)。根据基因序列设计引物,上游引物引入BamHⅠ酶切位点及保护碱基,下游引物引入HindⅢ酶切位点及保护碱基(表1)。PCR 25 μL反应体系:cDNA 1 μL、上下游引物各0.5 μL(终浓度0.2 μmol/L)、Prime STAR Max(2×) 12.5 μL、灭菌去离子水10.5 μL。PCR反应程序:98 ℃变性10 s,55 ℃退火5 s,72 ℃延伸30 s,40个循环。1%琼脂糖凝胶电泳检测。
1.5 atrogin-1表达载体的构建与鉴定
将含有pCold-TF质粒的大肠杆菌,于37 ℃过夜摇培,用质粒提取试剂盒提取质粒,电泳检测。用BamHⅠ和HindⅢ 37 ℃过夜双酶切pCold-TF质粒及atrogin-1基因的PCR产物。对酶切产物切胶回收并进行电泳检测。连接反应体系:1 μL pCold-TF质粒、2.5 μL PCR酶切产物、1 μL T4连接酶Buffer、1 μL T4连接酶、4.5 μL灭菌去离子水。16 ℃过夜连接,连接产物转化至大肠杆菌DH5α中,对长出的克隆进行PCR检测,检测正确后送生工生物工程(上海)股份有限公司进行测序。将测序正确的菌株提取质粒,并转化到Transetta(DE3) 感受态细胞中。

表1 PCR引物序列Tab.1 PCR primer sequences
注:引物序列中下划线为相应酶切位点。
Note:The underlines are restriction enzyme cutting sites.
1.6 atrogin-1蛋白的诱导表达
蛋白质的诱导表达参考文献[16]中的方法。将含有atrogin-1重组质粒的Transetta(DE3) 菌接种到LB液体培养基中(氨苄青霉素和氯霉素的终质量浓度均为50 μg/mL),37 ℃条件下230 r/min培养。当细菌生长达到OD600=0.4~0.6时,加入终浓度为0.5 mmol/L的IPTG,于16 ℃继续培养。24 h后取出,离心弃上清,沉淀用平衡液(20 mmol/L Tris-HCl, pH值为7.5,10%甘油,0.5 mol/L NaCl)重悬,超声破碎。12 000 r/min离心取上清,同体积平衡液重悬沉淀,将菌体裂解液、上清、沉淀分别进行SDS-PAGE凝胶电泳,检测蛋白质表达情况。
1.7 诱导条件对atrogin-1蛋白表达的影响
1.7.1 atrogin-1蛋白可溶性表达载体的筛选 分别构建含有atrogin-1的pET28a(+)以及pGEX6P-1重组菌株,挑出阳性克隆,将测序正确的菌进行诱导表达。将过夜培养的重组菌按照1%的比例接种到含有抗生素的LB液体培养基中,于37 ℃培养至OD600为0.4~0.6,加入IPTG,使终浓度为0.5 mmol/L,16 ℃继续培养24 h,SDS-PAGE凝胶电泳检测蛋白质表达情况。
1.7.2 诱导剂浓度对atrogin-1蛋白表达的影响 将过夜培养的重组菌pCold-TF-atrogin-1/Transetta(DE3)按照1%的比例接种到LB液体培养基中(氨苄青霉素和氯霉素的终质量浓度均为50 μg/mL),于37 ℃摇床培养至OD600为0.4~0.6,分为7份,分别加入IPTG,使其终浓度分别为0、0.05、0.10、0.30、0.50、1.00、1.20 mmol/L,16 ℃继续培养24 h,SDS-PAGE凝胶电泳检测蛋白质表达情况。
1.7.3 诱导时间对atrogin-1蛋白表达的影响 将过夜培养的重组菌pCold-TF-atrogin-1/Transetta(DE3)按照1%的比例接种到LB液体培养基中(氨苄和氯霉素的终质量浓度均为50 μg/mL),于37 ℃培养至OD600为0.4~0.6,加入IPTG,使终浓度为0.5 mmol/L,16 ℃继续培养,分别在0、3、6、9、20、24 h时间点取样,SDS-PAGE凝胶电泳检测蛋白质表达情况。
1.8 atrogin-1蛋白的分离纯化
将诱导表达的大量重组菌超声破碎后,4 ℃条件下12 000 r/min离心1 h,取上清,用0.45 μm的滤膜过滤后,滤液过Ni-NTA亲和柱,然后用不同浓度的咪唑(20~1 000 mmol/L)对Ni-NTA亲和柱进行洗脱,收集不同浓度下的洗脱液,用10%的SDS-PAGE凝胶电泳进行检测。蛋白质浓度用Bradford法测定[17]。
1.9 atrogin-1基因的转染及在细胞中的定位
将pEGFP-N1质粒以及atrogin-1基因的PCR产物进行EcoRⅠ、BamHⅠ双酶切,用T4连接酶过夜连接,连接产物转化至大肠杆菌DH5α中,对长出的克隆进行PCR检测,检测结果正确后,提取质粒进行EcoRⅠ、BamHⅠ双酶切,将切出正确条带的质粒送生工生物工程(上海)股份有限公司测序。用无内毒素提取试剂盒提取质粒,测定质量浓度,进行细胞转染。在已长至单层的293T细胞中加入1 μg重组质粒pEGFP-N1-atrogin-1,按照LipoD293TMDNA体外转染试剂盒说明书操作,以pEGFP-N1质粒作为空白对照。36 h后用荧光显微镜观察转染情况。经荧光显微镜观察,若融合蛋白已表达,PBS缓冲液漂洗3次,每次5 min。加入终质量浓度为10 μg/mL的Hoechst 33342避光孵育15 min,PBS缓冲液漂洗3次,每次5 min。荧光显微镜下观察、拍照。蓝色荧光信号指示细胞核的位置,绿色荧光信号指示EGFP融合蛋白细胞定位。
2 结果与分析
2.1 atrogin-1基因的克隆结果
从GenBank数据库中获得黄鳝atrogin-1(Fbxo32)的mRNA序列(登录号:XM_020596809.1),确定黄鳝atrogin-1基因ORF为1 074 bp,编码357个氨基酸。利用设计的引物进行PCR扩增,1%琼脂糖凝胶电泳结果显示,扩增条带大小与目的基因大小一致(图1)。
2.2 pCold-TF-atrogin-1重组质粒的酶切鉴定结果
挑取阳性克隆进行菌落PCR,条带大小正确(图2泳道3、4)。将含有目的基因的重组菌过夜培养,提取质粒,用BamH Ⅰ和Hind Ⅲ进行双酶切,电泳检测条带大小正确,证明pCold-TF-atrogin-1载体构建成功(图2泳道1、2)。
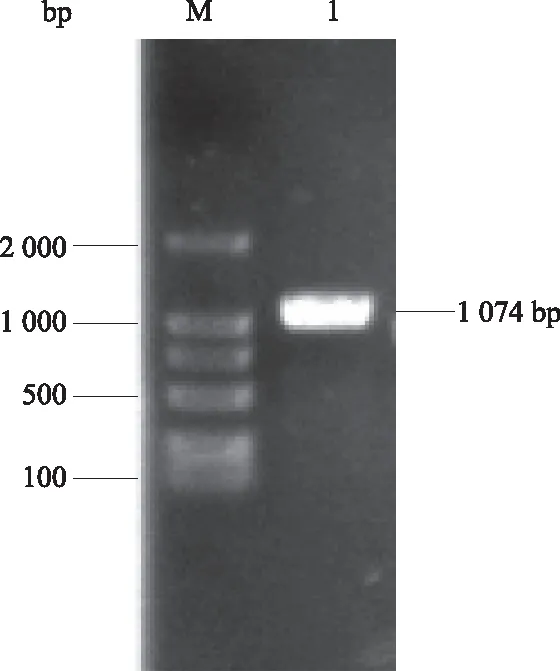
M:DL2000 DNA Marker;1:atrogin-1基因

M:DL10000 DNA Marker;1:pCold-TF-atrogin-1质粒;2:限制性内切酶BamH Ⅰ和Hind Ⅲ双酶切pCold-TF-atrogin-1质粒;M1:DL2000 DNA Marker;3、4:pCold-TF-atrogin-1的PCR验证
2.3 pCold-TF-atrogin-1重组质粒的表达产物分析
将含pCold-TF菌株和含有pCold-TF-atrogin-1的重组菌Transetta(DE3),在16 ℃用0.5 mmol/L IPTG诱导24 h。含pCold-TF菌株表达的蛋白质大小为54 ku,atrogin-1蛋白预测分子质量大小为41.8 ku,重组蛋白分子质量为95.8 ku,通过凝胶电泳检测条带大小与预测一致(图3)。
2.4 诱导条件对atrogin-1蛋白表达的影响
2.4.1 atrogin-1蛋白可溶表达载体的筛选 图4为16 ℃条件下用0.5 mmol/L的IPTG诱导24 h后蛋白质表达情况。结果显示,3种表达载体均可表达黄鳝atrogin-1蛋白,但是仅pCold-TF载体能够表达可溶性的atrogin-1融合蛋白,而以pET28a(+)和pGEX6P-1构建的重组载体,诱导表达时上清几乎没有融合蛋白,大部分的表达产物以包涵体的形式存在,不利于后续纯化和功能研究。因此,本研究选取pCold-TF作为atrogin-1的表达载体。
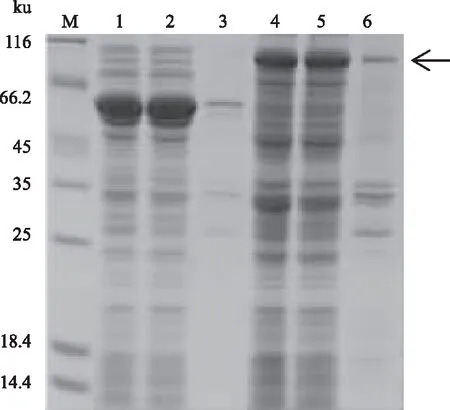
M:蛋白质Marker;1、2、3:pCold-TF菌体裂解液、上清、沉淀;4、5、6:重组质粒pCold-TF-atrogin-1的菌体裂解液、上清、沉淀
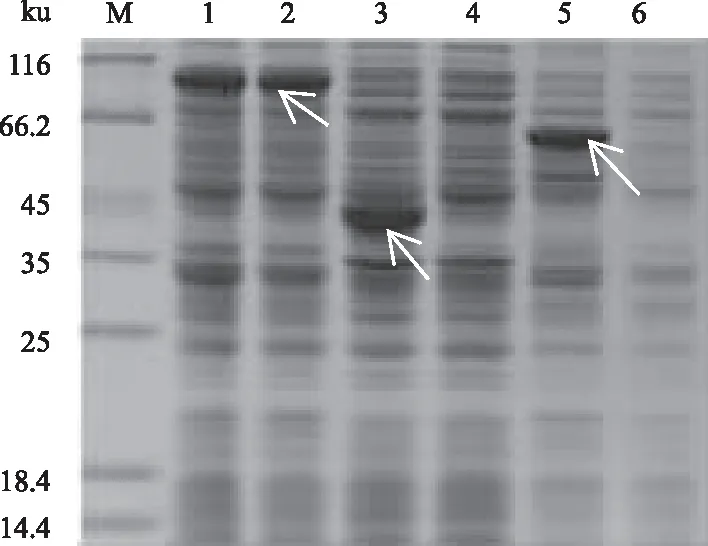
M:蛋白质Marker;1、 2:pCold-TF-atrogin-1菌体裂解液、上清;3、 4:pET28a(+)-atrogin-1菌体裂解液、上清;5、 6:pGEX6P-1-atrogin-1菌体裂解液、上清
2.4.2 诱导剂浓度对atrogin-1蛋白表达的影响 将含有pCold-TF-atrogin-1的重组菌Transetta(DE3)在16 ℃用不同浓度(0、0.05、0.10、 0.30、0.50、1.00、1.20 mmol/L)的IPTG诱导24 h,结果表明,0.05~1.20 mmol/L IPTG诱导条件下,蛋白质表达无明显差异(图5)。
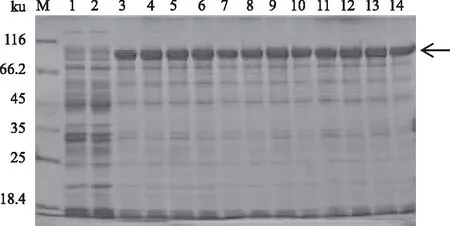
M:蛋白质Marker;1、3、5、7、9、11、13:pCold-TF-atrogin-1/Transetta(DE3)菌株分别用0、0.05、0.10、0.30、0.50、1.00、1.20 mmol/L IPTG诱导表达后的菌体裂解液;2、4、6、8、10、12、14:pCold-TF-atrogin-1/Transetta(DE3)菌株分别用0、0.05、0.10、 0.30、0.50、1.00、1.20 mmol/L IPTG诱导表达后菌体裂解液上清
2.4.3 诱导时间对atrogin-1蛋白表达的影响 图6为含有pCold-TF-atrogin-1的重组菌Transetta(DE3)在16 ℃用0.5 mmol/L IPTG诱导不同时间(0、3、6、9、20、24 h)的蛋白质表达情况。从图6可以看出,诱导3 h后,上清中有部分目的蛋白;20 h时,蛋白质量基本达到最大值;24 h之后,蛋白质表达无明显变化,且上清中可溶性蛋白量略有减少。可见,atrogin-1蛋白诱导20 h即可,诱导时间过长,反而使得部分蛋白质可溶性降低。
2.5 atrogin-1蛋白的分离纯化与浓度测定
将超声破碎后的菌液上清用Ni-NTA柱纯化,用不同浓度(20、40、60、80、100、200、500、1 000 mmol/L)的咪唑进行洗脱(图7)。结果表明,100 mmol/L和200 mmol/L的咪唑可以将大部分的杂蛋白洗脱;更高浓度的咪唑,如500 mmol/L、1 000 mmol/L的咪唑能够洗脱较为纯净的目的蛋白。收集500、1 000 mmol/L的咪唑洗脱液,浓缩脱盐后,于-80 ℃储存。
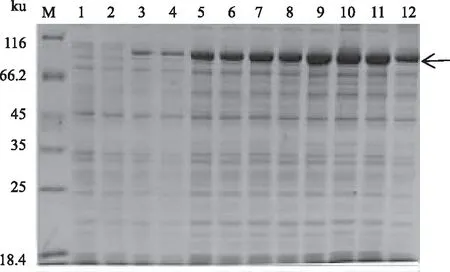
M:蛋白质Marker;1、3、5、7、9、11:pCold-TF-atrogin-1/Transetta(DE3)菌株诱导表达0、3、 6、9、20、24 h后的菌体裂解液;2、4、6、8、10、12:pCold-TF-atrogin-1/Transetta(DE3)菌株诱导表达0、3、 6、9、20、24 h后的菌体裂解液上清
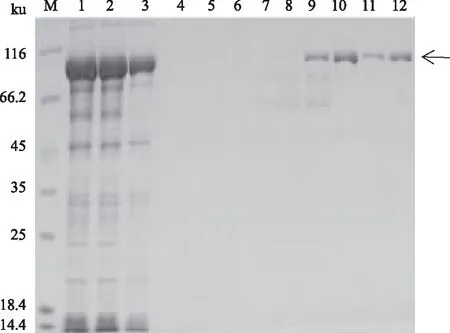
M:蛋白质Marker; 1:菌体裂解液; 2:滤膜滤过液; 3:流穿液; 4—10:0、20、40、60、80、100、200 mmol/L咪唑洗脱液; 11、12:500、1 000 mmol/L咪唑洗脱液
根据测得的OD值,制作蛋白质含量测定标准曲线,y=0.850 3x-0.009 1(R2=0.999),将测得的相应OD值带入计算,得到菌体裂解液、流穿液、蛋白洗脱液的蛋白质含量(表2)。纯化后收集得到的蛋白质含量约占总蛋白的43.35%。
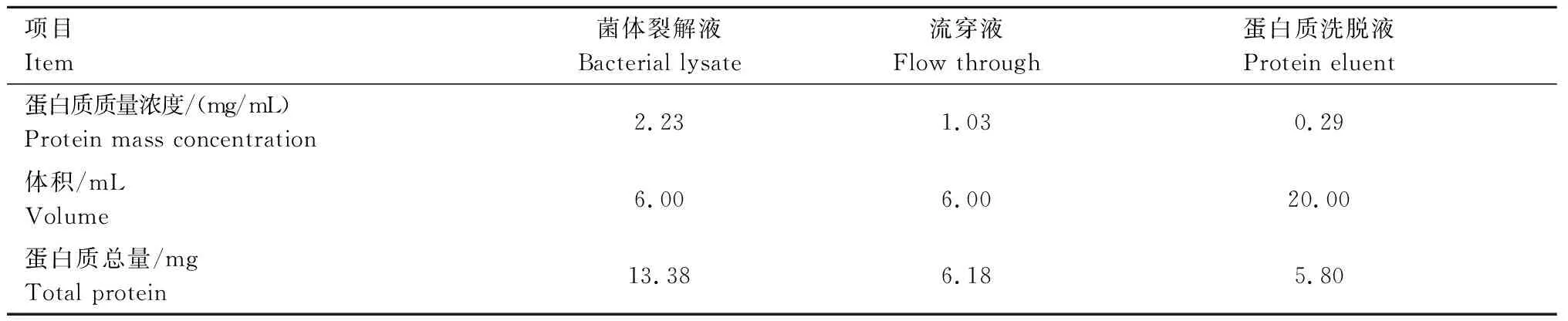
表2 atrogin-1蛋白得率分析
2.6 atrogin-1蛋白在293T细胞中的定位分析
转染后36 h在荧光显微镜下观察到绿色荧光,经Hoechst 33342 染料染色后,在紫外光下可以看到被染成蓝色的细胞核,EGPF蛋白和atrogin-1融合蛋白在293T细胞的细胞核及细胞质均有表达(图8)。

融合蛋白呈绿色 (EGFP),细胞核呈蓝色 (Hoechst 33342)
3 结论与讨论
本研究通过构建原核表达载体获取atrogin-1重组蛋白,并且对重组菌的表达进行条件优化,以期获得高纯度、高质量蛋白质。pCold-TF载体使用CspA启动子,诱导温度介于15~37 ℃,最适温度在15 ℃左右[14]。本研究发现,诱导剂的浓度对atrogin-1蛋白表达基本没有影响,这与曾发姣等[14]的研究结果一致,但与前人的研究结果不同。彭丹等[18]在Bn COP1蛋白(pCold-TF载体)表达研究中发现,最适IPTG浓度为0.8 mmol/L;而周波等[19]在乌桕SsSAD蛋白(pCold-TF载体)的表达研究中发现,最适IPTG浓度为0.6 mmol/L。本研究中,目的蛋白的表达量随着诱导时间的增加而增加,在诱导20 h后,蛋白质表达量达到最大值,20 h之后,可溶性蛋白的量略有减少。因此,pCold-TF-atrogin-1/Transetta(DE3)菌株诱导最适条件应为:16 ℃培养20 h左右;诱导剂浓度在0.05~1.00 mmol/L均可。可见,载体的选择对于蛋白质表达极为重要[20],在pET28a(+)以及pGEX6P-1的重组载体中,atrogin-1蛋白均能大量表达,但是都处于包涵体状态,对后续试验造成不必要的麻烦,而冷休克载体pCold-TF-atrogin-1能在低温条件下使其他蛋白质合成受到抑制,在IPTG诱导下,目的基因优先表达。
细胞转染结果表明,atrogin-1蛋白在细胞质及细胞核中均有表达,提示不同的蛋白质定位可能与其功能靶标相关。对黄鳝atrogin-1基因的研究不仅有助于了解黄鳝骨骼肌萎缩的机制,也对后续研究有着重要作用。治疗骨骼肌萎缩是目前世界难题之一,研究发现,泛素连接酶是骨骼肌萎缩的关键酶,作为泛素连接酶之一的atrogin-1有着较为广阔的研究前景。随着研究人员的不懈努力,发现了atrogin-1越来越多的功能。SKURK等[21]发现,atrogin-1在抑制心肌肥大方面有着重要作用;肌细胞生成素MyoG是骨骼肌分化的必需因子,JOGO等[22]发现,该因子与atrogin-1有着密切关系;真核翻译起始因子eIF3作为一个重要的调节因子,与atrogin-1存在着直接的相互作用[23];MyoD基因家族是参与调节肌肉发育以及分化的重要转录因子,MyoD能够被atrogin-1识别,从而被降解[11]。
本研究纯化后的蛋白质可用于后续atrogin-1抗体的制备和蛋白质表达模式研究,为atrogin-1的功能研究奠定基础。
