敲低lncRNA DILC对胶质瘤细胞体外生物学特性的影响
2020-05-23刘泉王新军王建业伍静
刘泉 王新军 王建业 伍静
脑胶质瘤为常见脑部肿瘤,放疗、化疗、手术等均为其公认治疗方法,但均无法有效预防复发、死亡等的发生,患者的整体预后状况仍不容乐观[1-3]。在脑胶质瘤等恶性肿瘤疾病中,肿瘤的侵袭转移是影响其治疗效果和预后的重要因素[4-5]。因此,对脑胶质瘤侵袭转移等生物学特性的干预有助于其疗效和预后的改善。长链非编码RNA(lncRNA)指的是长度大于200 bp 且无蛋白质编码能力的RNA 链,且已有研究证实lncRNA在脑胶质瘤发生发展中均具有重要影响[6-7]。本研究亦关注脑胶质瘤lncRNA,分析敲低lncRNA DILC 对胶质瘤细胞体外生物学特性的影响,旨在为胶质瘤早期诊治提供可能新策略,结果如下。
1 材料与方法
1.1 材料
胶质瘤细胞系LN382、U87MG 购自中科院上海生命科学院研究院生物化学与细胞生物学研究所,相关仪器如下:SW-CY-1F型净化工作台(苏州净化设备厂)、CO2恒温培养箱(美国Forman Scientific 公司)、离心机(德国Eppendorf 公司)、显微镜(日本Nikon 公司)、离心管、玻璃瓶、吸管、试管等(江苏佳美仪器有限公司)、低温冰箱(日本Sanyo公司)、PCR 基因扩增仪(美国BIORAD 公司)、电泳仪(北京六一仪器厂)、酶标仪(美国BIORAD 公司)、显微图像分析系统(美国Image 公司)相关试剂如下:Lipofectamine 2000 转染试剂(Invitrogen 公司)、RPMI-1640 培养基和胎牛血清(美国Gibco 公司)、RNA 提取试剂盒(德国Qiagen 公司)、逆转录试剂盒(美国Promega 公司)、实时定量PCR 试剂盒和SYBR Premix EX Taq(日本Takara 公司)、ddH2O(上海索宝生物科技有限公司)、胰蛋白酶(上海江莱生物科技有限公司)、JAK、STAT3、p-JAK2、p-STAT3 BCA 试剂盒(上海江莱生物科技有限公司)、多聚甲醛(武汉西祺生物科技有限公司)、结晶紫(北京酷来搏科技有限公司)、IL-6、p-JAK2、p-STAT3 PCR 扩增引物序列(上海生物工程公司)、人IL-6 ELISA 试剂盒(上海江莱生物科技有限公司)、Lnc RNA DILC siRNA、negative siRNA(上海吉玛制药技术有限公司)。
1.2 实验方法
1.2.1 分组和处理
胶质瘤细胞系LN382、U87MG 均培养在含15%胎牛血清的RPMI-1640 培养基中,放置在5%CO2、37℃恒温培养箱中培养,常规进行消化传代,并取对数生长期细胞进行相关实验研究。
胶质瘤细胞系LN382、U87MG 分别分组为NC组和敲低组。取各组对数生长期细胞接种于6 孔板中,细胞增长至70%融合时,通过Lipofectamine 2000 转染试剂进行细胞转染,其中NC组均以negative siRNA 转染,敲低组则以LncRNA DILC siRNA 转染,LncRNA DILC siRNA 序列为5′-AAGUGGAAGCGCAACAGGAAA-3′,而此序列打乱且并经分析不干扰任何基因表达的序列(5′-GAUAAAGGAAGGCAAGGACAC - 3′)则为negative siRNA。
1.2.2 PCR检测
转染前和转染后48 h,PCR检测IL-6、JAK2、STAT3 表达水平,细胞充分裂解提取总RNA,取2 μg 总RNA 逆转录形成cDNA。各引物序列(见表1)。PCR 反应体系:上游引物1 μg、下游引物1 μg、2×ES Reaction Mix 10 μL、d T18 1 μL、RIES Mix 1 μL,并补水至20 μL。PCR 反应条件如下:94℃5 min,94℃30 s、64℃30 s、72℃45 s,共33个循环后72℃延伸10 min。将获取的扩增产物行琼脂糖凝胶电泳,成像系统扫描,采用2-△△CT法进行各目标基因的mRNA 相对表达量分析。
1.2.3 ELISA 法检测
转染前和转染后48 h,ELISA 法检测离心细胞上清液中IL-6 水平,收集细胞上清液,1 600 r/min 转速、3 cm 半径离心5 min,分层后收取上清,根据人IL-6 ELISA 试剂盒以及酶标仪步骤指导进行IL-6 水平的检测。
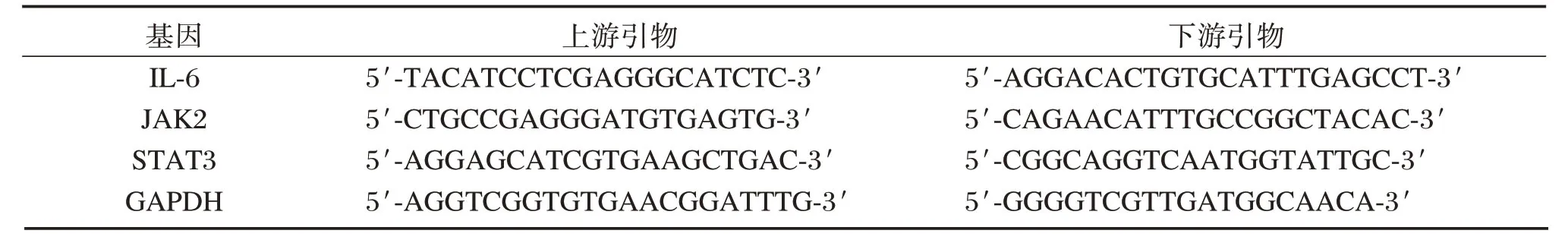
表1 引物序列表Table1 primer sequence table
1.2.4 Western Blot 法检测
转染前和转染后48 h,Western Blot 法检测JAK2、STAT3、p-JAK2 及p-STAT3 蛋白质表达水平,取待检测样本离心漂洗进行细胞裂解,再次离心处理后取上清液5 μL,通过BCA 法检测JAK2、STAT3、p-JAK2 及p-STAT3 蛋白浓度,具体的检测操作严格按照试剂盒说明书步骤进行。通过同一泳道条带灰度值的比值反应蛋白表达水平,计算p-JAK2/JAK2和p-STAT3/STAT3。
1.2.5 Transwell 小室侵袭实验
细胞转染后48 h,Transwell 小室侵袭实验[8]观察细胞的侵袭能力。
1.2.6 划痕实验细胞转染后48 h,Transwell 小室迁移划痕实验[9]观察细胞的转移能力状况。
1.3 统计学方法
采用SPSS 25.0 软件进行分析,计量资料比较均符合正态分布,以()表示,组建比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组LN382、U87MG 胶质瘤细胞侵袭和转移能力比较
细胞转染后48 h,与LN382、U87MG 胶质瘤细胞的NC组比较,其相应敲低组的穿膜细胞数增加,细胞迁移距离亦增加,差异有统计学意义(P<0.05)。见表2、图1和图2。
表2 各组LN382、U87MG 胶质瘤细胞侵袭和转移能力比较(±s)Table2 Comparison of invasion and metastasis ability of ln382 and U87MG glioma cells in each groups(±s)
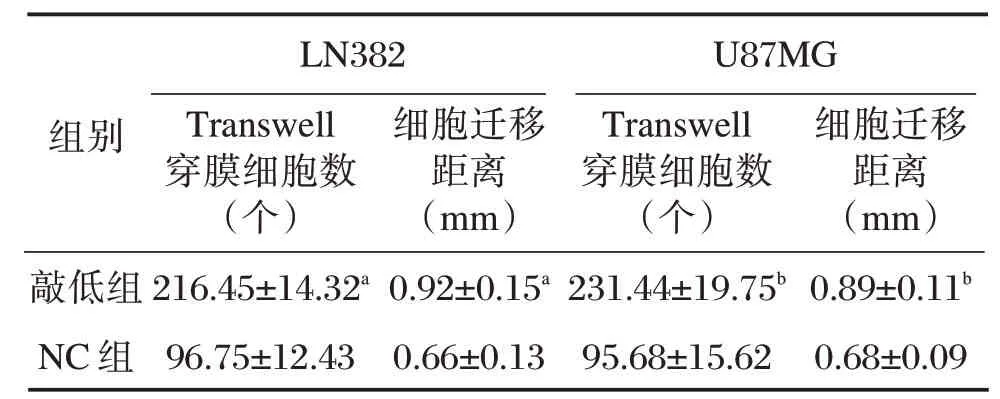
表2 各组LN382、U87MG 胶质瘤细胞侵袭和转移能力比较(±s)Table2 Comparison of invasion and metastasis ability of ln382 and U87MG glioma cells in each groups(±s)
注:与NC组比较,aP<0.05,bP<0.05。
组别敲低组NC组LN382 Transwell穿膜细胞数(个)216.45±14.32a 96.75±12.43细胞迁移距离(mm)0.92±0.15a 0.66±0.13 U87MG Transwell穿膜细胞数(个)231.44±19.75b 95.68±15.62细胞迁移距离(mm)0.89±0.11b 0.68±0.09
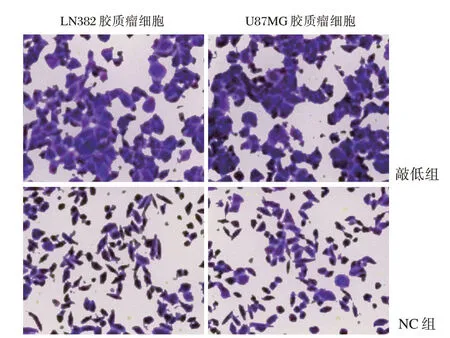
图1 各组侵袭实验结果(结晶紫染色,×400)Figure1 Results of invasion experiment in each groups(结晶紫染色,×400)
2.2 各组LN382、U87MG 胶质瘤细胞IL-6、JAK2、STAT3的mRNA相对表达量比较
与LN382、U87MG 胶质瘤细胞的NC组比较,其相应敲低组的IL-6、JAK2、STAT3的mRNA 相对表达量升高,差异有统计学意义(P<0.05)。见表3。
2.3 LN382、U87MG 胶质瘤细胞各组IL-6、JAK2、STAT3 蛋白质表达水平比较
细胞上清液中IL-6 水平升高,p-JAK2/JAK2和p-STAT3/STAT3 蛋白质表达水平亦相应升高,差异有统计学意义(P<0.05)。见表4。
3 讨论

图2 各组迁移实验结果Figure2 Results of migration experiment in each groups
脑胶质瘤是颅内常见恶性肿瘤,为常见中枢神经系统肿瘤疾病之一,其发生率呈现逐年递增趋势,是目前研究热门肿瘤疾病之一。脑胶质瘤疾病的临床治疗方案中以手术切除治疗为主,术后常辅以放化疗等辅助治疗,但这样的治疗方案虽然一直在不断优化改进,大部分恶性胶质瘤患者的预后状况仍较差[10-11]。多数恶性肿瘤具有较强的侵袭转移能力,邻近组织侵袭以及远处转移可加重其治疗的困难程度,进而影响疗效和预后状况[12-13]。
近年来的研究表明,多个lncRNA的异常表达状况与脑胶质瘤发生发展以及疾病复发等预后状况密切相关[14]。如陶海云等人[15]的研究中,LINC00152与脑胶质瘤侵袭转移相关,而抑制LINC00152 表达可达到抑制脑胶质瘤细胞侵袭转移的效果。郑杰灵等人[16]的研究亦表明Lnc RNA TCONS_00008552 在胶质瘤放疗抵抗株中的表达水平较高,在脑胶质瘤细胞放疗抵抗中具有促进作用,且在脑胶质侵袭转移中亦具有促进作用。lncRNA DILC 亦是与恶性肿瘤密切相关lncRNA 之一,其在肝癌中的表达出现明显下调,可抑制肝癌干细胞扩增[17]。本研究亦关注脑胶质瘤lncRNA DILC 在胶质瘤细胞侵袭转移等生物学特性中的作用,并分析了其可能作用机制,可为通过lncRNA DILC 检测干预达到胶质瘤早期诊治,从而改善疗效和预后提供依据。
表3 各组LN382、U87MG 胶质瘤细胞IL-6、JAK2、STAT3的mRNA相对表达量比较(±s)Table3 Comparison of relative mRNA expression of IL-6,jak2 and STAT3 in ln382 and U87MG glioma cells in each groups(±s)
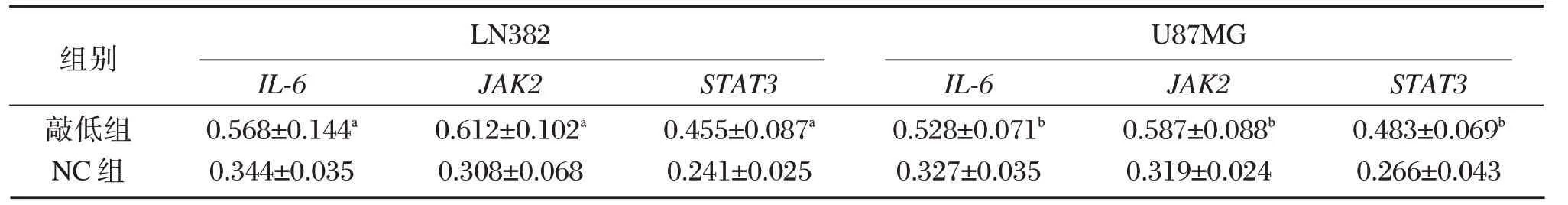
表3 各组LN382、U87MG 胶质瘤细胞IL-6、JAK2、STAT3的mRNA相对表达量比较(±s)Table3 Comparison of relative mRNA expression of IL-6,jak2 and STAT3 in ln382 and U87MG glioma cells in each groups(±s)
注:与NC组比较,aP<0.05,bP<0.05。
组别敲低组NC组LN382 IL-6 0.568±0.144a 0.344±0.035 JAK2 0.612±0.102a 0.308±0.068 STAT3 0.455±0.087a 0.241±0.025 U87MG IL-6 0.528±0.071b 0.327±0.035 JAK2 0.587±0.088b 0.319±0.024 STAT3 0.483±0.069b 0.266±0.043
表4 LN382、U87MG 胶质瘤细胞各组IL-6、JAK2、STAT3 蛋白质表达水平比较(±s)Table4 Comparison of protein expression levels of IL-6,JAK2 and STAT3 in ln382 and U87MG glioma cells in each groups(±s)

表4 LN382、U87MG 胶质瘤细胞各组IL-6、JAK2、STAT3 蛋白质表达水平比较(±s)Table4 Comparison of protein expression levels of IL-6,JAK2 and STAT3 in ln382 and U87MG glioma cells in each groups(±s)
注:与NC组比较,aP<0.05,bP<0.05。
组别敲低组NC组LN382 IL-6(ng/L)85.66±6.64a 27.51±5.75 p-JAK2/JAK2 0.462±0.009a 0.263±0.016 p-STAT3/STAT3 0.626±0.112a 0.215±0.035 U87MG IL-6(ng/L)82.16±8.13b 23.58±5.29 p-JAK2/JAK2 0.431±0.024b 0.255±0.007 p-STAT3/STAT3 0.651±0.082b 0.223±0.047
本研究结果提示lncRNA DILC与LN382、U87MG 胶质瘤细胞体外侵袭转移等生物学特性相关,而其表达抑制可能促进脑胶质瘤的侵袭转移,而提高其表可能有助于脑胶质瘤侵袭转移干预。本研究中,结果提示IL-6/JAK2/STAT3 信号通路可能为lncRNA DILC 影响脑胶质瘤侵袭转移的重要信号通路,具体可能为lncRNA DILC 低表达可能促进IL-6/JAK2/STAT3 信号通路活化,从而促进血管内皮生长因子表达,抑制胶质纤维酸性蛋白转录,影响星形胶质细胞提供细胞骨架稳定性,从而促进脑胶质瘤细胞的迁移。
综上所述,lncRNA DILC与胶质瘤密切相关,敲低lncRNA DILC 可激活IL-6/JAK2/STAT3 信号通路,促进胶质瘤细胞的侵袭转移,因此,对lncRNA DILC 及其相关信号通路IL-6/JAK2/STAT3 信号通路干预可能为脑胶质瘤有效干预途径。
