血尿酸和胰岛功能与2型糖尿病患者血液流变学相关性分析
2020-05-23杜金红王中正郭亚娜
杜金红 王中正 郭亚娜
2型糖尿病(Type 2 diabetes mellitus,T2DM)主要特征为慢性血糖水平呈进行性升高,流行病学调查显示,目前全球约有糖尿病患者1.8亿,预测到2030年将增加>1倍[1-2]。相关研究发现,糖尿病患者普遍存在血液流变学障碍,可增高血液黏度,提高血细胞聚集性,引发糖尿病微血管病变,增加致残致死风险[3]。另外,研究还指出,高血糖、胰岛素功能紊乱一定程度上可影响胰岛素控制血管内皮细胞、平滑肌细胞及肾小球系膜细胞对葡萄糖的摄取,增加细胞内血糖水平,从而诱发细胞病理性改变,促使微血管病变发生发展[4]。同时,学者认为,初诊T2DM患者在控制血糖、血压、血脂及体质量的同时,更应调控血尿酸(Uric acid,UA)水平、改善血液流变学,进一步抑制或延缓病情进展[5]。基于此,本研究以UA、空腹胰岛素(Fasting plasma insulin,FINS)、空腹C 肽(Fasting C-peptide,FCP)作为观察指标,通过观察其与T2DM患者血液流变学相关性,旨在为临床预防微血管病变发生提供更多循证依据。具体分析如下。
1 资料和方法
1.1 一般资料
选取2018年1月至2018年12月在本院收治的176例T2DM患者作为研究对象,其中微血管病变84例、无微血管病变92例。根据血液流变学分为血液黏度正常组(72例)、血液黏度升高组(104例)。2组年龄、性别、体质量指数、糖化血红蛋白(HbAlc)、腰围等基本资料比较,差异无统计学意义(P>0.05),但具有可比性。两组病程、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、总胆固醇(TC)、全血黏度200、全血黏度30、全血黏度5、全血黏度1、血浆黏度200 相比,差异具有统计学意义(P<0.05),见表1。所有患者及家属均已签署知情同意书。研究经我院医学伦理委员会批准。
表1 2组一般资料比较(±s)Table1 Comparison of general data of 2 groups(±s)
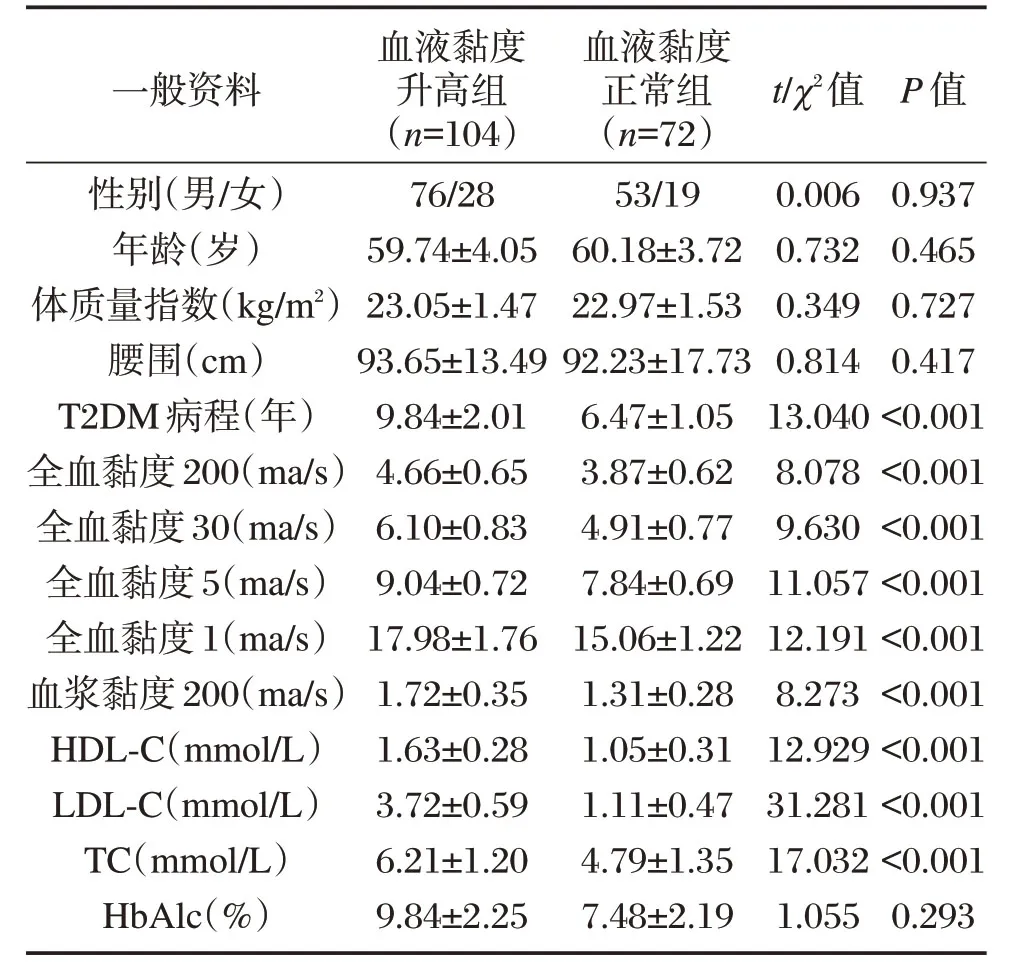
表1 2组一般资料比较(±s)Table1 Comparison of general data of 2 groups(±s)
一般资料性别(男/女)年龄(岁)体质量指数(kg/m2)腰围(cm)T2DM 病程(年)全血黏度200(ma/s)全血黏度30(ma/s)全血黏度5(ma/s)全血黏度1(ma/s)血浆黏度200(ma/s)HDL-C(mmol/L)LDL-C(mmol/L)TC(mmol/L)HbAlc(%)血液黏度升高组(n=104)76/28 59.74±4.05 23.05±1.47 93.65±13.49 9.84±2.01 4.66±0.65 6.10±0.83 9.04±0.72 17.98±1.76 1.72±0.35 1.63±0.28 3.72±0.59 6.21±1.20 9.84±2.25血液黏度正常组(n=72)53/19 60.18±3.72 22.97±1.53 92.23±17.73 6.47±1.05 3.87±0.62 4.91±0.77 7.84±0.69 15.06±1.22 1.31±0.28 1.05±0.31 1.11±0.47 4.79±1.35 7.48±2.19 t/χ2值0.006 0.732 0.349 0.814 13.040 8.078 9.630 11.057 12.191 8.273 12.929 31.281 17.032 1.055 P 值0.937 0.465 0.727 0.417<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001<0.001 0.293
1.2 选取标准
纳入标准:①均符合《2017 VA/DoD 临床实践指南:2型糖尿病的管理》[6]中T2DM 诊断标准;②空腹血糖(FPG)≥7.0 mmol/L 或餐后2 h 血糖(2hFPG)≥11.1 mmol/L;③临床资料完整者;④全血黏度200>4.32 ma/s、全血黏度30>5.45 ma/s、全血黏度5>8.53、全血黏度1>17.91 ma/s、血浆黏度200>1.70 ma/s 中2项及以上存在则判定为血液黏度升高;⑤患者及家属知情并签署同意书。排除标准:①1型糖尿病者;②肝肾等重要脏器器质性病变者;③血压>160/100 mmHg 者;④感染、外伤、胰腺炎等应激状态者;⑤合并糖尿病酮症酸中毒、高渗状态或其他糖尿病急性并发症者;⑥严重心脑血管疾病者;⑦既往有甲状腺、呼吸睡眠暂停综合征、风湿免疫系统疾病、肿瘤者;⑧近期存在糖皮质激素治疗史者;⑨继发性或原发性失语症、认知功能障碍、意识不清或精神行为异常者。
1.3 方法
入院后晨起空腹取3 mL 静脉血,离心15 min,3 000 r/min,分离取血清,置于-20℃冰箱低温保存,以全自动电化学发光免疫仪(型号:MODULAR P800)以电化学发光免疫法检测血清UA、FINS、FCP水平,仪器与试剂盒均购自德国罗氏公司,严格按照仪器与试剂盒说明书操作。
1.4 观察指标
①对比2组血清UA、FINS、FCP水平。②T2DM血液流变学改变的影响因素。③血清UA、FINS、FCP水平与血液流变学相关性。④根据T2DM患者有无微血管病变分为84例微血管病变者、92例无微血管病变者。对比微血管病变与无微血管病变者血清UA、FINS、FCP水平。⑤血清UA、FINS、FCP水平与微血管病变相关性。
1.5 统计学方法
采用SPSS 22.0 软件分析处理数据,计量资料采用()表示,组间比较用t检验,通过Logistic进行多因素回归分析,采用Person 进行相关性分析,P<0.05 表示差异有统计学意义。
2 结果
2.1 2组血清UA、FINS、FCP水平
血液黏度升高组血清UA、FINS、FCP水平高于血液黏度正常组,差异具有统计学意义(P<0.05),见表2。
表2 2组血清UA、FINS、FCP水平比较(±s)Table2 Comparison of serum UA,fins and FCP levels in 2 groups(±s)
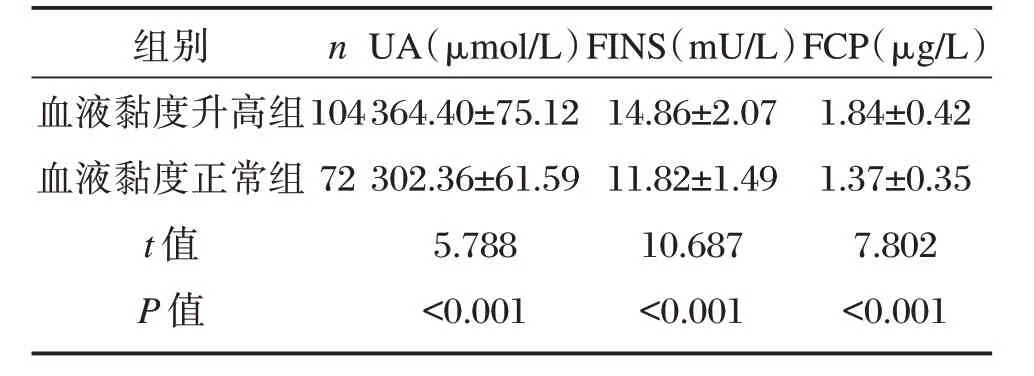
表2 2组血清UA、FINS、FCP水平比较(±s)Table2 Comparison of serum UA,fins and FCP levels in 2 groups(±s)
组别血液黏度升高组血液黏度正常组t 值P 值n 104 72 UA(μmol/L)364.40±75.12 302.36±61.59 5.788<0.001 FINS(mU/L)14.86±2.07 11.82±1.49 10.687<0.001 FCP(μg/L)1.84±0.42 1.37±0.35 7.802<0.001
2.2 T2DM血液流变学改变的影响因素
以T2DM血液流变学(血液黏度正常赋值为1,血液黏度升高赋值为2,高黏血症赋值为3)作为因变量,将病程、血清UA、FINS、FCP水平作为自变量,纳入Logistic回归分析,结果显示,病程、血清UA、FINS、FCP水平是T2DM血液流变学改变的重要影响因素(P<0.05),见表3。
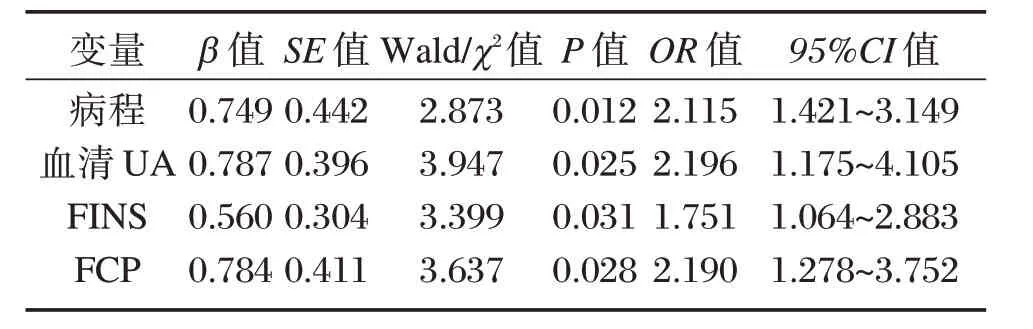
表3 T2DM血液流变学改变的影响因素Table3 Influencing factors of hemorheology changes in T2DM
2.3 血清UA、FINS、FCP水平与血液流变学相关性
经Person 相关系数分析,血清UA(r=0.385)、FINS(r=0.428)、FCP(r=0.507)水平与血液流变学呈正相关(P<0.05),见图1。

图1 血清与血液流变学相关性分析图Figure1 Correlation analysis of serum and hemorheology
2.4 微血管病变与无微血管病变者血清UA、FINS、FCP水平
微血管病变者血清UA、FINS、CP水平高于无微血管病变者,差异具有统计学意义(P<0.05),见表4。
2.5 血清UA、FINS、FCP水平与微血管病变相关性
微血管病变赋值“0”=无,“1”=有,经Person 相关系数分析,血清UA(r=0.353)、FINS(r=0.364)、FCP(r=0.484)与微血管病变呈正相关(P<0.05),见图2。
表4 血清UA、FINS、FCP水平与微血管病变比较(±s)Table4 Comparison of serum UA,fins and FCP levels with microvascular diseases(±s)
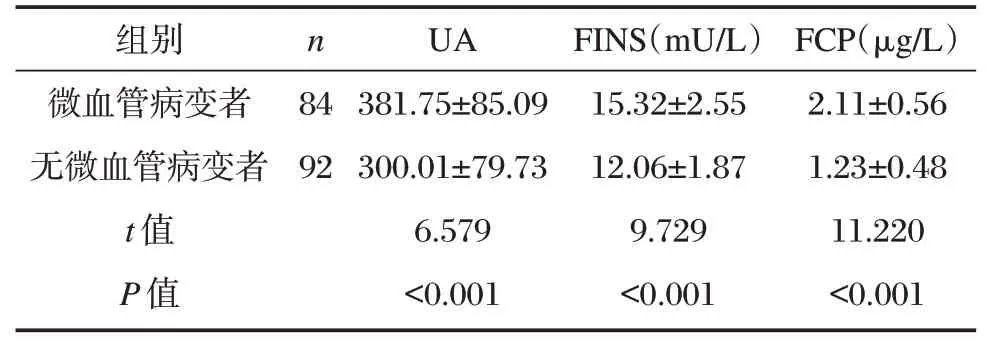
表4 血清UA、FINS、FCP水平与微血管病变比较(±s)Table4 Comparison of serum UA,fins and FCP levels with microvascular diseases(±s)
组别微血管病变者无微血管病变者t 值P 值n 84 92 UA 381.75±85.09 300.01±79.73 6.579<0.001 FINS(mU/L)15.32±2.55 12.06±1.87 9.729<0.001 FCP(μg/L)2.11±0.56 1.23±0.48 11.220<0.001
3 讨论
近年来,随我国人口老龄化趋势加剧,T2DM患病人数呈逐年递增态势[7-8]。相关研究表明,糖尿病患者血液处于高凝、高黏状态,易造成局部组织缺血、缺氧,增加微血管病变发生率[9]。因此及时明确血液流变学改变因素,对延缓T2DM 病情、预防微血管病变发生具有积极作用。
UA 属人体嘌呤代谢产物,经由机体核酸代谢形成,资料显示,代谢紊乱时,血液中UA水平增高,可提高心血管发病率,引发肾脏损伤。同时,彭喜涛等[10]研究发现,UA水平异常是T2DM患者颈动脉硬化病变的危险因素。本研究结果表明,血清UA水平在血液黏度升高患者中呈异常表达状态,与楼标雷等[11]、张秀萍等[12]研究相似。表明UA在T2DM患者血液流变学改变发生、发展中具有重要作用。结合文献分析机制可能为:T2DM患者具有高水平胰岛素及胰岛素前体物质,可刺激肾小管Na+-K+交换,增加H+排泄,促使UA 等阴离子重吸收,提高UA水平,且胰岛素抵抗状态下,3-磷酸甘油脱氢酶活性削弱、糖酵解过程中间产物5-磷酸核糖转移、嘌呤代谢紊乱均可增加UA水平[13]。另外,经Logistic回归性分析结果显示,血清UA水平是T2DM血液流变学改变的重要影响因素,并在微血管病变者中呈高表达状态,与刘艳萍[14]研究相似。李双等[15]研究也证实,高尿酸血症可促进糖尿病大血管病变、微血管病变、神经病变、糖尿病足等的发生发展,提示临床应警惕血清UA水平升高,以防微血管病变发生。
资料显示,高胰岛素血症可损伤血管内皮细胞,刺激产生纤溶酶原激活物抑制剂,加重血液高凝状态,诱发血管疾病[16-17]。同时,相关研究认为,血液黏度是影响糖尿病微血管病变发生发展的重要因素[18]。本研究数据表明,血清FINS、FCP水平在血液黏度升高中呈异常表达,并与血液流病学异常呈正相关。纪秋媛[19]研究也证实T2DM患者FCP水平及其所反映胰岛素抵抗程度可能是血浆纤维蛋白原水平升高的危险因素。基于上述研究经Person 相关系数进一步发现,血清UA、FINS、FCP与微血管病变呈正相关。充分表明血清UA、FINS、FCP水平可作为T2DM患者预后的预测因子,警惕微血管病变发生。
综上可知,血清UA、FINS、FCP 是T2DM患者血液流变学改变的危险因素,与血液流变学改变、微血管病变呈正相关,动态监测上述血清指标水平,可为临床评估预后提供科学循证指导。
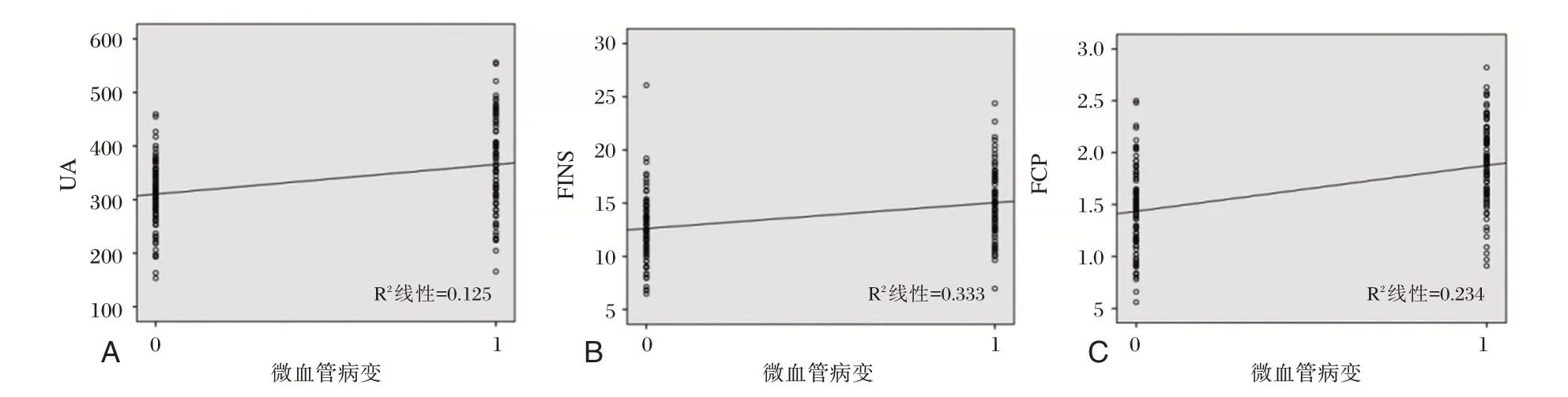
图2 血清与微血管病变相关性分析图Figure2 Correlation analysis of serum and microangiopathy
