新鲜冷冻和福尔马林固定石蜡包埋胃黏液腺癌组织中miRNA表达谱的比较
2020-05-22张梦岚贺菊香王丰梅
张梦岚,贺菊香,潘 莉,巩 雪,王丰梅
我国胃癌的病死率位居全部恶性肿瘤的第2位[1]。自1993年miRNA被首次报道以来[2],miRNA与肿瘤的研究取得了较大的进展。在胃癌中的研究显示,miRNA在胃癌的增殖、迁移和侵袭中发挥重要作用,而且参与了肿瘤的发生、发展,并与肿瘤的疗效、临床病理特征及预后等关系十分密切[3-4],所以miRNA很有可能成为胃癌早期筛查、预后判断及疗效评估的标志和靶点。但由于样本保存方法、病理类型、研究方法或样本来源地域差异等各种原因,导致胃癌组织中miRNA的研究结论不完全一致,甚至出现互相矛盾的结果[5-7]。因此,本实验用miRNA芯片技术对新鲜冷冻和福尔马林固定石蜡包埋配对的同一组织学类型的胃黏液腺癌组织中miRNA的表达谱,进行了筛查对比和统计分析,以初步探讨不同方法保存的同一胃癌组织类型中miRNA的表达普是否存在差异。
1 材料与方法
1.1 材料 实验标本来自2017年在青海省人民医院手术的胃癌患者,合计6例。新鲜冷冻组织由手术医师在手术过程中切取,并将所取组织块分为2份,一份迅速放入液氮罐中冷冻,后期转至-80 ℃超低温冰箱保存。一份由福尔马林固定石蜡包埋以便后期病理学核实是否切取到肿瘤及肿瘤组织所占整块组织的比例(肿瘤组织占比)。福尔马林固定石蜡包埋组织是经10%中性福尔马林固定,由病理医师取材后石蜡包埋而成的常规蜡块。所取组织块的质量均约为100 mg。术中所取的新鲜组织和福尔马林固定石蜡包埋组织经切片、染色后,由临床病理医师进行复诊,挑选癌组织占比均在50%以上,胃癌组织学类型均为胃黏液腺癌,并且患者术前未行任何放、化疗的6对配对样本进行芯片检测实验,并采集临床病理资料。6例样本的基本信息、病理特征及肿瘤组织在取材组织块中所占的比例情况见表1。
1.2 LC Sciences 芯片杂交实验基本过程 提取新鲜冷冻和石蜡包埋组织样本的总RNA,用Agilent 2100 bioanalyzer进行RNA数量和质量的测定,质检合格后样本进行芯片微阵列杂交实验。
微阵列实验由LC Sciences公司进行。微阵列实验使用5 μg总RNA样本。使用Poly(A)聚合酶在总RNA 3′端加上Poly(A)尾巴,再将一个寡聚核苷酸标记与该Poly(A)尾巴连接用于后续的荧光标记。杂交反应利用微循环泵在μParaflo微流体芯片上过夜进行。杂交使用含有25%甲酰胺的100 μL 6×SSPE缓冲液,杂交温度为34 ℃。RNA与探针杂交后,与标记特异结合的Cy3染料在微流体芯片上循环流动进行染色。利用激光扫描仪(GenePix 4000B,Molecular Device)采集杂交图像并使用Array-Pro图像分析软件(Media Cybernetics)进行图像数字化转换。数据分析首先是减除背景值,然后使用LOWESS过滤后进行信号归一化。总RNA的提取,质量检测,芯片杂交及结果分析均由杭州联川生物公司完成。

表1 6例样本的基本信息、临床病理特征及肿瘤组织的占比
1.3 数据处理 激光扫描仪采集芯片杂交图像后进行图像数字化转换,然后原始数据进行背景值减除,转化为以2为底的对数(log2),利用Transcriptome AnalysisConsole(美国Affymetrix公司)软件进行差异分析检出两组样本差异表达的miRNA,然后采用t检验的统计学方法对差异表达的miRNA进行差异显著性检验,以P<0.05为差异有统计学意义。并对新鲜冷冻和石蜡包埋样本的miRNA表达谱进行Pearson相关性及主成分分析(principal component analysis,PCA)分析,评估配对样本间miRNA表达谱的相关性及样本聚类情况。
2 结果
2.1 新鲜冷冻与福尔马林固定石蜡包埋胃癌样本中提取总RNA的质量及含量检测 两组样本提取总RNA后经Agilent 2100 bioanalyzer检测发现,术中取材后立即投入液氮后转至-80 ℃超低温冰箱保存的新鲜冷冻样本中提取的总RNA质量较高,6个样本均有不同峰值的28 S和18 S波峰,完整度符合28 S是18 S的1~2倍范围要求(图1)。福尔马林固定石蜡包埋样本中提取的总RNA有相对比较明显的降解,在6个样本中28 S和18 S的波峰均不明显(图2)。提取的样本RNA虽有部分降解,但在miRNA近25 nt处波峰明显,说明两组标本中的miRNA保存度完整,达到miRNA芯片杂交要求,可以进行下游实验。
2.2 芯片检测配对新鲜冷冻和福尔马林固定石蜡包埋胃癌组织中的miRNA表达谱 芯片杂交完成后,进行图像扫描,转换成数据并进行背景及归一化处理后数据经过统计学t检验,发现新鲜冷冻组织和福尔马林固定石蜡包埋两组样本中miRNA的表达谱差异有显著性,如果以P<0.05为检验水准则两组差异表达的miRNA有114个(图3)。如果P<0.01为检验水准,则两组有显著差异表达的miRNA有16个(图4)。

图1 新鲜冷冻标本中提取的总RNA质量检测结果:A~F.样本1~6的新鲜冷冻标本,纵坐标FU为荧光值,横坐标nt为核苷酸数
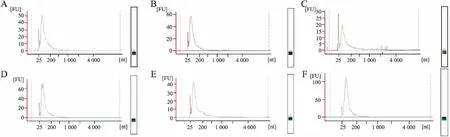
图2 福尔马林固定石蜡包埋样本中提取的总RNA质量检测结果:A~F.样本1~6的福尔马林固定石蜡包埋标本,纵坐标FU为荧光值,横坐标nt为核苷酸数
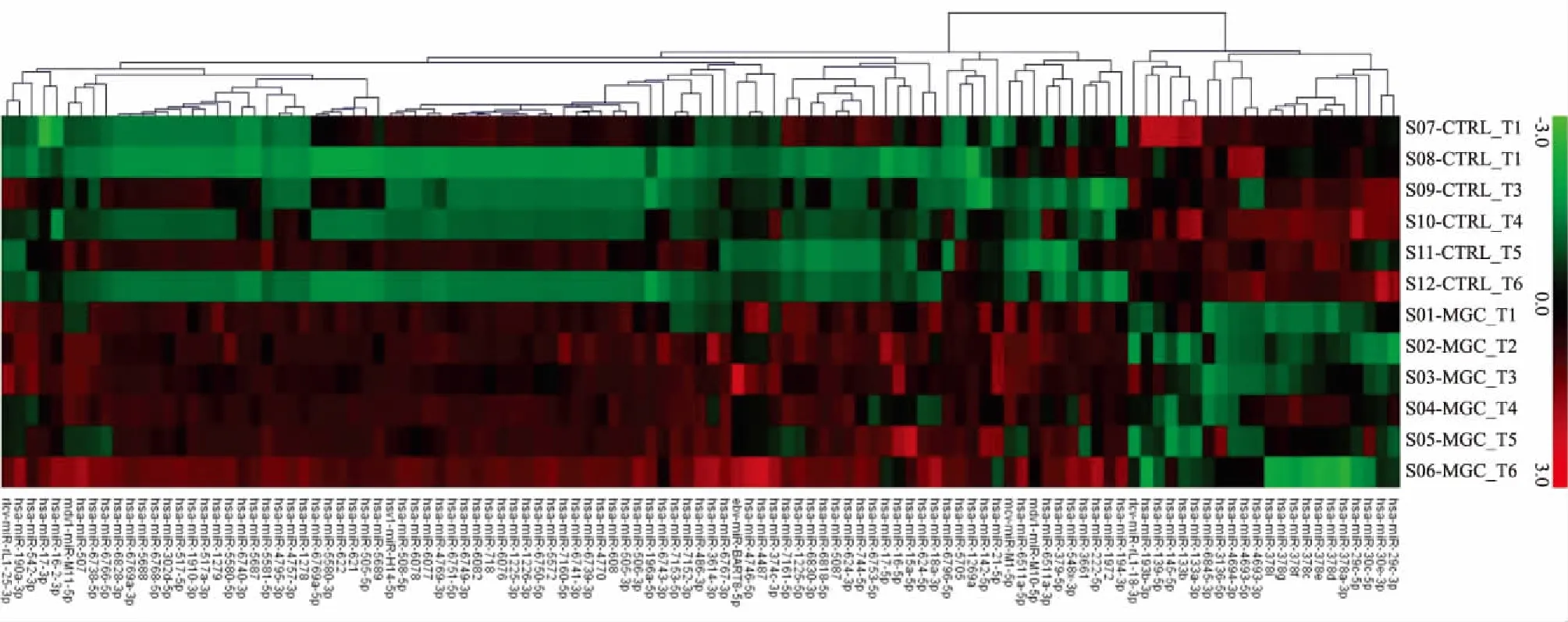
图3 新鲜冷冻和福尔马林固定石蜡包埋样本中差异表达的miRNA聚类图(P<0.05)
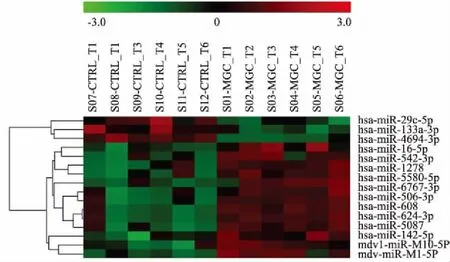
图4 新鲜冷冻和福尔马林固定石蜡包埋样本中差异表达的miRNA聚类图(P<0.01)
2.3 miRNA芯片杂交数据统计结果按差异倍数再筛选 miRNA芯片杂交数据统计结果在筛选差异表达的miRNA时除了考虑统计学的检验水准P值以外,另一重要的因素就是Fold Chang即差异倍数,比较组和对照组基因表达量平均值的差异倍数越大,说明差异越显著。常规标准是Fold Change (log2)≥1或Fold Change(log2)≤-1。为了显示两组间差异更显著的miRNA,常用的标准是Fold Change的绝对值≥2。本实验结果以Fold Change的绝对值≥2进行再次筛选,结果两组间分别有76个(P<0.05)和14个(P<0.01)miRNA呈显著差异表达。
2.4 检测样本miRNA表达谱的PCA PCA分析结果所示(图5),主成分1(PC1)、主成分2(PC2)的累积贡献率达90%。从图中看出miRNA表达谱因样本是新鲜冷冻或石蜡包埋的类型不同而有所差异,并且6例福尔马林固定石蜡包埋样本比新鲜冷冻样本miRNA的表达谱聚类更好,即新鲜冷冻组的离散度比福尔马林固定石蜡包埋组大,尤其是新鲜冷冻组的4号和6号样本的离散度较大。
2.5 Pearson检验 为测定配对新鲜冷冻和福尔马林固定石蜡包埋胃癌样本基因表达谱的一致性,进行了Pearson相关性检验(图6)。配对的新鲜冷冻和福尔马林固定石蜡包埋样本中样本1、2、3、4、5对之间呈极强相关关系(相关系数样本1为0.95,样本2为0.97,样本3为0.99,样本4为0.97,样本5为0.81),样本6为强相关关系(相关系数为0.69)。
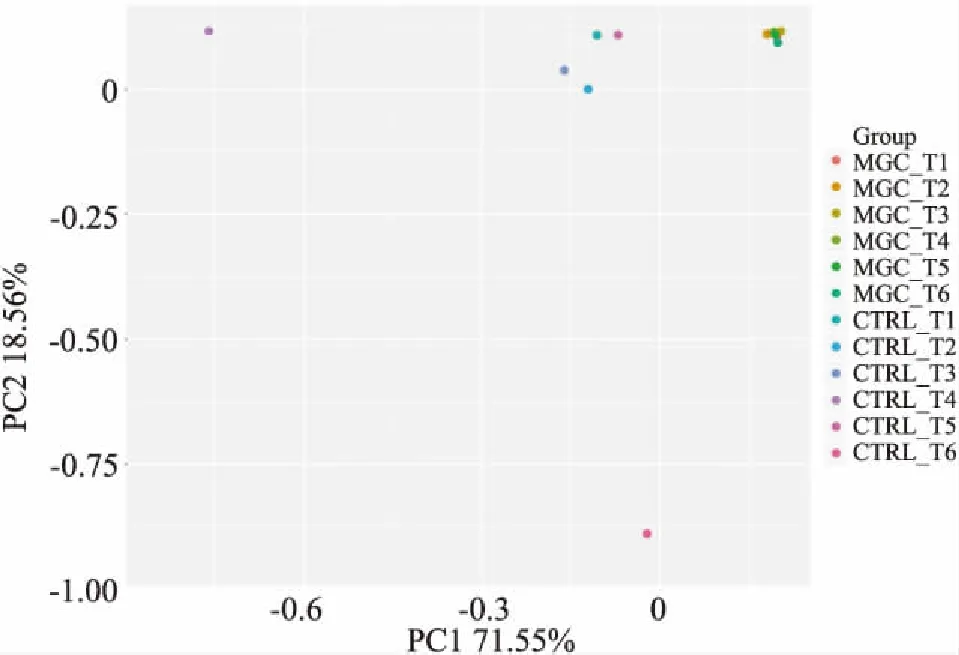
图5 样本miRNA表达谱的PCA分析
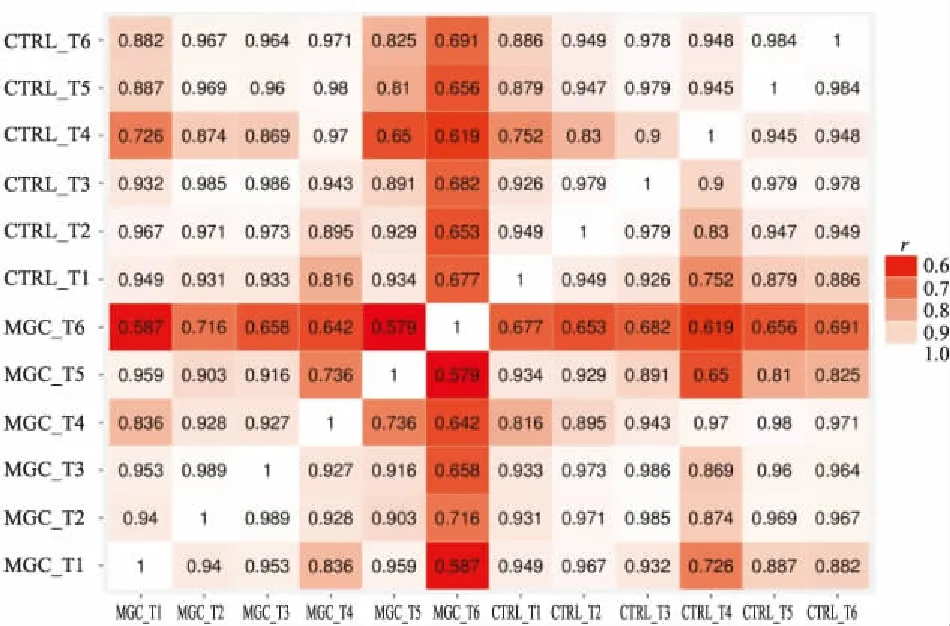
图6 Pearson相关性检验图
3 讨论
研究发现绝大多数肿瘤均存在miRNA表达失调,这些异常表达的miRNA可参与肿瘤的发生、分化、增殖、侵袭、转移、血管生成和免疫反应等。miRNA的研究实验应使用含高质量RNA的新鲜冷冻样本。然而,新鲜冷冻组织的取材、保存和运输工作均比较困难,而福尔马林固定石蜡包埋的样本不仅有大量的病理资料,且保存时间较长,应该是人类研究疾病的宝贵资源库,尤其是在回顾性研究和少见疾病的研究中可以发挥重要作用。所以,许多研究者想利用这类大量储存在医院组织库中且带有详细的临床资料的福尔马林固定石蜡包埋组织作为样本,并有研究认为在miRNA实验中,因miRNA跟长链RNA或DNA相反,因长度较短(19~25 nt),成熟miRNA的降解似乎不受福尔马林固定的影响[8],因此福尔马林固定石蜡包埋样本适用于miRNA的表达研究[9-10]。也有多篇文献报道了福尔马林固定石蜡包埋标本在肾、前列腺、乳腺等不同组织中研究miRNA表达的可行性[11]。另有学者认为福尔马林固定石蜡包埋样本在制备和储存过程不可避免地会降解RNA[12],导致RNA碎裂,所以福尔马林固定石蜡包埋组织中核酸不适合用于基因表达谱的实验[13]。
为此,本实验在美国Affymatrix公司全基因组表达谱芯片上用配对的6例新鲜冷冻和6例福尔马林固定石蜡包埋的胃黏液腺癌样本进行miRNA的芯片杂交和数据的统计筛选后发现Fold Change的绝对值≥2为标准,结果两组间有显著差异表达的miRNA分别有76个(P<0.05)和14个(P<0.01)。该结果提示配对的新鲜冷冻和石蜡包埋的同一组织学类型的胃癌组织miRNA表达谱存在差异性,即新鲜冷冻组织样本中miRNA基因的表达量不能准确转化为福尔马林固定石蜡包埋样本中的表达量,因此,如果研究直接利用福尔马林固定石蜡包埋样本中miRNA基因的绝对表达值,可能得到的结果不太准确,文献指出得到更多的可能是与降解相关的信息[14]。
从本组miRNA表达谱的相关性分析看出,配对标本新鲜冷冻与福尔马林固定石蜡包埋样本呈高度相关(r值均大于0.65),配对样本6相关性相对较低,可能与样本6新鲜冷冻(肿瘤组织占65%)与福尔马林固定石蜡包埋样本(肿瘤组织占100%)中的肿瘤细胞占比差异较大有关。聚类分析显示,新鲜冷冻组的4号和6号样本的离散度较大,在样本原始病理资料中显示这2例样本中肿瘤组织的占比较低,而聚类很好的福尔马林固定石蜡包埋样本由病理医师在诊断取材过程中获得,比在手术过程中的取材更准确,肿瘤组织占比更高,所以推测新鲜冷冻标本的离散度较大与肿瘤组织的占比较低有关。所以在肿瘤组织核酸表达的研究中组织在镜下的形态学检查十分重要,样本中所含的肿瘤坏死区、淋巴细胞浸润程度或非肿瘤细胞占比等均可能会影响实验数据的正确性。该结论亦被de Biase等[11]的研究证实。Gao等[15]的实验亦分析出很多miRNA与研究结论不一致,原因之一可能是标本收集标准的差异。
以上结果提示如果取材准确,福尔马林固定石蜡包埋样本和新鲜冷冻样本之间的miRNA表达谱高度相关,即福尔马林固定石蜡包埋样本同样可用于基因表达分析。所以有文献进一步指出两组样本内绝大部分基因间表达水平的相对大小关系不受降解的影响[16],因此可以利用福尔马林固定石蜡包埋样本用于基因表达高低相对关系的研究。本组实验结果显示,新鲜冷冻样本和福尔马林固定石蜡包埋样本中miRNA的表达虽然有很高的相关性,但两者miRNA的表达谱中有114个(P<0.05)和16个(P<0.01)存在显著差异。同时,另指出在配对的肺腺癌、浸润性乳腺癌和结肠癌中,福尔马林固定石蜡包埋样本与新鲜冷冻样本相比,其上千基因的表达检测值均至少有2倍的改变[16]。在扁桃体肿瘤中的研究中比较了新鲜冷冻标本和福尔马林固定石蜡包埋标本的miRNA表达谱,虽然两组之间表达的miRNA相关性较好,但差异表达的miRNA重叠程度亦不理想[17]。所以利用福尔马林固定石蜡包埋组织也不太适合用于全部核酸相对表达量的研究,推测可能不同miRNA稳定性有差异,有些更易被降解或转化。
总之,本组实验结果提示,在肿瘤核酸表达的研究中,对取材样本在镜下核实肿瘤组织的占比非常重要;而且配对的福尔马林固定石蜡包埋和新鲜冷冻组织中miRNA的表达存在显著差异,如果在研究中用相对容易获得且病理资料完整的福尔马林固定石蜡包埋组织作为研究材料,那么可能会由于甲醛固定处理过的石蜡包埋块标本经历了长时间的保存,miRNA可能发生了核酸与蛋白质交联反应,单甲基化基团的修饰等过程,导致miRNA发生降解或转化,所以采用福尔马林固定石蜡包埋组织中miRNA基因的绝对表达值,结论可能不太准确,可能会导致某些miRNA的丢失从而影响早期胃癌筛查的关键性分子标志物miRNA的检出及下游逆转录和基因表达定量分析。本实验及其他报道均显示新鲜冷冻与福尔马林固定石蜡包埋组织miRNA的表达谱呈高度的相关性,但用福尔马林固定石蜡包埋组织作为研究材料能否反映全部miRNA基因的相对表达仍需要进一步的实验去证实。
