热解吸-电喷雾离子源-三重四极杆质谱法快速筛查火锅底料和肉汤中非法添加罂粟壳
2020-05-22张虹艳石晓峰邱国玉王小乔张彩霞张晓萍吴福祥许晓辉李晨曦潘秀丽
张虹艳, 石晓峰,2*, 邱国玉, 王小乔, 张彩霞, 张晓萍, 吴福祥, 许晓辉, 李晨曦, 潘秀丽
(1. 兰州市食品药品检验所, 甘肃 兰州 730050; 2. 甘肃省医学科学研究院, 甘肃 兰州 730050)
罂粟壳为罂粟科植物罂粟(Papaversomniferum)采完鸦片后的干燥成熟果壳,具有一定的成瘾性,标志性成分为罂粟碱、那可丁、可待因、吗啡、蒂巴因等生物碱[1]。20世纪80年代中期以来,一些不法食品生产经营者在火锅底料、调味料、肉汤中掺用罂粟壳的现象屡禁不止,为此2008年12月卫生部发出《关于开展全国打击违法添加非食用物质和滥用食品添加剂专项整治的紧急通知》,明确将罂粟壳列入首批非食用物质名单。国内外文献报道的罂粟壳检测方法主要有气相色谱法[2]、液相色谱法[3]、气相色谱-质谱联用法[4]、液相色谱-质谱联用法[5-14],这些方法各有其优缺点,但共性问题是样品前处理繁琐。日常监管常用的罂粟壳胶体金卡片快检试剂盒由于其检出限的限制,假阴性率较高。因此建立一种快速、灵敏、准确检测食品中非法添加罂粟壳的方法显得十分必要。
热解吸-电喷雾离子源-三重四极杆质谱(TD-ESI-MS/MS)是目前比较先进的质谱技术之一,与传统质谱方法相比,检测器相同,但是取样方法发生较大变化,传统方法需要称样、提取、净化、浓缩等前处理步骤,而该方法具有无需样品前处理,快速、简便、灵敏等优势,操作时只通过简单的金属探针接触固体表面或液体样品采集待测物,以高温加热的方式完成探针表面吸附物质的解吸过程,解吸后的气相物质分子经载气流轨道收束并吹送至电喷雾区域,完成离子化过程,最终进入三重四极杆质谱检测器分析,适用于不同形态样品的检测[15,16]。电喷雾辅助激光解吸(electrospray-assisted laser desorption ionization, ELDI)[17]、直接实时分析(distress assessment and response tool, DART)[18]、解吸电喷雾(desorption electrospray ionization, DESI)[19]等离子源技术直接分析待测物时,受样品尺寸以及形状限制,且有不同程度的记忆效应,DART源检测罂粟壳还需要简单的样品前处理[20]。相比而言,TD-ESI的优势在于使用探针取样直接检测,不受样品状态影响,无需样品前处理过程,没有记忆效应,更适用于现场的快速筛查。目前TD-ESI-MS/MS法已应用于水果蔬菜中农药多残留[21]、血浆中利他林的药代动力学[22]、保健食品非法添加物[16]以及毒品检测[23]等方面,得到了较为满意的应用效果。本研究运用TD-ESI-MS/MS技术对食品中非法添加罂粟壳的5种生物碱进行快速定性分析,能够缩短分析时间、减少试剂耗材消耗,降低实验成本,是一种快速、绿色、环保的分析方法。
1 实验部分
1.1 仪器、试剂与材料
Ultivo三重四极杆质谱仪(美国Agilent公司), TD-ESI离子源(山东国投鸿基检测技术股份有限公司),金属取样探针材质为镍铬合金,线径0.6 mm,环直径2 mm,总长5~6 cm,伸出取样器的长度为4 cm; MS105DU电子天平(瑞士Mettler Toledo公司), Milli-Q超纯水系统(美国Millipore公司);移液枪(德国Eppendorf公司)。
对照品盐酸罂粟碱(批号:171214-201205,纯度:99.9% )、那可丁(批号:171224-201304,纯度:99.9% )、蒂巴因(批号:171216-201304)、吗啡(批号:171201-201324,纯度:99.1% )、可待因(批号:171203-201304,纯度:97.5% ),均购自中国食品药品检定研究院。
火锅底料和肉汤为当地食品安全抽检样品。
1.2 混合对照品溶液的配制
准确称取5种生物碱对照品各10.00 mg,分别用0.5%甲酸甲醇溶解并定容于10 mL容量瓶中,得到质量浓度均为1 g/L 的5种生物碱对照品的储备液,于-18 ℃冰箱中保存。精密吸取各对照品储备液适量,于10 mL容量瓶中,用乙腈定容至刻度,配制成罂粟碱、那可丁、蒂巴因质量浓度为1.0 mg/L 和吗啡、可待因质量浓度为5.0 mg/L 的混合对照品中间液,再用乙腈稀释至那可丁、罂粟碱、蒂巴因质量浓度为10 μg/L,可待因、吗啡质量浓度为50 μg/L 的混合对照品溶液。
1.3 仪器条件
1.3.1 热解吸-电喷雾离子源条件
精密移取混合对照品溶液3 μL,用探针取样,将待测物吸附于探针表面取样环,然后将探针插入加热管,采用高温加热的方式完成探针表面物质的解吸过程,解吸后的气相物质分子经载气流轨道收束并吹送至电喷雾区域。热解吸-电喷雾离子源配有外置注射泵,推动泵内溶剂进入离子源,通过电喷雾促进待测物离子化,最终进入三重四极杆质谱仪检测分析,热解吸-电喷雾离子源工作原理如图1所示,热解吸-离子化-质谱检测整个分析过程在30 s内即可完成。
离子源条件:注射泵流速200 μL/h,加热解吸温度260 ℃,注射泵溶剂为0.1%甲酸水溶液(含10 mmol/L 甲酸铵)-乙腈(1∶1, v/v)。
1.3.2 质谱条件
正离子模式;干燥气温度:300 ℃;干燥气流速:3 L/min;雾化器压力:34.5 kPa(5 psi);毛细管电压:4 000 V。质谱采集参数见表1。

图 1 热解吸-电喷雾离子源工作原理Fig. 1 Principle of thermal desorption (TD)-ESI source
1.3.3 定性分析
精密移取混合对照品溶液3 μL,通过探针取样,按上述仪器条件进行操作;对于固体样品,用取样探针的取样环在样品表面轻刮3~5 cm,对于液体样品,精密移取3 μL样品至探针取样环。同法操作,若样品与对照品溶液具有相同的分子离子峰和碎片离子峰,而且所选择的碎片离子丰度比与对照品溶液的离子丰度比相一致(相对丰度>50% ,允许±10%偏差;相对丰度在20% ~50%之间,允许±15%偏差;相对丰度在10% ~20%之间,允许±20%偏差;相对丰度≤10% ,允许±50%偏差),则可判断样品中存在这种化合物。

表 1 5种生物碱的CAS号、化学式、监测离子、碎裂电压、碰撞能Table 1 CAS Nos., chemical formula, monitoring ions, fragmentor and collision energies (CEs) of five alkaloids
2 结果与讨论
2.1 实验条件考察
2.1.1 热解吸温度
热解吸装置位于离子源的前端,热解吸温度对离子化效率至关重要,选择适用于待测物的热解吸温度保证此温度下离子化效率最高是本实验的关键因素。精密移取混合对照品溶液3 μL,以不同热解吸温度(240、250、260、270 ℃)连续检测3次,计算不同热解吸温度下总离子流图中5种生物碱加合响应值的平均值,依次为 31 324、35 669、45 356 和 37 888,因此选择260 ℃为热解吸温度。

图 2 注射泵不同流速对响应响度的影响Fig. 2 Effect of different rates of pump on the response intensitySource: TD-ESI, positive; gas temperature: 300 ℃; gas flow: 3 L/min; nebulizer: 34.5 kPa; capillary: 4000 V; temperature of thermal desorption: 260 ℃; solvent of injection: 0.1% formic acid aqueous solution containing 10 mmol/L formic ammonium-acetonitrile (1∶1, v/v).
2.1.2 注射泵流速
注射泵起到传输待测物使其离子化的作用,流速过高或过低均会影响离子化的效率,流速通常设置的范围为100~200 μL/h。精密移取混合对照品溶液3 μL,以不同注射泵流速(100、150、200 μL/h)进样测定,连续检测3次,记录总离子流图(纵坐标为5种生物碱加合响应值,横坐标为采集时间)。结果如图2所示,图中显示3个峰为连续测定3次的总离子流图,每个峰即一次进样的谱图,每个峰包含5种生物碱峰面积的加合响应;当注射泵流速降低时,注射泵内溶剂单位时间内带动待测物进入离子源的速度降低,峰形展宽,流速越低,峰展宽越明显;当注射泵流速升高时,峰形改善,离子化效率提高;注射泵流速为200 μL/h时,可以兼顾峰形与离子响应强度,因此选择200 μL/h作为注射泵流速。
2.1.3 注射泵溶剂
分别对比水-乙腈(1∶1, v/v)、0.1%甲酸水溶液-乙腈(1∶1, v/v)、0.1%甲酸水溶液(含10 mmol/L 甲酸铵)-乙腈(1∶1, v/v) 3种注射泵溶剂对5种生物碱检测效果的影响,发现0.1%甲酸水溶液(含10 mmol/L 甲酸铵)-乙腈(1∶1, v/v)作为注射泵溶剂时,5种生物碱响应强度最高,峰形最佳,故选择0.1%甲酸水溶液(含10 mmol/L 甲酸铵)-乙腈(1∶1, v/v)作为注射泵溶剂。
2.2 方法学验证
2.2.1 专属性试验
取火锅底料和肉汤空白基质,用探针的取样环取样,然后按1.3节仪器条件,将探针插入加热管热解吸,进而进入离子源电离并导入三重四极杆质谱检测器,考察空白基质对检测的干扰。结果显示空白基质均未检出5种生物碱,表明空白基质对检测无干扰,专属性强。
2.2.2 检出限
精密吸取混合对照品溶液适量,逐级稀释,分别加入火锅底料和肉汤空白基质中,按1.3节方法操作,至恰好能满足3倍信噪比时,计算检出限(LOD)。火锅底料和肉汤两种不同基质中5种生物碱的检出限见表2,其中那可丁、罂粟碱、蒂巴因3种生物碱检出限相同,火锅底料中吗啡和可待因的检出限是肉汤检出限5 μg/kg 的2倍,究其原因可能是因为火锅底料基质中含有较多油脂和其他固形物,说明样品未经前处理直接检测,复杂的基质成分会影响待测物的检测灵敏度。

表 2 5种生物碱的检出限Table 2 LODs for the five alkaloids

图 3 肉汤中5种生物碱6次重复试验的谱图Fig. 3 MRM spectra of a mixture of the five alkaloid standards in soup by six repetitive test Rate of injection: 200 μL/h; other conditions are the same as those in Fig. 2.
2.2.3 重复性和稳定性
精密吸取混合对照品溶液1 mL,加入5 g火锅底料和肉汤空白基质中,配制成那可丁、罂粟碱、蒂巴因含量均为2 μg/kg,可待因和吗啡浓度为10 μg/kg 的加标样品,分别按1.3节下的方法操作,重复进样6次,结果表明,各化合物均能重现。图3是肉汤加标样品的重复性试验图谱,其中图3a中显示6个峰为肉汤加标样品连续测定6次得到的总离子流图,每个峰包含5种生物碱的响应,图3b-k分别为各碎片离子对的监测谱图,可以看出,各化合物均能重现。
分别在1、2、4、12、24、48 h时进样测定,每个取样点进样3次,结果表明5种生物碱在1~48 h内均可检出,稳定性良好,能够满足实验要求。
2.3 罂粟壳胶体金卡片快检试剂盒的灵敏度
在火锅底料和肉汤空白基质中添加5种生物碱对照品储备溶液,模拟5种生物碱质量浓度均为5、10、20、40 μg/kg 的系列阳性样品,采用罂粟壳胶体金卡片快检试剂盒进行检测,T线与C线同时出现结果为阴性,T线不显色为阳性。两种食品基质的模拟阳性样品的快检结果相同,结果如图4所示,以肉汤阳性样品为例进行分析,当样品中生物碱浓度小于20 μg/kg 时,胶体金卡片显示阴性;当样品中生物碱浓度等于20 μg/kg 时,胶体金卡片显示弱阳性;当样品中生物碱浓度大于20 μg/kg 时,胶体金卡片显示阳性。该检测结果与TD-ESI-MS/MS的检出限结果进行比对,显示其灵敏度明显低于热解吸-电喷雾离子源-三重四极杆质谱检测法。

图 4 不同浓度生物碱胶体金卡片的快检结果Fig. 4 Results of the five alkaloids in different contents tested by colloidal gold card
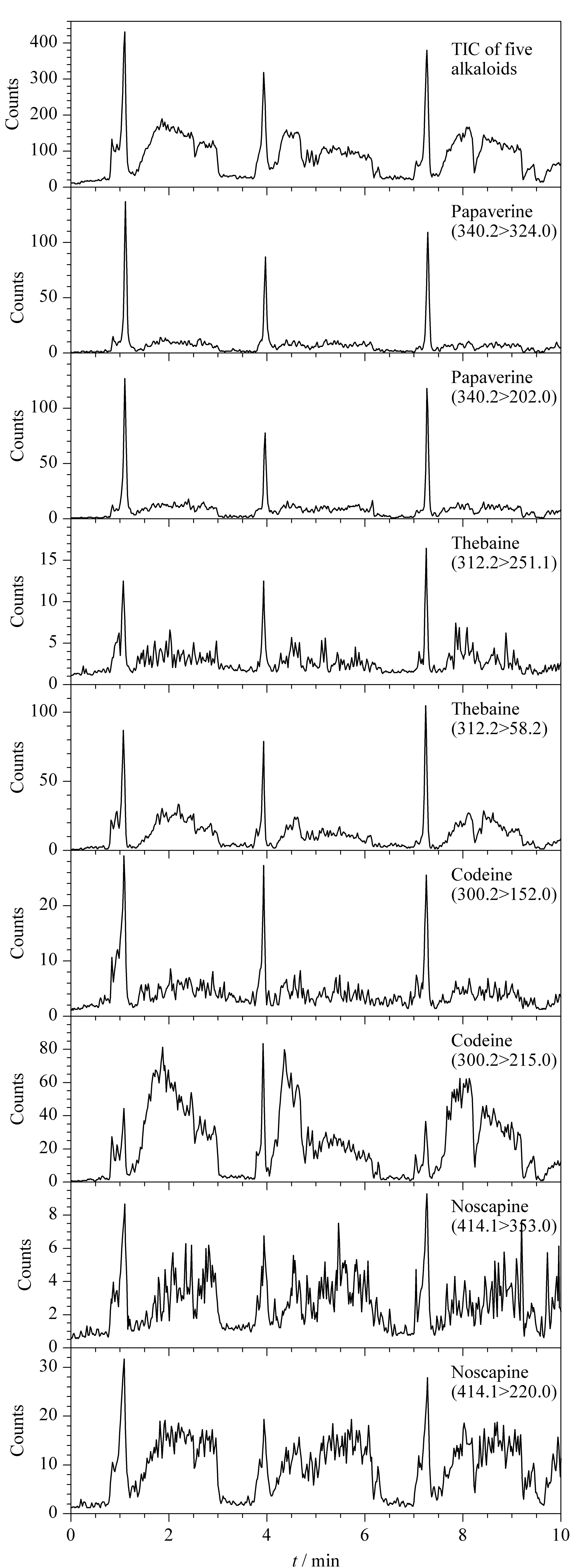
图 5 实际样品的测定结果Fig. 5 Detection results of the real samples Conditions are the same as those in Fig. 3.
2.4 实际样品的检测与验证
检测了50批次的火锅底料和肉汤样品,每个样品重复进样3次;发现一批次鸡汤为阳性样品,检出那可丁、罂粟碱、蒂巴因、可待因4种生物碱成分,特征离子具有较好的重现性,结果见图5,由于样品未经前处理,所以具有较高的背景响应。为此根据DB 31/2010-2012《火锅食品中罂粟碱、吗啡、那可丁、可待因和蒂巴因的测定》,采用HPLC-MS/MS对实际样品中筛查出的该批次鸡汤进行检验,进行进一步的结果验证,结果见表3,说明TD-ESI-MS/MS作为定性检测的快筛方法与HPLC-MS/MS结果具有一致性,表明该方法可以作为前端的现场快速筛查方法。
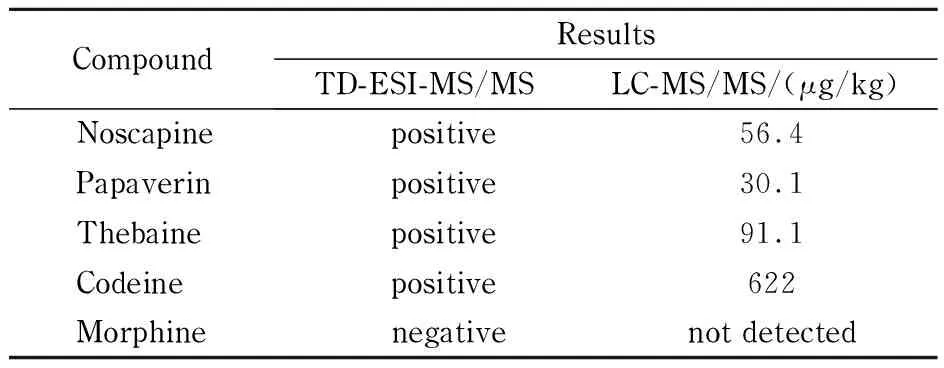
表 3 不同方法检测5种生物碱的结果对比Table 3 Comparison for the five alkaloids tested with different methods
3 结论
本研究建立了利用热解吸-电喷雾离子源-三重四极杆质谱对罂粟壳进行现场快速筛查的方法,该方法对固体和液体样品均无需前处理,操作简单快速,灵敏度高,准确性好,30 s内可以完成样品的检测;该仪器可以与车载设备联合使用,具有较高的社会嵌入性,可对食品中非法添加物进行风险预警,从源头降低食品安全风险。