同位素稀释-液相色谱-串联质谱法在小麦粉细交链孢菌酮酸和腾毒素标准物质制备和定值中的应用
2020-05-22谢继安刘柏林赵紫微杨大进赵云峰
谢继安, 刘柏林, 赵紫微, 张 磊, 杨大进, 赵云峰
(1. 安徽省疾病预防控制中心, 安徽 合肥 230601; 2. 国家食品安全风险评估中心, 北京 100050)
交链孢霉(alternaria)是一类广泛分布于农作物和土壤中的腐植菌,能引起水果、蔬菜和粮食的腐败,代谢产生交链孢霉毒素(alternaria toxins)[1],其中细交链孢菌酮酸(tenuazonic acid, TeA)和腾毒素(tentoxin, TEN)最为常见,结构式见图1。TeA和TEN主要存在于谷物、番茄、柑橘、樱桃等农作物和水果中,对小麦的污染非常普遍,检出率高,检出量大,世界各地均有报道[2,3]。2016年欧洲食品安全局(EFSA)开展了欧洲人群的交链孢霉毒素膳食暴露研究[3],显示婴幼儿为TeA和TEN膳食暴露的主要人群,TeA暴露来源主要为谷基婴幼儿食品和番茄及其制品,TEN则为番茄等果实蔬菜类食品。2016~2018年国家食品污染物监测显示小麦及其制品中TeA和TEN的污染严重,检出率超过90% , TeA最大检出值超过 2 000 μg/kg, TEN最大检出值超过200 μg/kg。
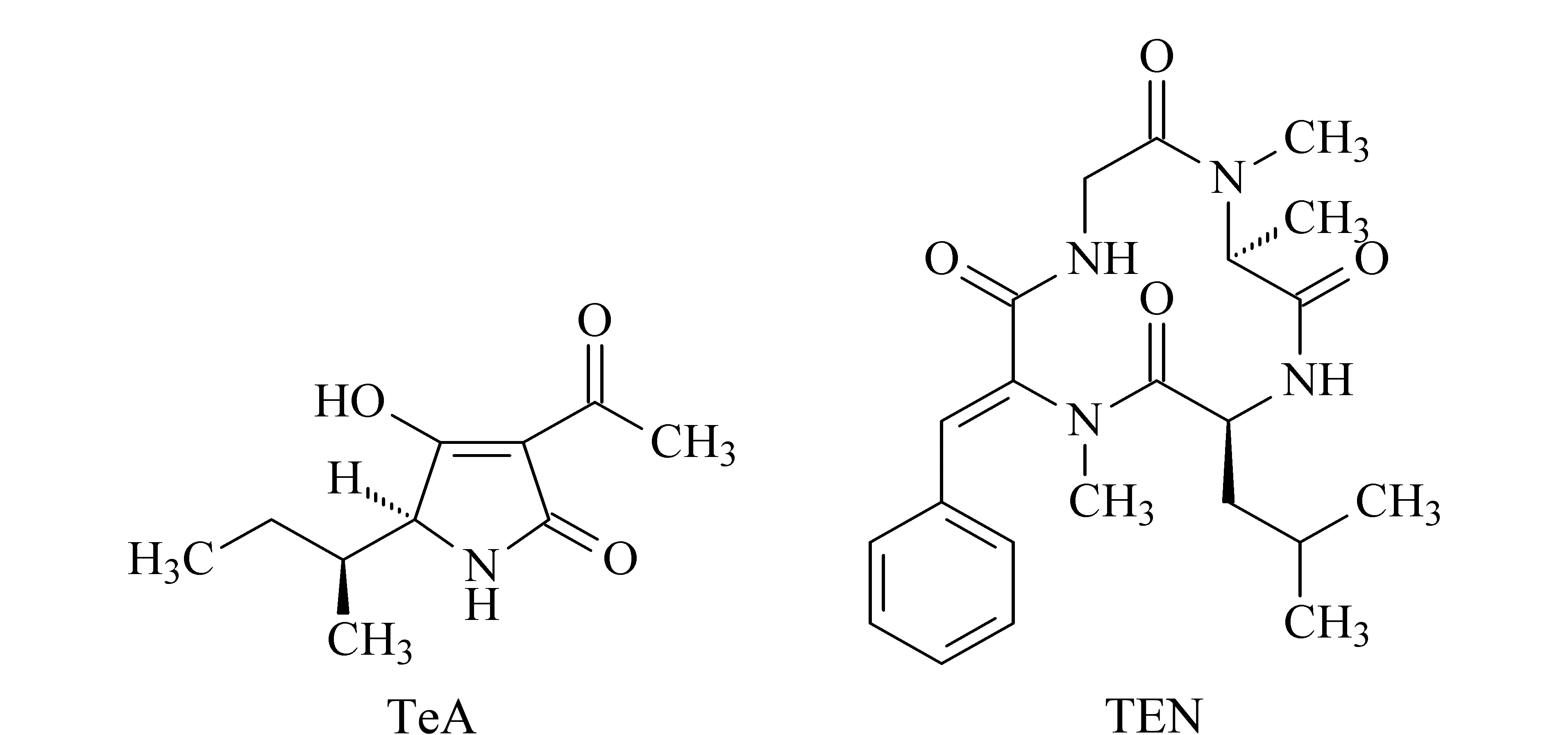
图 1 TeA和TEN的结构式Fig. 1 Structural formulas of tenuazonic acid (TeA) and tentoxin (TEN)
我国《食品安全国家标准食品中真菌毒素限量》[4]未规定食品中交链孢霉毒素的限量标准。鉴于标准物质在分析测试领域中有着重要作用[5],为提高食品中交链孢霉毒素的质控水平,为交链孢霉毒素膳食暴露评估提供可靠资料,科研人员有必要开展食品中交链孢霉毒素标准物质的研究工作。
本研究以天然受交链孢霉毒素污染的小麦籽粒为原料,按小麦粉卫生标准[6]制备成小麦粉,以该小麦粉为基体载体、TeA和TEN为目标物,按《一级标准物质技术规范》[7]要求进行均匀性和稳定性检验,同位素稀释-液相色谱-串联质谱法检测,多个实验室合作定值,依据《标准物质定值的通用原则及统计学原理》[8]进行统计分析。
1 实验部分
1.1 仪器与试剂
UPLC超高效液相色谱仪、Xevo TQ质谱仪、UPLC HSS T3色谱柱(100 mm×2.1 mm, 1.8 μm)、HLB固相萃取柱(200 mg/6 mL)(美国Waters公司), VORTEX Multi Reax高速旋涡混匀器(德国Heidolph公司), XS204电子天平(瑞士Mettler Toledo公司), GX-271固相萃取仪(美国Gilson公司), Legend Mach 1.6R高速冷冻离心机(美国Thermo Fisher公司), Milli-Q超净水系统(美国Millipore公司), EFAA-DC24防腐型氮吹浓缩仪(上海安谱实验科技股份有限公司)。
TeA(C10H15NO3, CAS号:610-88-8)、TEN(C22H30N4O4, CAS号:28540-82-1)(英国政府化学家实验室(LGC)),13C2-TeA(13C2C8H15NO3,德国Sigma Aldrich公司), D3-TEN(C22H27D3N4O4,加拿大Toronto Research Chemicals公司),乙腈和甲醇(色谱纯,德国Merck公司),碳酸氢铵(色谱纯,上海安谱实验科技股份有限公司)。
1.2 标准溶液的配制
分别取适量TeA标准溶液和TEN标准溶液至容量瓶中,用甲醇稀释成TeA和TEN质量浓度分别为2.0 μg/mL 和0.4 μg/mL 的混合标准溶液。于-20 ℃避光保存。分别取适量13C2-TeA标准溶液和D3-TEN标准溶液至容量瓶中,用甲醇稀释成13C2-TeA和D3-TEN质量浓度为1.0 μg/mL 和0.2 μg/mL 的混合同位素内标溶液,于-20 ℃避光保存。
1.3 样品提取与净化
准确称取5.0 g样品,加入200 μL混合同位素内标溶液并浸泡过夜,加入25 mL提取溶液(乙腈-甲醇-0.05 mol/L 磷酸二氢钠溶液(pH 3.0)(45∶10∶45, v/v/v)),高速旋涡混匀15 min,以 10 000 r/min 离心10 min,取5.0 mL上清液,加入15 mL 0.05 mol/L 磷酸二氢钠溶液(pH 3.0),稀释后全部通过HLB固相萃取柱净化,净化液于45 ℃水浴氮气吹至近干,用2.0 mL 10%甲醇水溶液复溶,以 12 000 r/min 离心10 min,上清液供LC-MS/MS分析。
1.4 仪器条件
色谱条件:色谱柱为Waters HSS T3柱(100 mm×2.1 mm, 1.8 μm),流动相以(A)1.0 mmol/L 碳酸氢铵溶液为水相,甲醇为(B)有机相,流速为0.2 mL/min。线性梯度洗脱:0~2.0 min, 5%B; 2.0~3.0 min, 5%B~75%B; 3.0~4.0 min, 75%B~90%B; 4.0~6.0 min, 90%B; 6.0~7.0min, 90%B~5%B; 7.0~9.0 min, 5%B。进样量为10 μL。
质谱条件:电喷雾电离(ESI)源,负离子模式,离子源温度为150 ℃,毛细管电压为-2.4 kV,脱溶剂温度为500 ℃,脱溶剂气流量为800 L/h,碰撞气流量为0.15 mL/min,多反应监测(MRM)模式定量检测。TeA、13C2-TeA、TEN和D3-TEN的质谱参数见表1。

表 1 TeA、13C2-TeA、TEN和D3-TEN的质谱参数Table 1 MS parameters of the TeA,13C2-TeA,TEN and D3-TEN
* Quantitative ion.
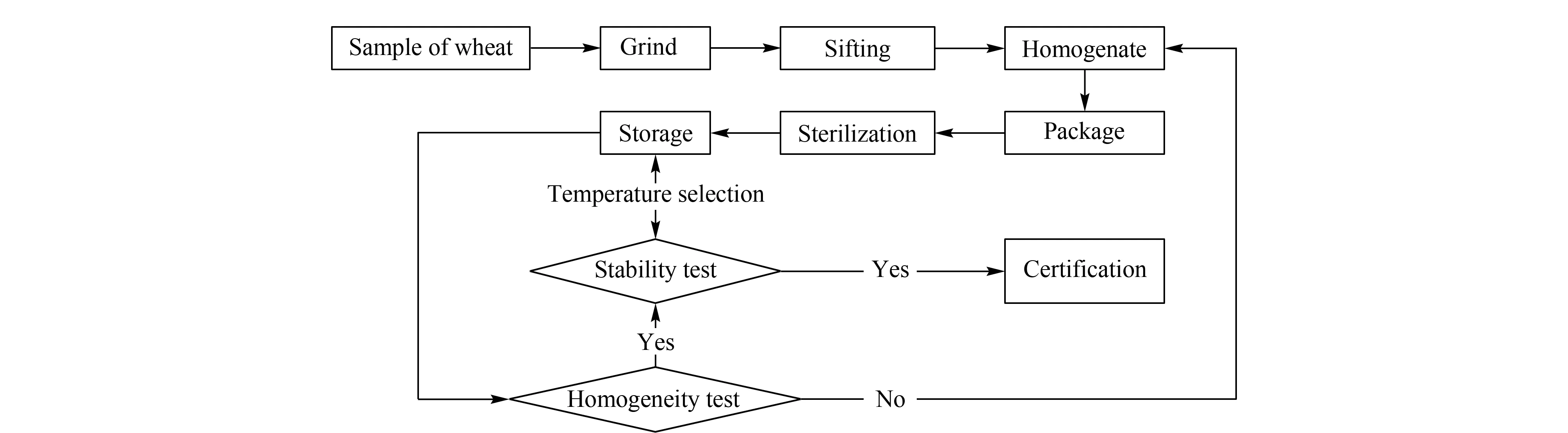
图 2 小麦粉中TeA和TEN标准物质的生产制备工艺流程图Fig. 2 Flow chart for preparation and certification of TeA and TEN in wheat flour
1.5 标准物质制备
通过对全国小麦主产区代表性样品的筛查,选取天然污染高浓度TeA及TEN的小麦籽粒样品和天然污染低浓度TeA及TEN小麦籽粒样品作为候选物,经一定比例混合后,按小麦粉卫生标准[6]中普通粉要求进行磨粉和过筛(CQ 20号筛)加工,再在干粉混料机中混匀6 h,制备成高、低2个浓度水平的小麦粉标准物质候选物。混匀后的样品用铝箔袋分装,抽真空热封的方法封袋,每包装袋约50 g。使用电子加速器辐照法对装袋样品进行辐照灭菌,辐照剂量为10 kGy,灭菌后的样品在室温(25 ℃)条件下避光保存于的密封桶中,确保其稳定性。
1.6 质量控制
在对小麦粉标准物质候选物分析的同时,以空白试验考察系统分析背景,以确保不存在本底干扰。各组分的空白样品加标回收率控制在100%±5%以内,相对标准偏差(RSD)控制在5%以内。
2 结果与分析
2.1 标准物质候选物制备工艺流程
标准物质的制备工艺流程图见图2。根据《一级标准物质技术规范》[7]要求对全国各小麦主产区代表性样品进行筛查,选取山西省某县的天然污染高浓度TeA及TEN的小麦籽粒样品和安徽省某县天然污染低浓度TeA及TEN的小麦籽粒样品作为候选物,满足小麦籽粒样品在不同气候条件下天然污染TeA和TEN的典型样品要求。天然污染TeA及TEN的小麦籽粒经粉碎、筛粉、混匀、分装、灭菌等制备工序,研制成小麦粉中细交链孢菌酮酸和腾毒素标准物质。
2.2 标准物质定值方法的优化
标准物质特性量值测量方法的准确性决定标准物质定值的准确性,一般采用国际物质量委员会(CCQM)认定的基准方法,针对食品中污染物类标准物质,一般采用同位素稀释质谱法进行标准物质特性量值的测量[9]。同位素稀释质谱法采用稳定性同位素标记的目标物为内标,该标记物与目标物具有相同分子结构,理化性质与目标物基本一致,可以抵消检测过程中各种基质效应和系统误差,是公认的一种测量微量污染物的基准方法[10,11]。基于上述要求,本研究建立了测定小麦粉中细交链孢菌酮酸和腾毒素的同位素稀释-液相色谱-串联质谱法,并对提取溶剂、提取时间、固相萃取柱、液相色谱条件和质谱条件、基质效应、定量线性范围、检出限和定量限、加标回收等多方面进行了方法学优化和确认[12-14]。
2.2.1 提取溶剂和提取时间
由于TeA和TEN的油水分配系数(logP)分别为0.65和1.46[15], TeA具有较强的水溶性,且易电离,而TEN兼具水溶性和脂溶性。经过优化,选择酸性缓冲盐和有机溶剂的混合提取液。酸性缓冲盐溶液能抑制TeA的电离,不仅能提高TeA的提取效率,还能使TeA在HLB固相萃取柱上得到很好保留,有利于样品的净化。混合提取液中一定比例的乙腈和甲醇不仅能提高TEN的提取效率,还具有一定沉淀蛋白质的作用,减少了样品提取液中可溶性植物蛋白等杂质的含量。
样品提取时间直接影响TeA和TEN的提取效率,实验使用高含量样品(TeA约200 μg/kg 和TEN约40 μg/kg)进行提取时间筛选,测定了高速旋涡混匀(振幅3 mm,振度 2 000 r/min)提取5、10、15和20 min时的提取效率(见图3)。当提取时间达到15 min及更长时,样品中TeA和TEN的检测值达到最大并相对稳定。因此选用高速旋涡混匀提取15 min,以确保将样品中TeA和TEN完全提取出来。

图 3 提取时间对小麦粉中TeA和TEN含量的影响Fig. 3 Effect of extraction time on the contents of TeA and TEN in wheat flour
2.2.2 固相萃取柱净化
HLB固相萃取柱含有亲水亲脂平衡反相吸附剂,是目前国内外广泛使用的样品前处理固相萃取柱。本研究利用HLB固相萃取柱中亲水性的N-乙烯吡咯烷酮保留TeA,亲水性的N-乙烯基吡咯烷酮和亲脂性的二乙烯基苯聚合物共同保留TEN,能实现完全保留TeA和TEN。实验选取HLB固相萃取柱规格分别为60 mg/3 mL、150 mg/6 mL、200 mg/6 mL和500 mg/6 mL进行空白样品加标回收试验(加标量为TeA 250 μg/kg、TEN 50 μg/kg)。如图4所示,当HLB填料≥200 mg时,空白样品加标回收率达到最大并趋于稳定,因此选用HLB(200 mg/6 mL)对样品提取液进行净化。
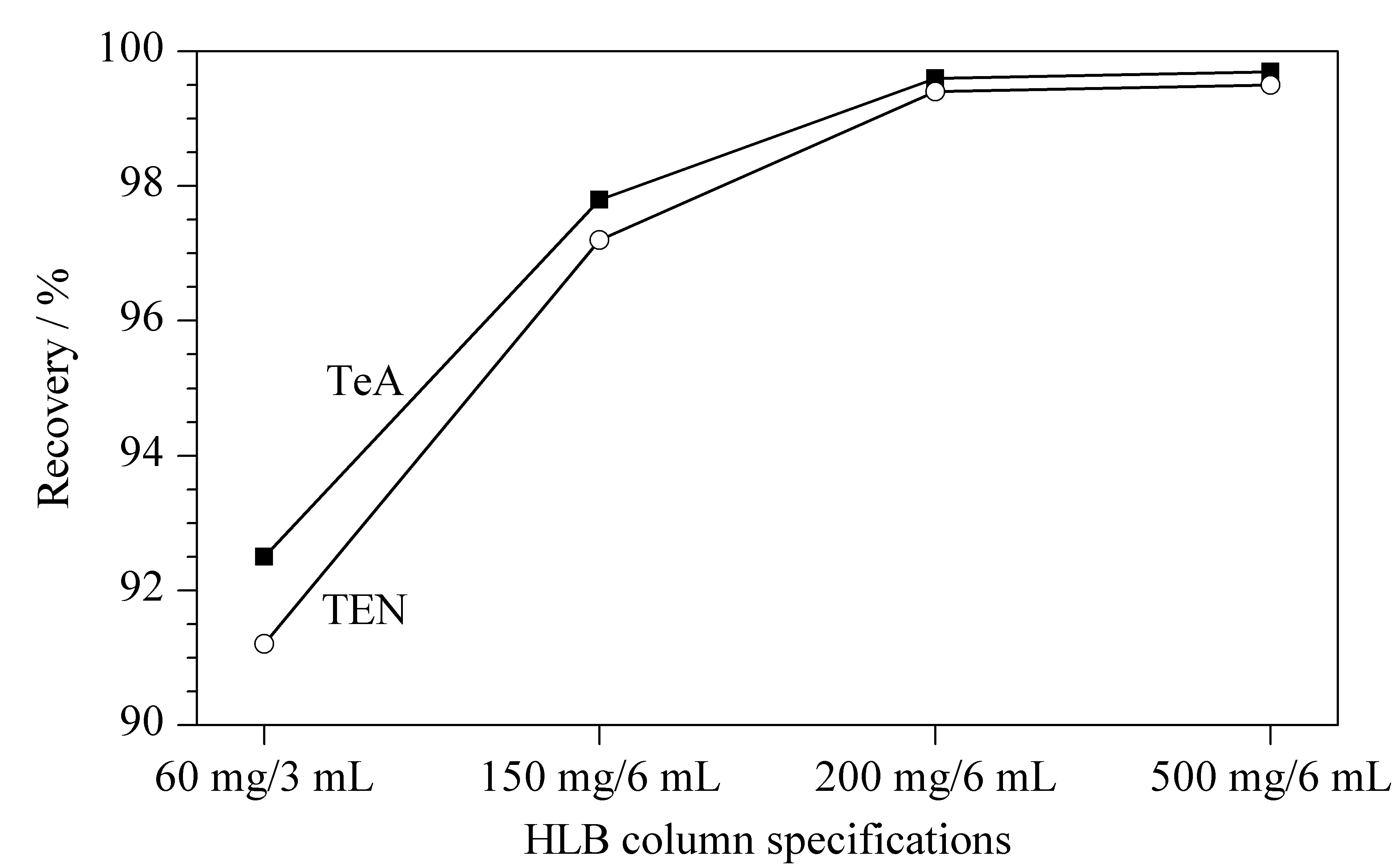
图 4 HLB柱规格对小麦粉中TeA(250 μg/kg)和 TEN(50 μg/kg)回收率的影响 Fig. 4 Effect of HLB column specifications on the recoveries of TeA (250 μg/kg)and TEN (50 μg/kg) in wheat flour
样品提取液净化时,需要考察样品提取液中有机溶剂含量对HLB固相萃取柱净化能力的影响(见图5,样品提取液中TeA和TEN分别为250 ng和50 ng)。结果表明,当样品提取液中有机溶剂体积分数超过20%时,则HLB固相萃取柱的流出液中能检出TeA和TEN,显示HLB固相萃取柱已无法保留样品提取液中全部的TeA和TEN,因此需要将样品提取液进行适当稀释,使有机溶剂体积分数降至20%以下才能使用HLB固相萃取柱净化。
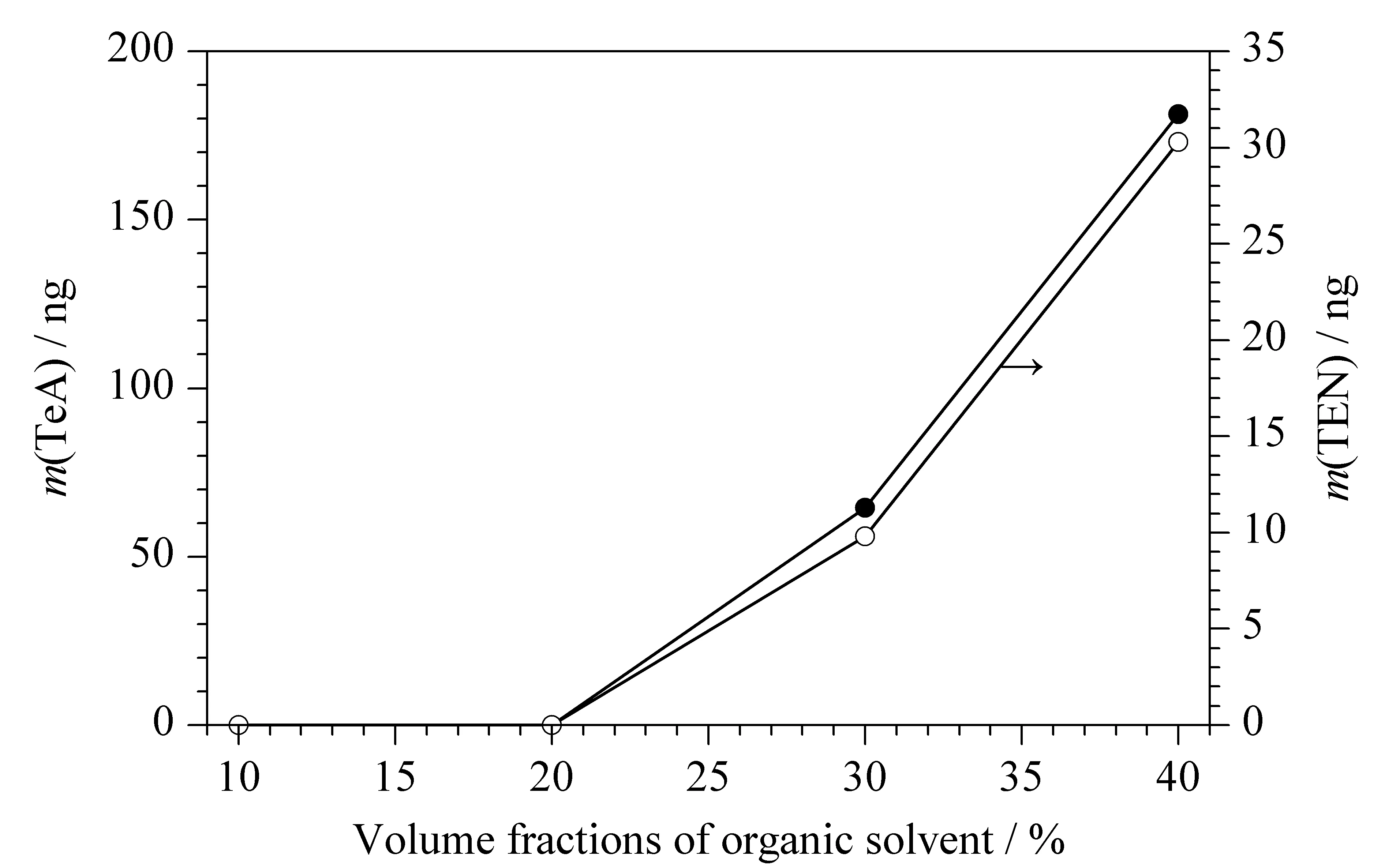
图 5 样品溶液中有机溶剂体积分数对HLB固相萃取柱净化能力的影响Fig. 5 Effect of volume fractions of organic solvent in sample solution on the purification capacity of HLB SPE column
2.2.3 液相色谱条件
本研究采用ESI-模式分析TeA和TEN,当流动相的水相为碱性溶液时,TeA和TEN的质谱响应值更高。色谱分析时,水相溶液碱度会影响TeA出峰时间和峰形。实验显示,当碳酸氢铵溶液浓度为1.0 mmol/L 时,TeA和TEN有较好的保留时间和较窄的色谱峰。有机相使用甲醇时,TeA和TEN的灵敏度也显著高于使用乙腈时。在MRM模式下,TeA和TEN及其同位素内标的色谱图见图6。
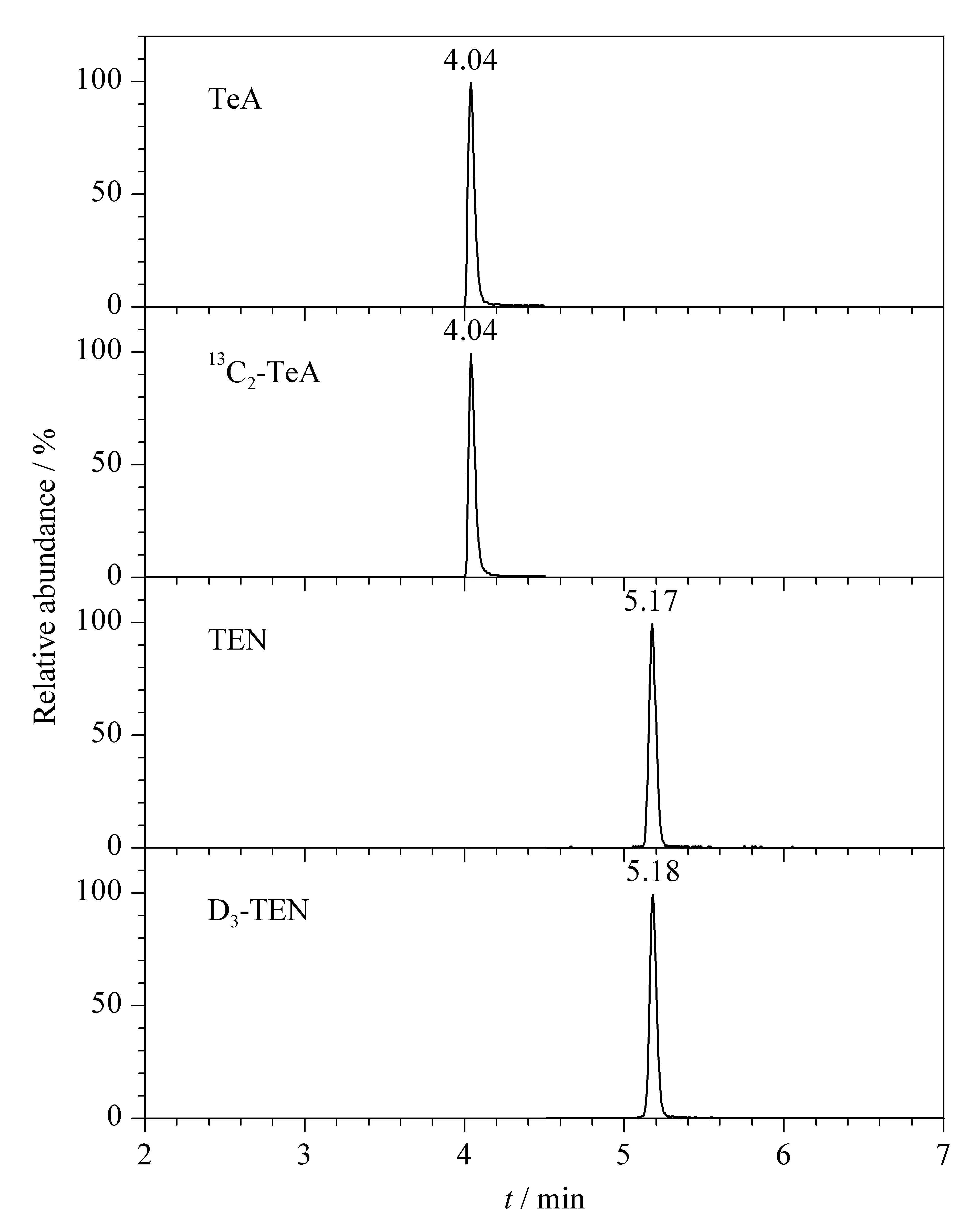
图 6 MRM模式下TeA、13C2-TeA、TEN和D3-TEN的色谱图Fig. 6 Chromatograms of TeA,13C2-TeA, TEN and D3-TEN in MRM mode
2.2.4 质谱条件
对TeA和TEN及其同位素内标进行质谱方法开发,优化毛细管电压、离子源温度、脱溶剂气温度、脱溶剂气流量、锥孔电压和碰撞能量等参数,得到TeA、TEN及同位素内标物的质谱参数信息(见表1)。TeA和TEN及其同位素内标的质谱裂解图见图7。
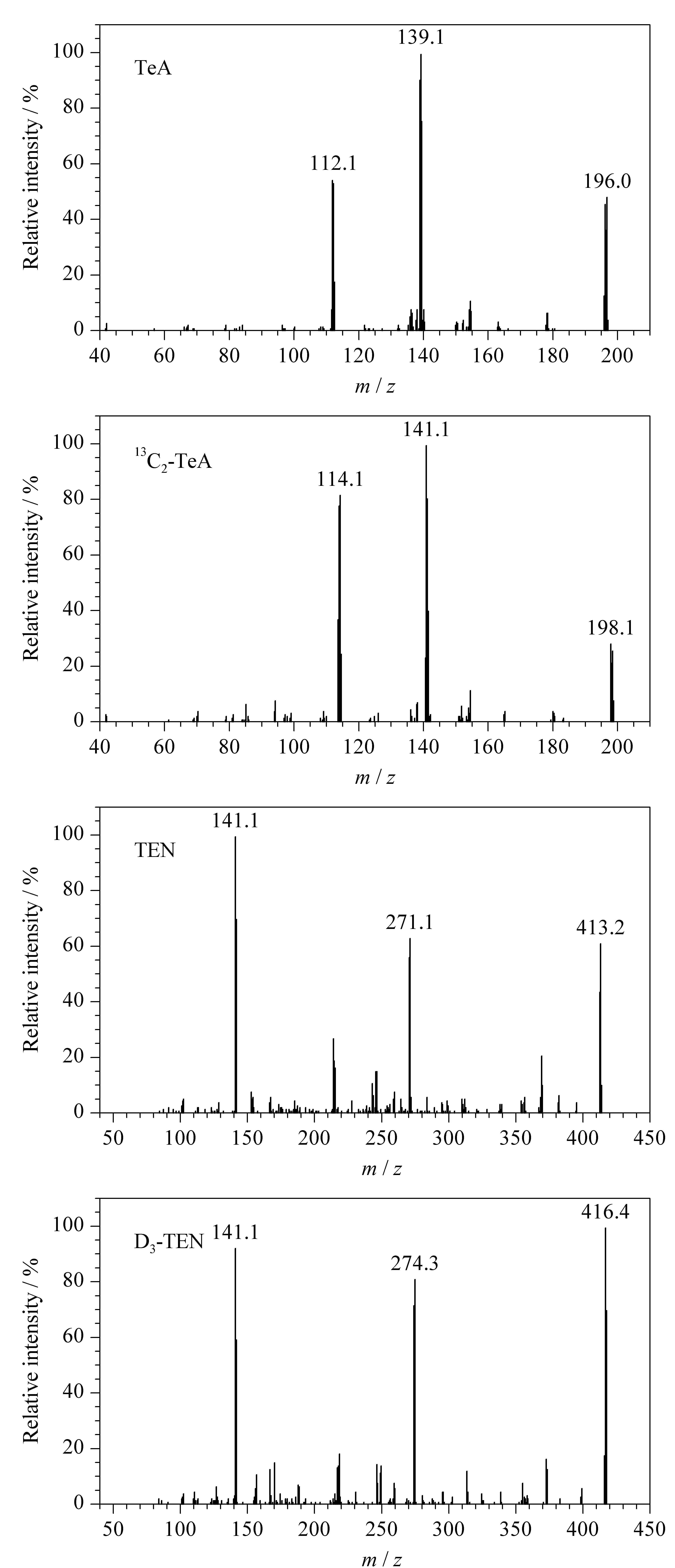
图 7 TeA、13C2-TeA、TEN和D3-TEN的质谱图Fig. 7 Mass spectra of TeA,13C2-TeA, TEN and D3-TEN
2.2.5 样品的基质效应
为了尽可能降低检验方法的基质效应,本研究着重对样品提取溶液和固相萃取柱进行考察。结果表明,采用酸性缓冲盐和有机溶剂的混合提取液及HLB柱净化,能去除小麦粉样品中绝大部分的基质干扰物,空白小麦粉基质的TeA和TEN质谱响应和纯溶剂TeA和TEN的质谱响应差别不大。为完全消除小麦粉样品基质效应的影响,在小麦粉样品中加入13C2-TeA和D3-TEN混合同位素内标溶液并浸泡过夜,使得同位素内标参与小麦粉样品前处理的全部过程,从而达到完全消除样品基质效应的影响。通过空白基质加标回收试验,基质标准曲线法的加标回收率和同位素内标稀释法加标回收率结果差别在±5.0%以内,且均在100%±5%控制范围内(见表2)。

表 2 采用基质标准曲线法和同位素内标稀释法时的检测结果Table 2 Detected results when using matrix standard curve and isotope internal standard dilution methods
2.3 方法学考察
2.3.1 线性范围
根据文献[16]报道我国小麦粉中TeA(1.76~520 μg/kg)和TEN(2.72~129 μg/kg)的含量范围,结合本研究小麦粉标准物质中TeA和TEN的含量水平,同时参考我国总膳食调查和水果中交链孢霉毒素的相关研究[16-20],制备了系列不同浓度的标准溶液和空白小麦粉基质加标溶液,连续3 d重复实验。结果显示,小麦粉中TeA含量在1.0~750 μg/kg 和TEN含量在0.2~150 μg/kg 时,TeA和TEN含量与其色谱峰面积呈线性相关,相关系数(r)均大于0.999,完全满足我国小麦粉中TeA和TEN的定量分析要求和小麦粉标准物质中TeA和TEN的定值要求。
2.3.2 检出限和定量
由于我国尚未制定小麦粉中TeA和TEN的限量标准,考虑到所研制的小麦粉标准物质中TeA和TEN含量水平(TeA: 100 μg/kg 和200 μg/kg, TEN: 20 μg/kg 和40 μg/kg)和文献[16]报道我国小麦粉中TeA和TEN的污染水平,需要建立一个准确、灵敏、精密度高的检测方法,用于小麦粉标准物质中TeA和TEN的定值和后续研究的暴露评估。参考相关研究[16-20]并结合本研究特性发现,在ESI-模式下,TeA和TEN的灵敏度明显高于ESI+模式,ESI-模式下脱氢活性更强的TEN离子化效率比TeA高,使得MRM模式下TEN的灵敏度高出TeA大约6~7倍。综合考虑本研究仪器检测灵敏度和我国小麦粉中TeA和TEN的含量范围,通过空白小麦粉基质加标方式,以定性离子通道中信噪比(S/N)为3时和10时样品溶液中目标化合物的浓度为检出限和定量限,最终得到本研究检测方法的检出限为0.5 μg/kg(TeA)和0.1 μg/kg(TEN);定量限为1.5 μg/kg(TeA)和0.3 μg/kg(TEN)。
2.3.3 加标回收试验
在阴性小麦粉样品(不含TeA和TEN)中加入低、中、高3个水平的TeA和TEN,每个加标样品取6个平行样。结果表明,TeA的加标回收率为98.9% ~104.6% ,相对标准偏差为1.5% ~3.8% ; TEN的加标回收率为99.6% ~103.7% ,相对标准偏差为1.4% ~3.1%(见表3)。实验结果显示本方法准确度和精密度良好。

表 3 阴性小麦粉样品中TeA和TEN的加标回收率和相对标准偏差(n=6)Table 3 Spiked recoveries and RSDs of the TeA and TEN in negative wheat flour samples (n=6)
2.4 标准物质定值方式和要求
本研究采用多个实验室合作定值的方式进行小麦粉中TeA和TEN标准物质定值工作。依据《一级标准物质技术规范》[7]要求,共制定了4条定值原则:(1)合作定值实验室均为国内先进水平的实验室,定值工作由技术熟练的专业人员操作,确保定值数据的准确性;(2)使用统一的标准物质、同位素内标溶液和固相萃取柱等关键耗材,确保定值结果的溯源性;(3)使用统一的定值方法,确保系统误差的一致性;(4)各定值实验室的定值工作在不同的工作日内进行。
本次定值实验室选择可代表我国食品检测领域的权威实验室,且在各自领域内具备国内领先水平。其中,国家粮食和物资储备局科学研究院拥有我国粮油质量安全重点实验室和国家粮食局粮油质量检验测试中心,可代表我国粮油检测领域的权威实验室;中国食品药品检定研究院是我国检验食品药品生物制品质量的法定机构和最高技术仲裁机构,可代表我国食品药品检测领域的权威检测机构;北京出入境检验检疫局技术中心(现北京海关技术中心)可代表我国进出口食品安全检验检疫方面的权威机构;山东省食品药品检验研究院可代表我国省级食品药品检验领域的领先水平;上海市疾病预防控制中心、江苏省疾病预防控制中心、浙江省疾病预防控制中心和山东省疾病预防控制中心是我国经济发达地区的疾病预防控制机构,其实验室检测能力可代表我国疾病预防控制机构食品安全检测领域的领先水平。此外,定值实验室还需拥有国际主流品牌的液相色谱-串联质谱仪,为该标准物质定值的必备条件,确保满足定值方法规定的检测灵敏度和精密度要求。由于无法获得小麦粉中TeA和TEN的基体标准物质,各定值实验在开展定值工作前,需对本研究建立的定值方法的有效性进行方法学验证,包括对目标物保留时间、定量定性离子丰度比和标准溶液响应因子的确认,以及对定量限、全程空白和回收率的控制等来确保定值方法的准确、可靠。
在定值工作开展前,为确保定值工作的规范性和可操作性,本研究组向各定值单位发放了定值邀请函、定值工作说明和定值方法标准操作程序等材料,并明确了各定值单位加标回收试验的加标量、定值报告格式和定值结果报送时间(15个工作日内)等相关要求。在确认各定值单位对定值工作无疑义后,向各定值单位发放小麦粉细交链孢菌酮酸和腾毒素标准物质定值样品(高、低含量各2袋),每袋至少取样6次,提供6个测定结果,4袋样品至少提供24个定值数据,同时提交空白小麦粉样品的加标回收试验数据。为确保定值的可溯源性与质量控制,同时向各定值单位发放TeA和TEN标准溶液、同位素内标溶液、HLB固相萃取柱和空白小麦粉样品等关键耗材。

表 4 小麦粉中TeA和TEN标准物质含量定值及不确定度Table 4 Certified values and uncertainties of the TeA and TEN in wheat flour
uhb: homogeneity uncertainty;us: stability uncertainty;uchar: multi-laboratory characterizations uncertainty;ucal: standard curve measurement uncertainty;u: total uncertainty;k: coverage factor.
2.5 标准物质量值的溯源性
标准物质需要使用可溯源的基准试剂进行定值,以确保测量结果的溯源性[7]。实际工作中一般采用可溯源的有证标准物质(CRM)进行定值测量,当可溯源的有证标准物质无法获得时,应尽可能使用溯源性良好的纯度标准物质(或标准溶液)。由于目前国内外均无法获得TeA和TEN的有证标准物质,本定值工作所使用的TeA和TEN标准溶液均购于英国政府化学家实验室,虽然该标准溶液不是有证标准物质,但该标准溶液证书具有完整的定值报告和明确的不确定度范围,所使用的TeA纯度标准物质的纯度值为99.5%±0.5% , TEN纯度标准物质的纯度值为99.2%±0.8% ,其结构和纯度均通过核磁、高分辨质谱等权威方法进行确认,是目前国际上所能获得的纯度最高的TeA和TEN纯度标准物质,具有良好的溯源性。另外,本研究所使用的13C2-TeA标准物质购于德国Sigma_Aldrich公司,D3-TEN标准物质购于加拿大Toronto Research Chemicals公司,13C2-TeA标准物质和D3-TEN标准物质也是目前所能获得的唯一的同位素标准物质,它们的结构和纯度也通过核磁、高分辨质谱等权威方法进行确认,同位素纯度均大于99% ,化学纯度大于98% ,使用前均通过高分辨质谱确认其杂质不影响TeA和TEN的测定,完全满足同位素内标稀释法定值的相关要求。
2.6 标准物质不确定度评定
依据《标准物质定值的通用原则及统计学原理》[8]的要求,标准物质总不确定度一般由3部分组成:(1)通过定值数据的标准偏差、测量次数和确定的置信水平按统计方法得出;(2)对定值方法影响因素的分析,分项计算得出;(3)标准物质均匀性和有效期内的变化所引起的误差。应用到本研究可细化成4个部分组成:(1)均匀性引入的不确定度(uhb),此项可分为袋间均匀性引入的不确定度和袋内均匀性引入的不确定度;(2)稳定性引入的不确定度(us),此项可分为短期稳定性引入的不确定度和长期稳定性引入的不确定度;(3)多个实验室定值过程中引入的不确定度(uchar),此项可分为所有定值数据的不确定度和定值过程中的各种B类不确定度;(4)标准曲线求得的分析结果的不确定度(ucal)。小麦粉中细交链孢菌酮酸和腾毒素标准物质含量定值及不确定度见表4,各实验室定值数据的相对标准偏差在可接受范围内,标准物质的均匀性和稳定性良好。
3 结论
本研究采用天然污染TeA和TEN的小麦样品基质,经粉碎、筛粉、混匀、灭菌、分装等制备工序,研制成均匀性和稳定性良好的小麦粉中细交链孢菌酮酸和腾毒素标准物质,采用固相萃取-同位素稀释-液相色谱-串联质谱法进行检测,由国内不同领域的10家权威实验室联合定值,是国内外首例小麦粉中细交链孢菌酮酸和腾毒素标准物质,具有目标物浓度为自然条件下天然含量水平,均匀度好和定值不确定度小等优点。本标准物质已获批国家二级标准物质(标准号:GBW(E)100547和GBW(E)100548),经山东省农科院农业质量标准与检测技术研究所和安徽省农产品质量安全检测中心等单位试用,效果良好。本标准物质的成功研制,为促进国内交链孢霉毒素检测技术的提升提供技术支持,也为国内食品中细交链孢菌酮酸和腾毒素的暴露监测数据的准确性提供依据。