高温氮化对Hβ 分子筛物化性能的影响研究
2020-05-22曹丽媛刘浩玮李飞杰刘海燕
曹丽媛,刘浩玮,李飞杰,刘海燕
中国石油大学(北京) 化学工程与环境学院, 北京 昌平102249
碱性分子筛是一类重要的固体碱催化剂。高温氮化法,即将分子筛置于氨气或氮气气氛中在一定温度下进行焙烧,是制备碱性分子筛的重要方法。该方法可以将氮原子引入分子筛骨架,取代骨架中的部分氧原子,使分子筛骨架碱性增强,同时改变分子筛的表面性质,使其催化性能发生改变[1]。近年来,高温氮化法制备碱性分子筛成为了研究热点,研究者已成功制备出多种含氮的微孔、介孔分子筛材料,如氮化MCM-41[2],MCM-22[3],SAPO-34[4],ZSM-5[5-7],HY[8-10]以及Beta[11-12]等。由于氮化后分子筛会产生碱性位,因此具有一定的碱性,通常将其用于Knoevenagel 缩合反应中,并表现出较好的催化活性。因为微孔分子筛结构的有序性和稳定性较高,难以通过高温氮化法使氮原子大量替代氧原子,导致氮化后分子筛中的氮原子含量较低,并且碱性较弱,使得对分子筛碱性和氮原子存在形式的表征有一定的困难。
本工作采用高温氮化法,在不同的氮化温度下制备了N-Hβ 分子筛。采用X 射线衍射(XRD)、场发射扫描电镜(SEM)、N2吸附脱附、红外光谱(FT-IR)、X 射线光电子能谱(XPS)、NH3程序升温脱附(NH3-TPD)和CO2程序升温脱附(CO2-TPD)等方法对制备的N-Hβ 分子筛的物化性质、骨架结构以及酸碱性质进行了详细的表征。
1 实验部分
1.1 氮化Hβ 分子筛的制备
称取一定量的Hβ 分子筛(南开催化剂厂生产,SiO2和Al2O3分子比为25)平铺在石英舟中,放入管式反应炉恒温区内。抽真空1 h 后,先通入N2排出管式反应炉中的杂质气体,然后关闭N2阀,通入NH3(气体流量为60 mL/min)。气流稳定后开始加热,待炉温升至所需温度开始计时,保持8 h。反应完成后,停止加热,继续通入N2,使样品在N2流(气体流量为60 mL/min)中冷却至室温。分别将200 和800 ℃氮化处理的样品记作N-Hβ-200 和N-Hβ-800。
1.2 催化剂表征
采用荷兰PANalytical EMPYREAN 型X 射线衍射仪(XRD)分析样品的晶相结构,Cu Kα 辐射(波长为0.154 nm),管电压为40 kV,管电流为40 mA,扫描范围为5~50°。结晶度的计算方法:以Hβ 分子筛做为标准样品,其结晶度为100%;计算XRD 图谱中20.4~24.8°范围的峰面积,峰面积计算公式如式(1)所示:

其中:XR为标样的结晶度;Ai为待测样品的峰面积;AR为待测标样的峰面积。
样品的晶体形貌使用德国ZEISS Gemini 300 型场发射环境扫描电子显微镜(SEM)观察,加速电压5 kV,4 万倍,并使用与扫描电镜连接的能谱仪(EDS)对样品进行N 元素含量分析。采用美国麦克仪器公司生产ASAP 2020M 全自动物理吸附仪分析样品的比表面积及孔结构,分子筛首先在106 Pa,350 ℃下脱气5 h,然后进行氮气吸附脱附实验。用Brunaur-Emmett-Teller(BET)方法计算比表面积,t-plot方法计算微孔表面积和微孔体积。样品的酸、碱性在中国彼奥德公司生产的化学吸附仪上分别采用NH3-TPD 和CO2-TPD 方法进行表征。测定方法为:将100 mg 催化剂(20~40 目)装于石英管中,先在N2气氛下程序升温至500 ℃,吹扫30 min 之后,降温至100 ℃,通入NH3或CO2(气体流量为30 mL/min),吸附15 min。然后将气体切换至N2,待基线稳定后以10 ℃/min 的升温速率程序升温至600 ℃(CO2升温至700 ℃)进行脱附。样品的骨架结构和官能团信息在德国Bruker 80V 型傅里叶变换红外光谱仪上进行表征。扫描次数为32 次,分辨率为4 cm-1。羟基红外(OH-IR)测试条件:将20 mg 样品压成直径为13 mm 的圆片放入原位池中,在400 ℃下真空脱气1 h,冷却至室温后测试。吡啶红外(Py-IR)测试条件:将20 mg 样品压成直径为13 mm 的圆片放入原位池中,在400 ℃下真空脱气1 h,冷却至室温采集背景并吸附吡啶蒸汽10 min;然后脱气升温至200 ℃,保持30 min,冷却至室温,扫描总酸图谱;再次脱气升温至350 ℃,保持30 min,冷却至室温,扫描强酸图谱,将图谱进行积分计算得出酸量值。采用英国Thermo Fisher 公司生产的Kα 型X 射线光电子能谱仪(XPS)分析N 元素的化合态,单色Al Kα X 射线辐射源(1 486.74 eV),分辨率为0.5 eV,窄扫描透过能为30 eV。
2 结果与讨论
2.1 氮化处理对分子筛物化性质的影响
图1 为Hβ 分子筛,N-Hβ-200 和N-Hβ-800 的XRD图谱。从图中可见,氮化后样品的XRD 图谱中仍然具有与Hβ 分子筛相同的XRD 特征衍射峰,但其峰强度略有降低。Hβ 及在不同温度下氮化处理所得的N-Hβ-200 和N-Hβ-800 分子筛的结构参数如表1 所示。由表1 可知,200 ℃氮化后,N-Hβ-200 的相对结晶度降为95%,随着氮化温度升高至800 ℃,所得样品的相对结晶度降低至86%。说明氮化处理对分子筛的晶体结构产生了一定程度的破坏,且氮化温度越高,破坏程度越大。由氮化前后样品的SEM 照片(如图2)可见,随着氮化温度的升高,分子筛的晶粒大小和形貌均没有发生明显的变化。

图1 Hβ,N-Hβ-200 和N-Hβ-800 的XRD 图谱Fig.1 XRD patterns of Hβ, N-Hβ-200 and N-Hβ-800

图2 Hβ,N-Hβ-200 和N-Hβ-800 的SEM照片Fig.2 SEM images of Hβ, N-Hβ-200 and N-Hβ-800
由表1 还可以看出,经200 ℃氮化处理后,分子筛的总比表面减小11%,微孔比表面积减小14%,总孔容和微孔孔容均略有减少,可见该温度下进行氮化处理,对分子筛的孔结构影响较小。经800 ℃氮化处理后,分子筛的总比表面积减少50%,引起总比表面积减小的主要原因是微孔比表面积的大幅降低;此外,N-Hβ-800 的总孔容也由处理前的0.46 cm3/g 大幅减小到0.16 cm3/g,介孔孔容从0.27 cm3/g减小到0.11 cm3/g,而微孔孔容减小至0.05 cm3/g。由上述分析可知,当氮化温度较高(800 ℃)时,分子筛中部分Si-O-T 键发生断裂,导致骨架结构部分坍塌[12]。但从XRD 图谱可知,N-Hβ-800 的相对结晶度与原样品相比并未大幅降低,说明经氮化处理后Hβ 分子筛的晶相结构并未遭到严重破坏,所以高温氮化处理后,分子筛比表面积和孔容的大幅降低主要归因于Si-O-T 键断裂后的生成的Si 和Al 原子对其微孔孔道的严重堵塞。
从表1 中还可以看出,N-Hβ-200 和N-Hβ-800 中氮的质量分数分别为0.84%和2.33%,说明经氮化处理后,一定量氮原子进入Hβ 分子筛骨架,取代了骨架中的氧原子[1],并且随着氮化温度的升高,引入分子筛中的氮含量逐渐增加。

表1 Hβ,N-Hβ-200 和N-Hβ-800 结构参数Table 1 Textural properties of Hβ, N-Hβ-200 and N-Hβ-800
2.2 氮化对分子筛骨架结构的影响
Hβ,N-Hβ-200 和N-Hβ-800 的FT-IR 图谱如图3 所示。由图可见,氮化处理前后,分子筛的FT-IR 图谱中在1 230,1 080,796,570,525 和430 cm-1处均出现吸收峰,这些峰归属于Hβ 分子筛Si-O 和Al-O 的振动吸收峰[13],说明杂原子氮的引入及高温处理并没有使分子筛的骨架结构发生明显的变化。但氮化处理后,1 230 和1 080 cm-1处的振动峰向高频偏移,这与分子筛骨架发生了不同程度的氮原子取代有关[14-15]。NARASIMHARAO 等[12]认为振动峰的偏移是由于氮原子引入分子筛骨架取代了氧原子,导致骨架失去氧原子后,结构无序性增加和键张力变化引起的。

图3 Hβ,N-Hβ-200 和N-Hβ-800 的的FT-IR图谱Fig.3 FT-IR spectra of Hβ, N-Hβ-200 and N-Hβ-800
为了进一步探究分子筛氮化处理的反应机理,将Hβ 和N-Hβ-800 两种分子筛进行了OH-IR 表征,结果如图4 所示。由图可见,经800 ℃氮化处理后,位于3 745 和3 609 cm-1处归属于Hβ 分子筛末端Si-OH 和Si-OH-Al 的伸缩振动峰均向高波数偏移,且强度减弱,说明NH3与分子筛中的部分端-OH和桥-OH 发生反应,使得端-OH 和桥-OH 的量都有所减少。而且随着氮原子的引入,使未参与反应的-OH 因外部化学环境的改变,导致其出峰位置发生了相应的变化[16-17]。除此之外,在N-Hβ-800 分子筛的OH-IR 谱图中,在3 490 和3 400 cm-1处出现了较弱的吸收峰,分别归属于端-NH2和桥-NH-的伸缩振动峰[5,12]。综合上述分析说明,在高温氮化过程中,氮原子取代了氧原子,进入了分子筛骨架,产生了Si-NH2-Al,Si-NH-Al,Si-NH-Si 和Si-NH2等新物种。将N-Hβ-800 分子筛进行了N 1s的XPS 表征,结果如图5 所示。结合能在402.1 eV 处出现的峰,可归属于NH4+。SRASRA 等[18]认为,这可能是由于氮化处理后,电荷补偿所产生的正离子,因其强度相对低,也证明它的含量非常少。而结合能在399.5 eV 处出现的较高强度峰,可归属为-NH2和-NH-中的N 原子所产生的[18],这与OH-IR表征结果一致。
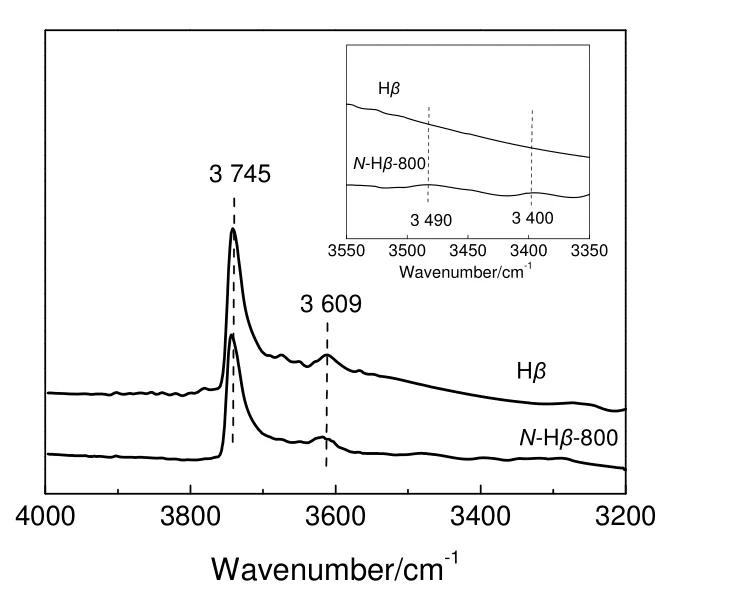
图4 Hβ 及N-Hβ-800 分子筛的OH-IR 图谱Fig.4 OH-IR spectra of Hβ and N-Hβ-800

图5 N-Hβ-800 的N 1s XPS图谱Fig.5 N 1s XPS peak spectra of N-Hβ-800
2.3 氮化对分子筛酸碱性质的影响
氮原子进入分子筛骨架,将会在一定程度上调变分子筛的酸碱性[1]。Hβ,N-Hβ-200 和N-Hβ-800 样品的NH3-TPD 图谱如图6 所示。由图6 可见,Hβ 分子筛的NH3-TPD 图谱在210,260 和405 ℃分别出现了3 个NH3的脱附峰。其中210和260 ℃对应于分子筛的弱酸中心,405 ℃对应于强酸中心。N-Hβ-200 在同样的位置出现了脱附峰,但其峰面积减小,证明200 ℃氮化处理的样品与Hβ 相比酸强度并未发生明显变化,但强酸酸量和弱酸酸量均有所减少。经800 ℃氮化处理后,N-Hβ-800 的NH3-TPD 图谱中代表强酸和弱酸的NH3脱附峰分别移至370,245 和190 ℃,且峰面积大幅减小,说明经分子筛的总酸量减少、酸强度减弱。

图6 Hβ,N-Hβ-200 和N-Hβ-800 的NH3-TPD 图谱Fig.6 NH3-TPD curves of Hβ, N-Hβ-200 and N-Hβ-800
将Hβ,N-Hβ-200 和N-Hβ-800 进行Py-IR表征分析其酸类型和酸量,结果见表2。经过氮化处理后Brönsted(B)酸和Lewis(L)酸的总酸量和中强酸酸量均大幅降低。氮化处理温度为200 ℃时,N-Hβ-200分子筛的L酸量仅为氮化处理前的30%左右,总B酸酸量仅为50%左右;氮化处理温度升至800 ℃后,所得样品的L酸量进一步降低至原来的23%,总B酸酸量仅为原来的39%左右。L酸减弱与氮化过程中部分Si-O-Al断裂脱铝有关,而B酸减弱是NH3与分子筛中-OH发生反应,使得-OH的量都有所减少引起的[5]。

表2 Hβ,N-Hβ-200 和N-Hβ-800 的酸类型和酸量表Table 2 Acid types and amounts of Hβ, N-Hβ-200 and N-Hβ-800
Hβ,N-Hβ-200和N-Hβ-800的CO2-TPD图谱如图7所示。由图可见,在氮化前Hβ分子筛的CO2-TPD谱图中只在205 和400 ℃出现了一个弱碱性位的脱附峰和一个强碱性位的脱附峰,出现在205 ℃的脱附峰对应于CO2物理吸附于Hβ 分子筛所产生的脱附峰,而400 ℃出现的强度较弱的脱附峰是Hβ 分子筛中O2-和-OH 吸附CO2产生的[15]。N-Hβ-200 的CO2-TPD 谱图与Hβ 比较差别不大,这是因为在在200 ℃氮化条件下,N-Hβ-200 分子筛可能会产生一定量的碱性位,但由于此时引入氮含量只有0.84%,使得这部分碱性位无法显示出来。与Hβ 和N-Hβ-200不同,N-Hβ-800 的CO2-TPD 图谱中分别在300,380和480 ℃出现了3 个CO2脱附峰。研究表明,此处脱附峰分别归属于Si-NH2-Al,Si-NH-Al 和Si-NH-Si物种[15],其中,Si-NH2-Al 碱性最弱,Si-NH-Si 碱性最强,Si-NH-Al 的碱性居中。上述结果表明,经800 ℃氮化处理后,Hβ 分子筛中产生了明显的碱性位,从而调变了Hβ 分子筛的酸碱性。

图7 Hβ,N-Hβ-200 和N-Hβ-800 的CO2-TPD图谱Fig.7 The CO2-TPD curves of Hβ, N-Hβ-200 and N-Hβ-800
3 结 论
采用氮化处理法对Hβ 分子筛进行改性,结果表明:处理温度为200 和800 ℃时,Hβ 分子筛的晶相结构和骨架结构均未遭到严重破坏,但分子筛的比表面积和孔体积减小,酸量和酸强度明显降低,且随着氮化温度的升高,进入分子筛骨架的氮原子越多。XPS,CO2-TPD 以及OH-IR 等表征结果表明,当氮化温度为800 ℃时,所得样品中出现-NH2-和-NH-基团,产生了新的碱性位。
