日龄和交配状态对亚洲玉米螟雄蛾内生殖器特征的影响
2020-05-22张万民屈丽莉王浩杰杜永均
冯 波, 张万民, 张 丹, 屈丽莉, 孟 威, 王 巍, 王浩杰, 杜永均
(1. 温州医科大学健康与环境生态研究所, 浙江温州 325035; 2. 辽宁省绿色农业技术中心, 沈阳 110034;3. 宁波纽康生物技术有限公司, 浙江宁波 315000; 4. 浙江大学农药与环境毒理研究所, 杭州 310058)
基于性信息素的害虫诱捕技术(性诱技术)已经在害虫测报(冯波等, 2017)和防治(杜永均等, 2013; 冯波等, 2019; 郭前爽等, 2019)过程中发挥重要作用。亚洲玉米螟Ostriniafurnacalis属于鳞翅目草螟科,一直是危害我国各地玉米的主要害虫 (何康来等, 2002)。我国从20世纪80年代就已经开始利用性诱技术监测和防治亚洲玉米螟 (程誌青等, 1982; 谢为民, 1992; 胡代花等, 2015),并且亚洲玉米螟性诱剂的诱蛾量可以达到黑光灯的11~26倍 (李文德, 1982; 李枝伟, 1992),但是到目前为止,利用性诱剂群集诱杀亚洲玉米螟的推广应用并不广泛,这可能与性诱剂群集诱杀防控亚洲玉米螟的机理不明有关,因为性诱剂仅能引诱部分雄蛾,并且亚洲玉米螟雄蛾存在多次交配现象(冯波等, 2020),如何从理论上阐述性诱剂群集诱杀亚洲玉米螟的有效性显得很有必要。
在交配过程中,雄蛾储精囊和复射精管内储存的精子通过单射精管进入雌蛾体内 (Spurgeonetal., 1994),附腺分泌精液,保证精子达到雌蛾受精囊前有足够的营养和合适的环境 (Bakeretal., 2003),单射精管内含物则参与了精包形成 (Fänger and Naumann, 1993),因此可以利用射精管内含物的颜色来判定雄蛾的交配状态 (Spurgeonetal., 1994; 周娇等, 2012; Zhangetal., 2017)。例如,交配后12 h内二化螟Chilosuppressalis雄蛾生殖器内含物和未交配雄蛾明显不同,但是到交配后24 h已经完全恢复(郭前爽等, 2019)。交配对亚洲玉米螟雄蛾生殖系统的影响目前还不清楚。也有学者研究了羽化日龄对欧洲玉米螟Ostrinianubilalis(Hu and Andow, 2009)、梨小食心虫Grapholitamolesta(Zhangetal., 2017) 和二化螟(郭前爽等, 2019)雄性生殖系统的影响,但是未见日龄对亚洲玉米螟雄性生殖系统的影响的研究报道。为此,本文详细描述了亚洲玉米螟雄蛾的内生殖系统,分析了不同日龄和交配状态亚洲玉米螟雄蛾的内生殖器特征,比较了田间性诱剂引诱亚洲玉米螟雄蛾的内生殖系统,从而明确了亚洲玉米螟雄蛾的内生殖系统组成,日龄、交配状态和交配后时间对雄蛾内生殖系统的影响,为性信息素诱捕测报和防治亚洲玉米螟提供理论依据。
1 材料与方法
1.1 试虫
2019年5月在辽宁省采集含有越冬代亚洲玉米螟老熟幼虫的玉米秆并带回浙江宁波室内饲养。饲养条件参考于洪春等(2018),温度为28±1℃,相对湿度为75%±10%,光周期为16L∶8D (20∶00时开始黑暗)。每天9∶00时收集新羽化的亚洲玉米螟成虫。根据成虫腹部特征(雄蛾在第5节可见腹板后面还有酷似一节的外生殖器)和翅面颜色(雄蛾翅面颜色更深,斑纹更明显)鉴别雌雄。雌雄成虫分开饲养,喂以10%蜂蜜水,每天19∶00时饲喂一次。9∶00时收集的亚洲玉米螟成虫均为前一晚羽化,标记为1日龄,其余日龄以此类推。羽化0 d亚洲玉米螟雄蛾通过以下方法获得:9∶00时将前一晚羽化的亚洲玉米螟成虫收集干净后,在20∶00时再次收集新羽化的亚洲玉米螟雄成虫,标记为羽化0 d。
1.2 亚洲玉米螟雌雄蛾生殖系统解剖
将亚洲玉米螟蛾体背面向上,从基部取下腹部,放入75%酒精中,利用镊子从腹基部开始,小心地将腹部各节的背板和腹板去掉,这样整个生殖器官可以完整地暴露在外。对于雄蛾而言,去掉雄蛾的消化系统并小心地剔除生殖器表面的脂肪体,得到完整的雄蛾内生殖系统。对于雌蛾而言,找到雌蛾的交配囊,确定其内含有的精包数量。雄蛾内生殖系统解剖完成后,摆好各部位的姿势,利用Motic显微照相系统进行拍照。雄蛾生殖器内含物等级参考已发表欧洲玉米螟 (Hu and Andow, 2009) 的分类方法进行划分。
1.3 不同日龄未交配亚洲玉米螟雄蛾内生殖系统比较
由于9∶00时收集的亚洲玉米螟成虫均为前一晚羽化,因此标记为羽化后1 d,其余羽化日龄以此类推。选择羽化后1, 3, 6和9 d的未交配雄蛾,在20∶00-22∶00时按照1.2节方法解剖雄蛾生殖系统,每日龄各解剖雄蛾8~10头,并进行拍照比较。雄蛾生殖器内含物等级参考已发表欧洲玉米螟(Hu and Andow, 2009)和二化螟(郭前爽等, 2019)的分类方法进行划分。
1.4 交配后亚洲玉米螟雄蛾生殖器内含物等级的测定和观察
18∶00时将当日9∶00时收集的新羽化亚洲玉米螟雌蛾和雄蛾按8∶8比例放入交配笼(长×宽×高=30 cm×30 cm×30 cm)中,从19∶00时开始,每隔20 min检查一次亚洲玉米螟的交配情况,发现亚洲玉米螟交配时,将正在交配的亚洲玉米螟雌雄个体移入新的一次性塑料杯中,记录交配时间。交配结束后,根据第5节可见腹板后面还有酷似一节的外生殖器和翅面颜色更深、斑纹更明显等特征鉴别出雄蛾,按照交配后0, 12, 24, 36, 48, 60, 72, 96, 120, 168和228 h分别解剖6头雄蛾生殖系统,同时解剖与之交配的雌蛾交配囊,检查精包数量,确定雌雄是否成功交配。
1.5 田间性信息素诱集亚洲玉米螟雄蛾的生殖器内含物等级的观察
田间性信息素诱集亚洲玉米螟试验于2019年7月在黑龙江省哈尔滨市双城区进行。选择玉米长势较均匀、日常管理基本一致的3个试验点,各试验点间距大于1 km。每个试验点设置3个诱捕器,每个诱捕器安装1枚诱芯,各诱捕器间距30 m以上。诱捕器悬挂高度为50 cm。试验用的亚洲玉米螟性信息素PVC毛细管诱芯和新型飞蛾诱捕器都由宁波纽康生物技术有限公司提供。在每日8∶00-10∶00时解剖诱捕器中诱集的亚洲玉米螟雄蛾,本实验共解剖64头田间性诱亚洲玉米螟雄蛾。
1.6 数据分析
数据分析采用软件SPSS 17.0。多组平均数间的差异显著性分析则采用One-way ANOVA中的LSD法。
2 结果
2.1 亚洲玉米螟雄蛾内生殖系统组成
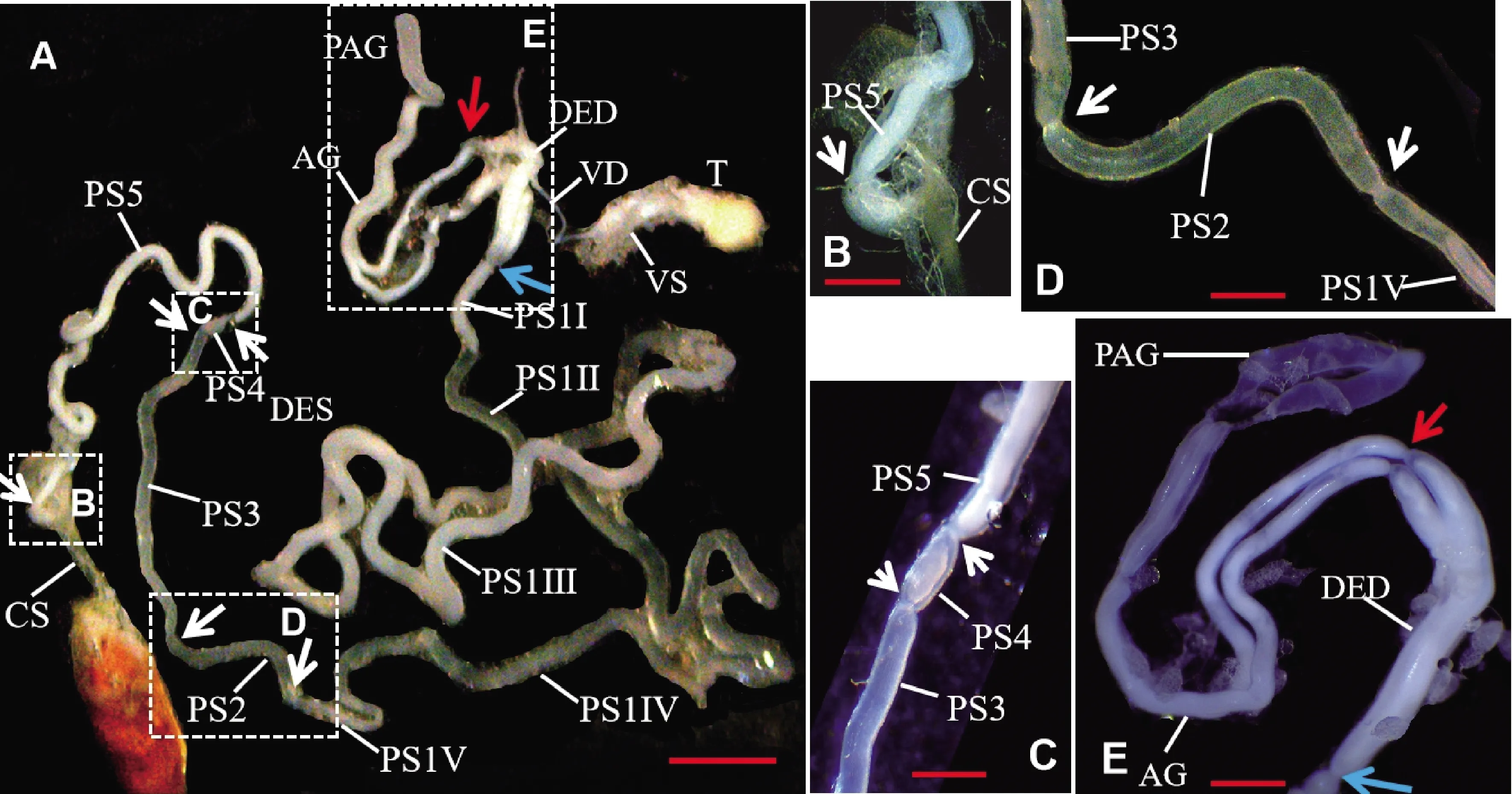
图1 亚洲玉米螟雄蛾内生殖系统Fig. 1 Internal reproductive system of male moths of Ostrinia furnacalis图B~E对应图A中的4个方框。以输精管和复射精管的连接点为中心,远离该点为端部,靠近该点为基部。白色箭头表示单射精管非角质化区上的5个缢缩,将非角质化区分为5段 (PS1-5); 蓝色箭头表示单射精管和复射精管间的缢缩; 红色箭头表示复射精管和附腺间的缢缩。图中红线表示标尺,图A为1.5 mm,图B~E为0.6 mm。Figs. B-E correspond to the four boxes in Fig. A. The junction of vas deferens and ductus ejaculatorius duplexes is used as the center, the far part from the junction as the terminal end and the near part from the junction as the base. The white arrows indicate five constrictions in the primary segment of ductus ejaculatorius simplex, which divide the primary segment into five segments (PS1-5). The blue arrow indicates the constriction between ductus ejaculatorius simplex and ductus ejaculatorius duplexes. The red arrow indicates the constrictions between ductus ejaculatorius duplexes and accessory glands. Red lines in these figures are the scale bar, which are 1.5 mm in Fig. A and 0.6 mm in Figs. B-E. AG: 附腺Accessory glands; CS: 单射精管角质化区Cuticular segment of ductus ejaculatorius simplex; DED: 复射精管Ductus ejaculatorius duplexes; DES: 单射精管Ductus ejaculatorius simplex; PAG: 附腺囊Pond of accessory glands; PS: 单射精管非角质化区Primary segment of ductus ejaculatorius simplex; PS1Ⅰ-PS1Ⅴ: PS1的5个区 Five regions of PS1; T: 精巢Testis; VD: 输精管Vas deferens; VS: 储精囊Vesiculae seminales.
亚洲玉米螟雄蛾内生殖系统由1个精巢 (testis, T)、1对输精管(vas deferens, VD)、1对附腺(accessory glands, AG)、1对复射精管(ductus ejaculatorius duplexes, DED)和1条单射精管 (ductus ejaculatorius simplex)组成 (图1)。精巢近圆球形,淡黄色。输精管端部与精巢相连,基部与复射精管相连,中部膨大为储精囊(vesiculae seminales, VS)。复射精管一端与单射精管基部相连,另一端与附腺基部相连。附腺短,约为复射精管长度的3倍,两条附腺基部1/2彼此分离,端部相互合并。附腺端部分化出1对附腺囊(pond of accessory glands, PAG)。单射精管端部与外生殖器的中茎相连。根据体壁是否角质化将单射精管分为角质化区(cuticular segment, CS)和非角质化区(primary segment, PS)。根据单射精管非角质化区上的缢缩,可以将单射精管非角质化区分为5段(PS1-5) (图1),PS1很长,占了整个单射精管长度的2/3;PS4极短,PS3和PS5长度相似,长于PS2的2倍。根据单射精管的内含物形态,可以将PS1分为5个区(PS1Ⅰ-Ⅴ),其中PS1Ⅳ最长,约为PS1长度的一半,PS1Ⅲ长度其次,而PS1Ⅰ, PS1Ⅱ和PS1Ⅴ很短。
2.2 未交配亚洲玉米螟雄蛾内生殖系统内含物的分级和充满程度
输精管、附腺、复射精管、单射精管内均有内含物。根据内含物的疏密程度,可以将未交配亚洲玉米螟雄蛾生殖器内含物分为5级,0级内含物透明,1级内含物半透明,2级内含物不透明,3级内含物淡白色,4级内含物乳白色(图2)。
内含物为均匀的乳白色时,存在充满(图3: A和B) 和未充满(图3: C-F) 两种状态,未充满状态可以表现出下列4种形式,第1种是PS5端部区域内含物缩小,与膜之间有明显的空隙(图3: C);第2种是PS5端部内含物几乎完全退化,导致PS5端部为空(图3: D);第3种是PS5基部内含物缩小,与膜之间有明显的空隙(图3: E);第4种是PS5中部内含物整体缩小,与膜之间有明显的空隙(图3: F)。
2.3 未交配亚洲玉米螟雄蛾内生殖系统不同部位的内含物等级
1日龄雄蛾内生殖器不同部位的内含物等级存在差异(图4)。输精管、储精囊、复射精管、附腺和PS5内含物等级最高,为4级;PS1Ⅰ, PS1Ⅲ和PS1Ⅴ内含物为3级,PS4内含物为2-3级,平均为2.50±0.29级;附腺囊内含物为2级。PS2和PS3内含物为0-1级,平均分别为0.50±0.29级和0.75±0.25级;PS1Ⅱ和PS1Ⅳ内含物为0级。

图2 亚洲玉米螟雄性生殖器内含物分级Fig. 2 Grading of genital contents in the genital duct of male moth of Ostrinia furnacalisA: 0级(PS1Ⅱ), 内含物几乎完全透明Grade 0 (PS1Ⅱ), contents transparent; B: 1级(PS3), 内含物半透明Grade 1 (PS3), contents semi-transparent; C: 2级(PS3), 内含物不透明Grade 2 (PS3), contents non-transparent; D: 3级(PS1Ⅲ), 内含物淡白色Grade 3 (PS1Ⅲ), contents white; E: 4级(PS5), 内含物乳白色Grade 4 (PS5), contents milk white. 内生殖器名称同图1。For names of internal genital organs, refer to Fig. 1. 标尺Scale bar =0.6 mm.

图3 未交配亚洲玉米螟雄蛾生殖器内含物填充状态Fig. 3 Filling status of the genital contents in unmated male adults of Ostrinia furnacalisA-B: PS5内含物为充满状态Primary segment 5 fully filled with contents; C-F: PS5内含物为未充满状态Primary segment 5 not fully filled with contents. 内生殖器名称同图1。For names of internal genital organs, refer to Fig. 1. 标尺Scale bar=0.6 mm.

图4 1日龄亚洲玉米螟雄蛾内生殖器不同部位内含物等级比较Fig. 4 Comparison of the grades of contents in different parts of internal genital organs of 1-day-old male moths of Ostrinia furnacalis内生殖器名称同图1; 柱上不同字母表示不同部位内含物等级差异显著(P<0.05, LSD法)。For names of internal genital organs, refer to Fig. 1. Different letters above bars indicate significant differences in the grade of contents among different genital parts (P<0.05, LSD method).
2.4 日龄对未交配亚洲玉米螟雄蛾内生殖系统的影响
1, 3, 6和9日龄未交配雄蛾内生殖器不同部位的内含物等级无明显差异,表明日龄对雄蛾内生殖器中的内含物等级无影响(图5)。但是6和9日龄未交配雄蛾内生殖器PS5内含物存在充满和未充满两种状态。

图5 不同日龄未交配雄蛾生殖系统比较Fig. 5 Comparison of the reproductive system of unmated male moths of Ostrinia furnacalis of different age in daysA: 1日龄1 day-old; B: 3日龄3 day-old; C: 6日龄6 day-old; D: 9日龄9 day-old.
2.5 交配对亚洲玉米螟雄蛾内生殖系统内含物等级的影响
交配后0 h雄蛾输精管和储精囊内含物较未交配时几乎无变化,仍然为4级,附腺囊内含物等级也几乎无变化,仍然为2级;但是内生殖器其余部位的内含物均呈现出一致的酥松状态,为2级,其中附腺、复射精管、PS1Ⅰ, PS1Ⅲ, PS1Ⅴ, PS4和PS5内含物等级均显著低于未交配雄蛾(P<0.001),而PS1Ⅱ, PS1Ⅳ, PS2和PS3内含物等级均显著高于未交配雄蛾(P<0.001) (图6和7)。随着交配后时间的增加,已交配雄蛾生殖器内含物等级逐渐恢复。交配后12 h,附腺和复射精管内含物等级显著升高为4级 (P<0.001),恢复到未交配状态;PS1Ⅴ和PS5内含物等级分别升高为2.5和3.25级,和未交配雄蛾差异不显著(P≥0.058);PS1Ⅱ, PS1Ⅳ和PS3内含物等级分别降低为1, 1.5和1.75级,仍然显著高于未交配雄蛾 (P≤0.030)。交配后24 h,PS1Ⅰ, PS1Ⅲ和PS1Ⅴ内含物等级恢复到未交配状态;PS1Ⅳ内含物等级降低为1.25级,仍然显著高于未交配雄蛾(P<0.001)。交配后36 h,PS5内含物等级升高为4级,恢复到未交配状态;PS1Ⅱ和PS1Ⅳ的内含物等级分别降低到0.25和0.5级,和未交配雄蛾差异不显著(P≥0.182)。交配后48 h,PS2内含物等级降低为1.5级,和未交配雄蛾差异不显著(P=0.058)。交配后60 h,雄蛾生殖器内含物等级完全恢复到未交配状态。
交配后60 h,PS5内含物的等级虽然恢复到未交配状态,但是内含物却出现了中间断裂(图8: A, D, E)、质地不均匀(图8: B, C)、边界不光滑 (图8: A, E, F)等和未交配内含物不同的形态。并即使到交配后228 h,PS5内含物仍然和未交配雄蛾内含物表现出上述差异(图8)。

图6 交配后不同时间的亚洲玉米螟雄蛾生殖系统Fig. 6 Reproductive system of male moths of Ostrinia furnacalis at different hours after matingA: 交配后0 h (0 h after mating); B: 交配后12 h (12 h after mating); C: 交配后24 h (24 h after mating); D: 交配后36 h (36 h after mating); E: 交配后48 h (48 h after mating); F: 交配后60 h (60 h after mating); G: 未交配Unmated. 标尺Scale bar=3.0 mm.

图7 交配对亚洲玉米螟雄蛾生殖器内含物等级的影响Fig. 7 Effect of mating on the grades of genital contents in male moths of Ostrinia furnacalis内生殖器名称同图1; 柱上不同字母表示同一生殖器部位的内含物等级在交配后不同时间差异显著(P<0.05, LSD法)。For names of internal genital organs, refer to Fig. 1. Different letters above bars indicate significant differences in the grade of contents among different hours after mating for the same genital organ (P<0.05, LSD method).
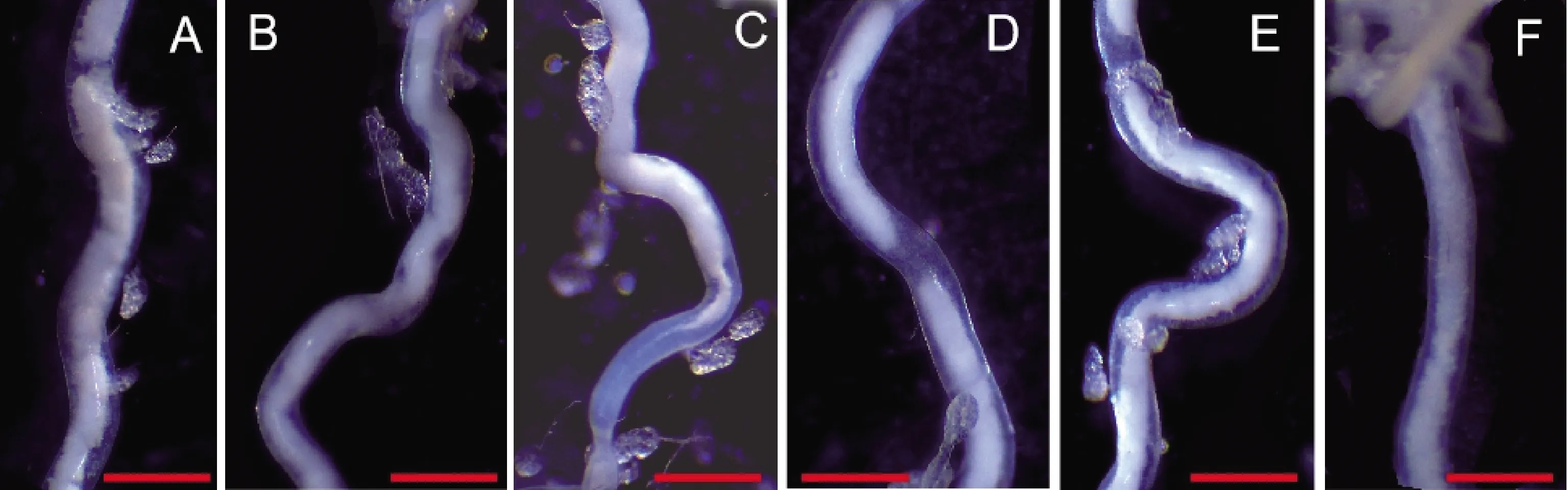
图8 交配后不同时间亚洲玉米螟雄蛾PS5内含物比较Fig. 8 Comparison of genital contents of PS5 in male moths of Ostrinia furnacalisat different time points after matingA: 交配后60 h (60 h after mating); B: 交配后72 h (72 h after mating); C: 交配后96 h (96 h after mating); D: 交配后120 h (120 h after mating); E: 交配后168 h (168 h after mating); F: 交配后228 h (228 h after mating). 标尺Scale bar=0.6 mm.
2.6 田间性诱亚洲玉米螟的交配状态
由于交配和未交配雄蛾的生殖系统存在差异,我们对性诱剂引诱雄蛾的生殖系统进行了解剖,发现田间性诱捕器诱捕到的雄蛾生殖系统表现出多种形态,在解剖的64头性诱雄蛾中,有39头雄蛾生殖系统表现出未交配生殖系统特征,判定为未交配雄蛾,25头雄蛾生殖系统表现出交配后雄蛾生殖系统特征,判定为交配后雄蛾,性诱雄蛾中未交配雄蛾的比例为60.9%。同时,在性诱的未交配雄蛾中,仅有3头生殖系统内含物表现出未充满状态。
3 讨论
亚洲玉米螟雄蛾内生殖系统除了1个精巢、1对输精管、1对附腺、1对复射精管和1条单射精管外,还在附腺端部连接1对短的附腺囊,这和欧洲玉米螟雄性内生殖系统(Hu and Andow, 2009)相似,但是和二化螟等昆虫的生殖系统(郭前爽等, 2019)明显不同。亚洲玉米螟雄蛾的附腺较短,稍长于复射精管长度的2倍,而二化螟雄蛾内生殖系统的附腺很长,约为内生殖器长度的1/3(郭前爽等, 2019)。蛾类单射精管非角质化区可以根据缢缩分为多段,例如斑蛾Zygaenatrifolii的单射精管分为6段 (Fänger and Naumann, 1993),欧洲玉米螟(Hu and Andow, 2009)和二化螟(郭前爽等, 2019)单射精管非角质化区分为7段。本研究发现亚洲玉米螟雄蛾单射精管非角质化区上仅有4处稳定的缢缩,将单射精管非角质化区分为5段(PS1-5)。同时发现PS1内含物等级存在差异,可以细分为PS1Ⅰ-Ⅴ共5个区。羽化日龄并不影响欧洲玉米螟(Hu and Andow, 2009)和梨小食心虫(Zhangetal., 2017)雄性生殖系统内含物等级,但是却显著影响二化螟雄性生殖系统内含物等级(郭前爽等, 2019)。本研究发现,亚洲玉米螟雄蛾内生殖系统内含物等级不受日龄影响。
精巢产生精子,成熟的精子通过输精管储存在储精囊中,交配发生时,储精囊中的精子通过射精管进入雌蛾体内(Osanaietal., 1987)。但是亚洲玉米螟雄蛾交配后0 h输精管和储精囊内含物等级无明显变化,说明这2个组织中的内含物并没有大量参与交配,亚洲玉米螟雄蛾交配过程中射入雌蛾体内的精子并没有储存在输精管和储精囊中。二化螟交配后0 h雄性输精管和储精囊的内含物等级也无明显变化(郭前爽等, 2019)。但是交配后0 h雄蛾内生殖系统中附腺、复射精管和单射精管内含物等级均发生变化,说明这些器官均参与了交配过程。在交配过程中,附腺分泌精液,保证精子达到雌蛾受精囊前有足够的营养和合适的环境(Bakeretal., 2003),单射精管内含物则参与了精包形成(Fänger and Naumann, 1993)。亚洲玉米螟雄蛾体内的大量精子可能储存在复射精管内,在交配过程中随着精液的流动而射入雌蛾体内。类似情况也在二化螟雄蛾内生殖系统中被证实(郭前爽等, 2019)。烟芽夜蛾Heliothisvirescens(Henneberry and Clayton, 1984; Proshold, 1991) 和墨西哥稻螟Eorellmaloftini(Spurgeonetal., 1994)的复射精管内也存在大量精子。亚洲玉米螟雄蛾输精管和储精囊内的精子可能用于交配后再次充满复射精管,为下一次交配做准备。附腺囊的内含物等级在交配后0 h 无明显变化,说明附腺囊也没有直接参与雄蛾的交配过程。附腺囊在鳞翅目昆虫中并不普遍存在,到目前为止我们并不知道其功能。随着交配后时间的增加,已交配雄蛾生殖器内含物等级逐渐恢复,但是各器官内含物等级恢复的速度存在差异。附腺和复射精管内含物等级在交配后12 h即恢复到未交配状态,PS1Ⅰ, PS1Ⅲ和PS1Ⅴ内含物等级在交配后24 h恢复到未交配状态,PS5内含物等级在交配后36 h恢复到未交配状态,到交配后48 h,交配雄蛾内生殖系统的内含物等级才和未交配雄蛾差异不显著,直到交配后60 h,交配雄蛾内生殖系统的内含物等级才能够完全恢复到未交配水平。这也表明交配后亚洲玉米螟雄蛾的恢复速度较慢。相比而言,交配后二化螟雄蛾的恢复速度较快,交配后24 h,二化螟雄蛾生殖系统内含物等级和未交配雄蛾无显著差异,交配后36 h,雄蛾生殖器内含物等级完全恢复到未交配状态(郭前爽等, 2019)。这可能和二化螟雄蛾具有更强的交配能力有关,二化螟雄蛾最多可交配4次,平均2.72次(焦晓国等, 2006)。
到交配后60 h,雄蛾生殖系统内含物等级虽然已经恢复到未交配状态,但是直到交配后228 h,PS5内含物仍然表现出中间断裂、质地不均匀、边界不光滑并有很多小缺刻等特征,和未交配雄蛾的内含物存在形态差异,表明交配后亚洲玉米螟雄蛾的生殖系统并不会完全恢复到未交配状态,依据这些差异可以区别亚洲玉米螟的交配状态。利用雄蛾生殖系统特征判定雄蛾的交配状态在其他昆虫中也有应用。例如可以根据复射精管中精子数量来确定烟芽夜蛾雄蛾的交配状态(Henneberry and Clayton, 1984; Proshold, 1991),利用复射精管的颜色来区别墨西哥稻螟雄蛾的交配状态(Spurgeonetal., 1994),根据单射精管角质化区内含物的有无、第7段内含物颜色和内含物前后两端的空隙 (gap) 判定梨小食心虫(Zhangetal., 2017)、沙棘木蠹蛾Holcocerushippophaecolus(周娇等, 2012)、欧洲玉米螟(Hu and Andow, 2009)、云杉芽卷蛾Choristoneurafumiferana(Bergh and Seabrook, 1986) 和蔷薇斜条卷叶蛾Choristoneurarosaceana(Evendenetal., 2003)雄蛾的交配状态。
亚洲玉米螟雌雄配对时,雌蛾生殖力随着雄蛾比例(0.8∶1~2∶1)增加而明显提高(刘瑞林等, 1983),表明配对的亚洲玉米螟雄蛾并不是完全交配,仅有部分个体能够被雌蛾选择并完成交配。另外亚洲玉米螟雄蛾在选择雌蛾的过程中可能需要耗费较多的能量,精力不足的雄蛾在进行第一次交配前即死亡,仅有精强体壮、竞争力强的雄蛾才能够进行交配,从而保持种群的竞争力(冯波等, 2020)。本研究通过解剖性诱剂引诱亚洲玉米螟雄蛾的生殖系统,发现性诱剂不仅能诱捕到较高比例的未交配亚洲玉米螟雄蛾 (60.9%),而且可以诱集到已经交配过的雄蛾,后一种现象可能是因为雄蛾,特别是交配能力强的个体具有多次交配的习性。而性诱剂引诱雄蛾中已交配雄蛾的比例(31.1%)明显低于室内二次交配雄蛾的比例(45.3%),表明部分具有多次交配能力的雄蛾在交配之前就已经被性诱剂诱杀。这些结果表明性诱剂可以在亚洲玉米螟雄蛾首次交配或再次交配之前将其诱杀,从而大幅降低田间种群的交配比例,压低田间害虫的种群数量,达到防控的目的。因此本研究从理论上证明利用性诱剂群集诱杀测报和防控亚洲玉米螟是可行的。
