冻干法合成高效率电子转移的C-ZIF-67@g-C3N4光催化材料
2020-05-22王烨
王 烨
(哈尔滨师范大学)
0 引言
目前,人们日益增长的能源需求,以及化石燃料的过度开采和使用对环境造成影响,促使人们大力发展清洁能源[1].利用太阳能直接把水分解成氢气和氧气被认为是最环保、最理想收集太阳能转化为化学能的方法之一[2-3].光催化技术因其没有任何有害的副产物并且成本低廉,而备受关注[4-7].各种类型的光响应催化剂一直被开发利用[8-10].其中,无金属高分子石墨氮化碳g-C3N4因其具有适当的带隙、良好的高热和化学稳定性,而具有较好的水分解和降解污染物的性能[11-12].但由于其电荷复合快、光吸收差、比表面积低等特点,限制了g-C3N4的光催化能力[13-14].因此,研究者做了很多努力来增强g-C3N4的光催化性能.例如,掺杂金属或非金属元素、构造异质结以及设计多孔纳米结构[15-19].
碳基纳米材料如碳纳米管、石墨烯、石墨聚丙烯腈可以与g-C3N4形成异质结,促进光生载流子的分离,从而提高了光催化活性[20-22].在该文的工作中,利用沸石咪唑酯骨架结构材料(ZIF-67)和三聚氰胺,通过冻干和热解两步成功合成新型的C-ZIF-67@g-C3N4光催化材料.由热解后的C-ZIF-67衍生出坚固空心的碳纳米管骨架与g-C3N4形成致密异质结,促进光生载流子的分离,提高光催化活性.使材料具有较好光催化水解产氢和产氧的能力.
1 实验详情
1.1 制备
在一个典型的合成过程中,室温下将0.73 mg的六水合硝酸钴溶解在50 mL的甲醇中.与此同时,将0.81 mg的二甲基咪唑溶解在50 mL的甲醇中.在室温下搅拌15 min后快速将上述两种溶液混合在一起,并持续搅拌24 h.离心收集生成的紫色沉淀,用甲醇反复洗涤,然后将所得的紫色粉末在40 ℃下干燥12 h.将紫色粉末放在方船,置于管式炉中在10%的氢氩混合气的环境下退火,在350℃保持1.5 h,在900 ℃时保持3.5 h后降到室温,得到的黑色粉末称为C-ZIF-67.全程升温速率是2 ℃/min.
将100 mg的三聚氰胺和10 mg的黑色粉末C-ZIF-67分别溶解在5 mL的去离子水中,在超声的环境下将两种溶液均匀混合,迅速放入液氮中冷冻,直至溶液完全冷冻后,放入冻干机中冷冻干燥48 h.将得到的灰白色絮状物质放入方船中用锡纸密封,置于管式炉中加热到550℃.升温速率是5℃/min,并保持2 h.反应结束后,将方船冷却到常温,得到的样品称为C-ZIF-67@g-C3N4.为了对比将三聚氰胺同样情况直接加热所得到的样品称为g-C3N4.
1.2 特征描述
产物的形貌和晶体结构及能谱分析用扫描电子显微镜( FE-SEM; SU70,Hita chi,Japan) 和 X-ray 衍射( XRD; D/max2600,Rigaku,Japan) 来表征.样品的热重分析,采用(TG/DTA, Diamond 6300, PerkinElmer, USA)处理,在氮气环境下进行,升温速率是10℃/min.
1.3 光催化测试
光催化产氢测试是在耐热的石英容器中进行的,容器顶部的石英窗口能让光照垂直照明,外部有用于冷却的循环水系统.将样品(100 mg)悬浮在含有1wt%铂助催化剂的(100 mL,10vol%)甲醇水溶液中.反应前,将上述反应器中的容器抽气20 min,接着再通20 min的氮气来除去溶液中的氧气.光源由300W氙灯(CEL-HXUV300, Beijing CEL technology Co. Ltd.)辐照提供.所有的测试都是在室温下进行的.氢气含量的检测是采用以氮气为载体的离线气相色谱仪(GC-2014C, Shimadzu C0rporation of Japan).光催化产氧测试是将100 mg样品悬浮在含有0.01 mol/L的硝酸银水溶液中,与上述反应在同一容器同一条件下进行.
2 结果和讨论
利用扫描电镜分析了制备样品表面的微观结构特征.图1(a)显示了在室温下合成的紫色粉ZIF-67的微观形貌,其由大小均一且边长为250 nm左右的菱形十二面体结构组成.从ZIF-67的形貌上可以看出,样品的菱形十二面体结构比较完整,说明样品的结晶性比较好.这一点从接下来的X射线衍射(XRD)测试中也可以看出.经过高温处理后的形貌如图1(b)所示,C-ZIF-67基本保持了初始的纳米粒子的尺寸和多面体的形状,但由于较多的微小碳纳米管的生长,含氧基团和挥发性金属的缺失,导致其表面变得粗糙.与此同时,可以观察到碳纳米管的表面存在很多Co金属纳米颗粒[23].说明已经成功的合成了由钴、氮和碳纳米管组成的坚固的空心结构.从图1(d)可以看到g-C3N4的类似于平面堆积的结构.当观察图1(c)中的C-ZIF-67@g-C3N4时,可以清楚地观察到C-ZIF-67包裹在g-C3N4中,形成了紧密牢固的接触界面,验证了C-ZIF-67@g-C3N4中异质结的存在.对比图1(c)和图1(d)之后可以推断出,因为C-ZIF-67空心结构的加入增大了C-ZIF-67@g-C3N4的比表面积,进而增加了样品的采光性能.
通过X射线衍射(XRD)测定了制备样品的晶体结构和相组成.如图2所示,可以观察到合成的前驱体的峰形和峰位置与报道中ZIF-67的标准XRD基本吻合,与扫描电镜的表征相一致,说明已经成功合成了纯相的ZIF-67.经过热处理后C-ZIF-67的XRD峰形发生了明显变化,如图2(b)所示.其中,谱图上峰值为44.2°、51.6°、76.0°这三个较强的峰归因于面心立方结构的单质钴[24].此外,26.2°的峰对应于石墨碳(002)位面的夹层峰.g-C3N4的XRD图谱在13.2°和27.6°处表现出两个特征的衍射峰,分别对应于平面结构相(100)峰和芳香烃模型夹层堆积(002)峰.而在复合材料C-ZIF-67@g-C3N4的图谱中既可以观察到属于g-C3N4的两个衍射峰,也同时在44.2°的位置上找到钴的.再一次证明已成功合成复合材料,但由于C-ZIF-67含量较少,钴的峰值有所下降.

图1 四种材料的扫描电镜图像(a)~(d)分别表示ZIF-67, C-ZIF-67, C-ZIF-67@g-C3N4和g-C3N4
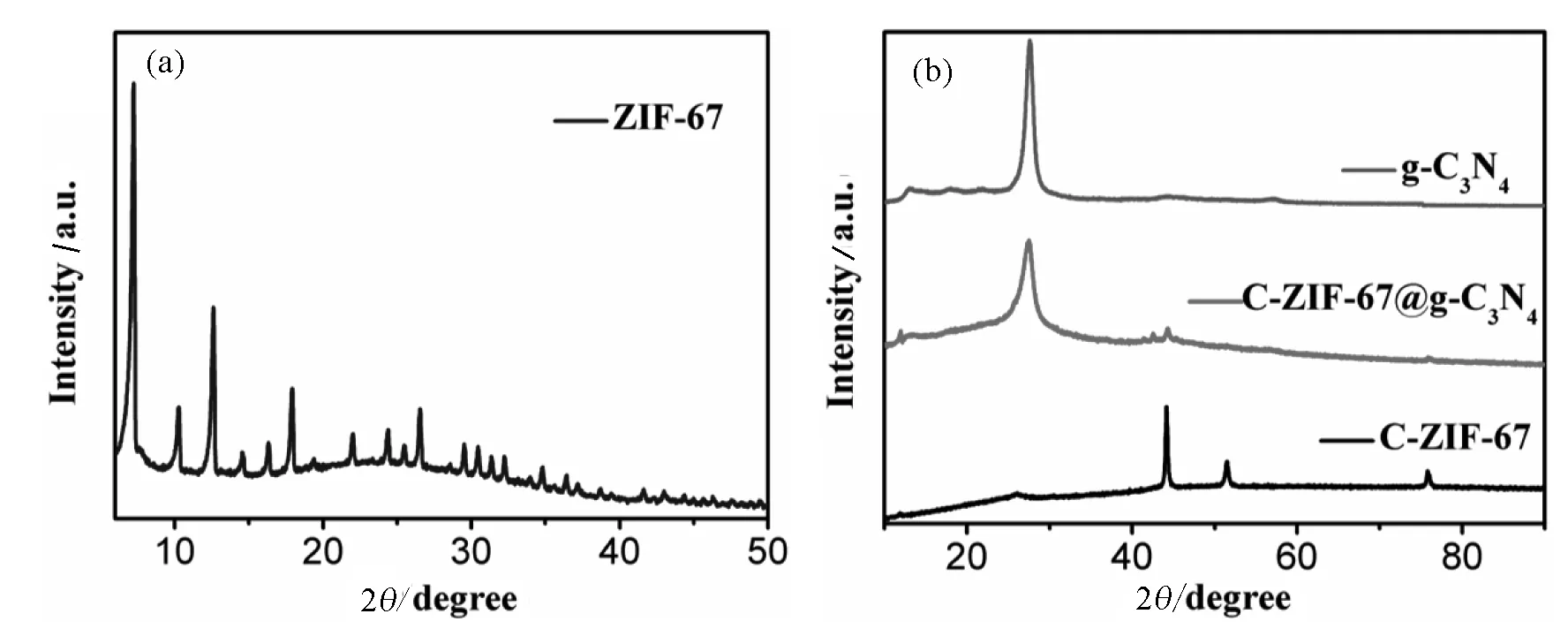
图2 制备样品的XRD图像(a)ZIF-67样品;(b)C-ZIF-67, C-ZIF-67@g-C3N4和g-C3N4三种样品
为了确定最终制备样品中沉积的C-ZIF-67的实际负载,将制备样品在氮气环境中进行了热重(TG)分析,如图3所示.对于C-ZIF-67来说,从30~780 ℃的范围内,其失重率比较低,只有12.8%,这可能是由于表面吸收水分的损失和少量的C-ZIF-67升华造成的.而C-ZIF-67@g-C3N4和g-C3N4这两个样品都显示了相似的减重区域.在500℃以下表现出良好的热稳定性,然而从500℃左右g-C3N4的重量开始有所下降,到780℃已经几乎降为0.这可能与g-C3N4的完全升华和分解有关.因此从C-ZIF-67@g-C3N4样品的减重区域可以估算出制备样品中C-ZIF-67的实际含量为10.88%.
三种样品的能谱分析(EDX)见表4,表明制备样品中C-ZIF-67@g-C3N4所用样品中都只有C、N、Co三种元素存在,再一次证明了成功制备了由Co、N掺杂碳纳米管组成的半导体催化剂.
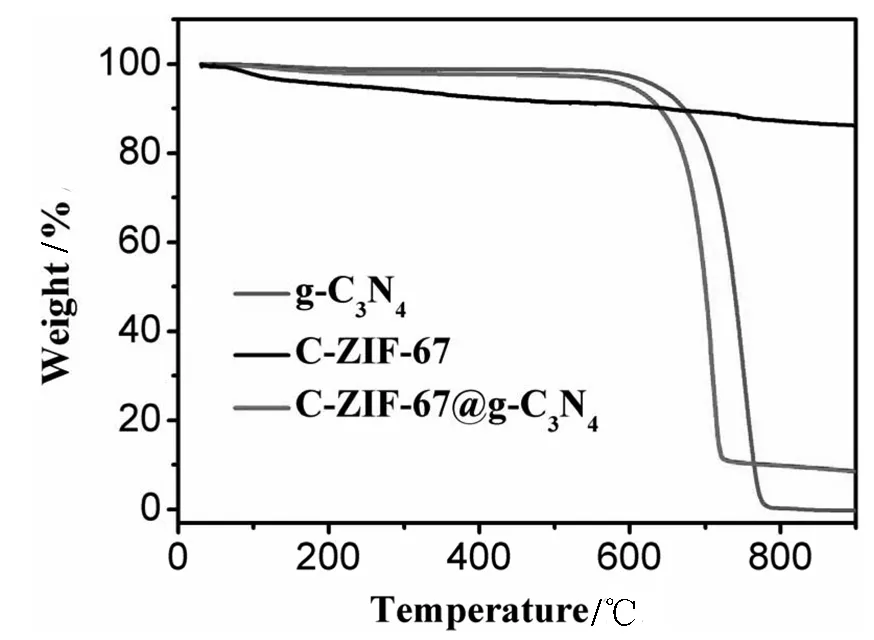
图3 C-ZIF-67, C-ZIF-67@g-C3N4和g-C3N4三种材料的热重分析
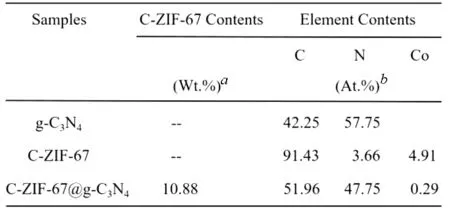
(其中,a的数值表示热重法测定最终制备样品中C-ZIF-67的含量,b的数值由能谱分析EDX确定)
如图4(b)所示,光催化产氢是一个典型的电子传输反应.在相同条件下,C-ZIF-67@g-C3N4的光催化析氢性能略高于g-C3N4,验证了C-ZIF-67@g-C3N4中的异质结构有利于光催化中的电荷分离和转移,并且在复合材料中加入由碳纳米管组成具有坚固的空心结构的C-ZIF-67,使复合样品具有较高的比表面积,增加了样品在溶液中的接触面积和采光性能,进而增强了样品的光催化能力.更加令人惊喜的是,C-ZIF-67@g-C3N4还有光催化产氧的性能,这可能是由于钴金属元素的加入使氧空穴的浓度减小,这样就有较少的空穴与光生载流子复合,从而提高光催化产氧效率.随着时间的进行,C-ZIF-67@g-C3N4的产氧速率明显降低,这可能与电子捕获剂硝酸银溶液浓度的降低和被还原的金属银沉积在催化剂的表面有关[23].
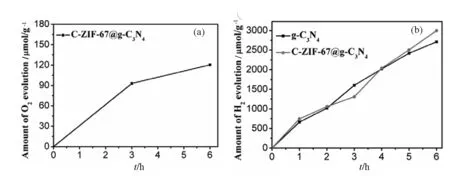
图4 全光谱下不同催化剂的产氧和产氢的速率对比图
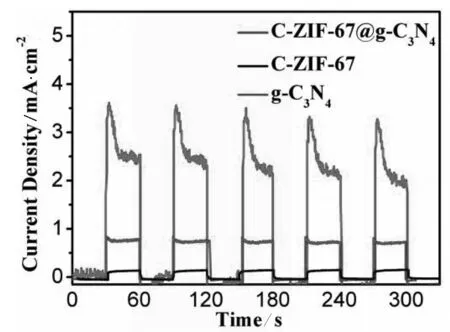
图6 三种样品在同一环境下的光电流响应测试
凭借光电流测试可以判断材料的光生电荷分离速率.图5为C-ZIF-67、g-C3N4和C-ZIF-67@g-C3N4三种样品在同一光照下进行的光电流强度测试的结果.从图5中可以看出C-ZIF-67的光响应强度较小,可以忽略不计,而C-ZIF-67@g-C3N4的光电流强度相对于g-C3N4有明显提高,这与光催化析氢的结果相一致.这是催化剂与电解液间较快的电荷传输速率[25]和较低的光生电子与空穴的复合速率的共同作用的结果[26].
3 结论
该文通过冻干法和高温煅烧两步合成C-ZIF-67@g-C3N4光催化剂.采用x射线衍射测试、能谱分析和热重分析确定了催化剂的组成成分.通过扫描电镜确定了复合体系的形貌,并进一步探究了C-ZIF-67@g-C3N4复合材料的光催化性质.实验证明,复合材料中钴金属元素的掺入有效提高了光生载流子的产生,C-ZIF-67和g-C3N4之间良好的异质结能够有效促进了光生载流子的分离,从而使C-ZIF-67@g-C3N4具有较好光催化水解产氢和产氧的能力.同时该工艺操作相对简单、原料成本较低、过程绿色环保对解决能源问题具有一定的价值.
