糖尿病周围神经病变的维生素D水平及与IL-13、IL-17的相关性研究
2020-05-22曹信宇
杨 茹,曹信宇,王 茜
糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是糖尿病(diabetes mellitus,DM)患者的常见微血管并发症之一;DPN的发病率高达90%[1]。DPN患者通常会增加残疾、心血管疾病和病死率的风险[2]。DPN的患病率随DM患者年龄及病程的增加而增加。在DPN的病理发展过程中,学者们提出了多种可能病因,如高血糖所致的氧化应激、炎症和神经元缺血[3]。其中,促炎细胞因子,如白细胞介素(interleukin,IL)家族,会影响DM患者神经元和胶质细胞活性,并参与DPN的病理发展过程[4]。然而,DPN的病理发展作用机制依然尚不完全清楚,除了严格的血糖控制外,对DPN疾病缺乏有效的额外补充治疗[5]。DPN发展的危险因素识别对于更好地认识DPN的病理机制和更有效的额外补充治疗至关重要。机体中维生素D是一种多功能的促激素,在人体内有广泛的多功能作用。25-羟维生素D[25(OH)D]是血液中测量的维生素D循环形式,临床上用于替代机体维生素D水平。既往研究证实25(OH)D缺乏与胰岛素抵抗具有相关性[6]。但是一些研究指出25(OH)D缺乏可能与2型糖尿病(type 2 diabetes mellitus,T2DM)患者的DPN有关,但还没有明确定论。本研究旨在探讨T2MD患者25(OH)D及与DPN的相关性,进一步探讨25(OH)D与DPN患者白细胞介素13(interleukin-13,IL-13)、白细胞介素17(interleukin-17,IL-17)之间相关性。
1 对象与方法
1.1 对象 选取2017年1月—2018年11月在河北省秦皇岛军工医院诊疗的T2DM患者。根据1999年WHO标准和2012年美国糖尿病协会标准对T2DM患者进行诊断[7]。DPN的诊断依据包括临床症状评估、神经检查、电生理检查、定量感觉测试和自主神经功能测试。纳入标准:所有患者均为T2DM患者/年龄40~60岁,T2DM病程≥5年。排除标准:1型糖尿病(type 1 diabetes mellitus,T1DM)或特定类型糖尿病、糖尿病急性并发症、恶性肿瘤患者/代谢性骨病史、脑梗死、甲状旁腺退行性改变(包括甲状旁腺功能亢进和甲状旁腺功能减退)以及近3个月来口服维生素D补充剂患者。最终纳入82例T2DM患者(T2DM组),其中合并DPN患者53例(DPN组),不合并DPN患者29例(NDPN组)。同时纳入30名体检健康志愿者(健康对照组)。本次研究已得到医院伦理委员会批准通过,均签署知情同意书。
1.2 方法 入组患者于住院第2天上午8∶30~9∶30休息30 min后采集血样,血清在4 ℃环境下以2 000×g离心15 min,所有样品均保存于-80 ℃,待分析。24 h内收集患者一般资料[年龄、性别、体质量指数(BMI)、病程];血糖指标[空腹血糖(fasting blood glucose,FBG)、糖化血红蛋白(HbAlc)];血脂指标[总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、高密度脂蛋白(high density lipoprotein,HDL)、低密度脂蛋白(low density lipoprotein,LDL)];肾功能指标[肌酐(creatinine,Cr)];炎症细胞因子(IL-13、IL-17);神经传导检查[正中神经运动神经传导速度(median motor nerve conduction velocity,MNCV)、正中神经振幅(median nerve amplitude,MNA)、腓总神经运动神经传导速度(peroneal motor nerve conduction velocity,PMCV)、腓运动神经振幅(peroneal motor nerve amplitude,PMNA)、正中神经感觉神经传导速度(median nerve sensory nerve conduction velocity,MSCV)、正中运动神经振幅(median motor nerve amplitude,MMNA)];DPN类型(疼痛型、无痛型);神经缺陷评分(neurological deficiency score,NDS)。采用酶联免疫吸附试验来测定血清中25-(OH)D水平。本方法测定25-(OH)D水平的范围为0~120 ng/ml。DPN类型根据视觉模拟量表(VAS)分为疼痛型与无痛型。DPN组中疼痛型24例,无痛性29例。NDS评分:双侧大拇趾振动觉、针刺觉、温度觉正常定义为0分,减弱或消失定义为1分;踝反射正常定义为0分,重扣击出现踝反射定义为1分,消失定义为2分,满分10分。0~2分:无神经病变,3~5分:轻度神经病变,6~8分:中度神经病变,9~10分:重度神经病变。DPN组中轻型神经病变15例,中度神经病变10例,重度神经病变28例。
1.3 统计学处理 应用SPSS 21.0软件对数据进行统计分析。计数资料用率(%)表示,采用χ2检验,等级资料采用非参数检验。计量资料以±s表示,采用t检验进行比较。25-(OH)D水平与炎症因子相关性采用Pearson's检验,计算r值。变量之间存在线性关系,采用多因素Logistic回归校正模型分析T2DM患者发生DPN的危险因素。以P<0.05为差异具有统计学意义。
2 结果
2.1 一般资料及各项指标比较 T2DM组患者BMI、FBG、HbA1c、Cr、TC、TG、LDL、IL-13、IL-17均高于健康对照组(P<0.05);T2DM组患者25(OH)D水平低于健康对照组,差异具有统计学意义(P<0.05)(表1)。

表1 T2DM组与健康对照组一般资料及各项指标比较
2.2 DPN组与NDPN组资料比较 DPN组年龄、病程、FBG、HbAlc、IL-17均高于NDPN组(P<0.05);MNCV、MNA、PMCV、PMNA、MSCV、MMNA、25(OH)D、IL-13均低于NDPN组(P<0.05)(表2)。疼痛型DPN患者的25(OH)D水平低于无痛型[(20.12±8.38)ng/mlvs(31.23±16.85)ng/ml,t=3.119,P=0.003];NDS评分中重度患者25(OH)D水平高于轻度、高于中度患者且差异具有统计学意义[(22.52±10.65)ng/mlvs(30.52±13.58)ng/ml、(28.48±14.58)ng/ml,P<0.05]。
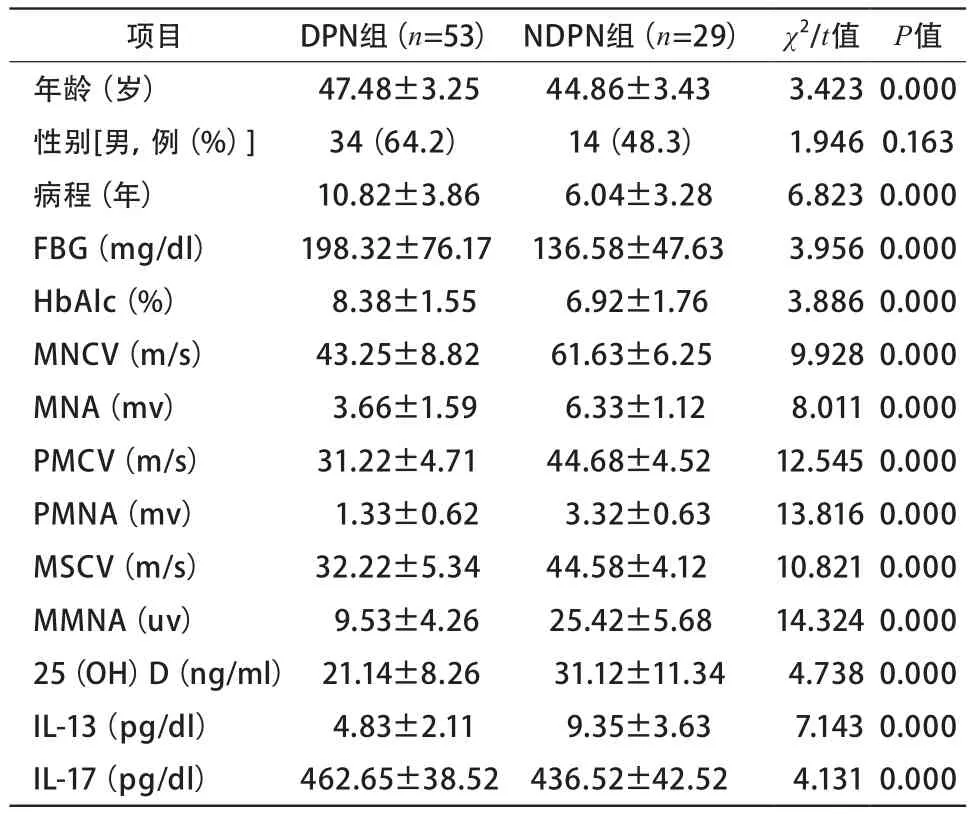
表2 DPN组与NDPN组资料比较
2.3 DPN组患者25(OH)D水平与IL-13、IL-17相关性分析 DPN组患者25(OH)D与IL-13呈现正相关性(r=0.559,P=0.000);与IL-17呈现负相关性(r=-0.363,P=0.008)。
2.4 多因素Logistic回归结果 结果显示,年龄、病程和HbAlc、IL-17是T2DM患者发生DPN的危险因素(P<0.05);25(OH)D、IL-13是T2DM患者发生DPN的保护因素(P<0.05)(表3)。

表3 T2DM患者发生DPN的多因素Logistic回归结果
3 讨论
维生素D缺乏是世界范围的难题,70%~80%的沙特阿拉伯和伊朗居民维生素D水平低于25 nmol/L;在黎巴嫩,32%的居民维生素D水平低于25 nmol/L[8-9]。在中国北京、天津、贵州、上海地区均报道了当地居民存在维生素D缺乏(25(OH)D≤20 ng/ml,范围13.9%~87.1%)[10-12]。虽然维生素D缺乏的比例波动较大,其可能原因来自于地域性差异,如日照时间、强度及经济水平。但是,中国居民维生素D缺乏的比例依然较高。一般来说,维生素D主要生理作用一直被认为是调节机体钙和磷的平衡和骨的矿化。最近研究表明维生素D缺乏会增加骨质疏松、自身免疫性疾病、癌症、心血管疾病、肥胖和T2MD等多种疾病发生风险[13-16]。而目前T2MD发生与维生素D缺乏之间的关系已被大多数学者证实[17]。本研究通过与健康对照组的比较发现T2MD患者机体内的25(OH)D水平较低。主要机制可能是25(OH)D缺乏可能通过影响β细胞功能、胰岛素分泌和循环血浆钙在T2MD的发病机制中发挥重要作用。随着关于25(OH)D在T2DM患者的进一步研究,关于25(OH)D可以增加DPN的发生风险的作用目前尚未得到一致,尽管一些循证医学证据支持上述观点,但是依然需要进一步的实验研究来证实[18-19]。本研究证实25(OH)D是T2MD患者发生DPN的保护因素,补充机体25(OH)D能够在一定程度上避免该病变的发生,且25(OH)D与神经病变的严重程度有关。另外,疼痛型DPN患者的25(OH)D水平低于无痛型DPN患者,表明,25(OH)D在疼痛型DPN发生中起着一定作用[20]。25(OH)D在DPN病理生理学中的作用机制目前尚不明了。但是一些动物研究表明25(OH)D缺乏与低水平神经生长因子(神经营养素)有关,而神经营养素在交感神经和感觉神经的发育及存活中极为重要,缺乏神经营养素可导致脑神经细胞内钙稳态紊乱。神经营养素减少和钙稳态紊乱可增加毒素对神经的损伤,维生素D受体(Vitamin D receptor,VDR)也调节神经细胞的分化和功能。因此,25(OH)D缺乏会损害伤感受器功能,加重神经损伤[21]。此外,25(OH)D缺乏是动脉粥样硬化性心血管疾病的危险因素。推测25(OH)D缺乏也可能通过与动脉粥样硬化过程相关的机制促进DPN的发生。维生素D缺乏或不足可能促进急性时相反应,导致胰岛素抵抗,增加急性期蛋白质的产生,从而促进血管的慢性炎症[22]。因此,T2MD患者的神经组织或细胞可能经历一个较长慢性炎症反应过程,会引起一系列临床症状。巨噬细胞和淋巴细胞侵入T2MD患者神经并释放IL或肿瘤坏死因子α并加快神经病变的进展[23]。通过模型校正发现IL-13、IL-17与DPN的发生具有联系,而IL-13、IL-17与25(OH)D水平具有相关性。IL-13是一种主要由激活的T淋巴细胞(Th2细胞)产生的具有多效能的免疫调节细胞因子。此外,IL-13抑制单核细胞和巨噬细胞产生促炎细胞因子和前列腺素[24]。IL-17是一种由激活的Th17产生的促炎细胞因子,在调节免疫反应中起着重要作用。维25(OH)D通过VDR介导调节神经递质,神经保护和神经免疫功能[25]。进一步证实上述推测可能成立。Hang等[26]报道了IL-13和IL-17在糖尿病视网膜病变(diabetic retinopathy,DR)微血管并发症中的作用。而DPN和DR有着相似的病理机制。另外,Hitman等[27]证实25(OH)D缺乏会影响机体免疫系统,增加感染风险。郑亚虹等[28]证实IL-17水平的上调与DPN的发生具有联系。25(OH)D对这些炎症因子影响可能有助于深入了解DPN发生机制。因此,25(OH)D缺乏可能通过下调IL-13水平,上调IL-17水平来促进DPN发生。但是这一结论需要进一步动物实验来证实。
目前为止,控制血糖并对DPN患者对症治疗是目前主要治疗方法。本研究结果表明维生素D缺乏可以下调IL-13水平,上调IL-17水平来促进DPN发生且与DPN类型及神经病变严重程度相关。因此,在日常诊疗过程中,除需要动态监测血糖外,25(OH)D水平的临床监测同等重要,如果存在维生素D不足或缺乏,则建议额外补充维生素D。
