全腹腔镜ALPPS治疗肝脏恶性肿瘤(附三例报告及文献复习)
2020-05-22陈新葛勇胜荚卫东
陈新,葛勇胜,荚卫东
(中国科学技术大学附属第一医院肝脏外科 肝胆胰外科安徽省重点实验室,安徽 合肥 230001)
全球第一例腹腔镜肝切除术(laparoscopic hepatectomy,LH)的成功施行开启了微创肝脏外科新领域[1],随着术式的改良、器械的更新、技术瓶颈的突破,LH日臻成熟。LH具有术中失血量少、疼痛轻、并发症低的优势,且有与开腹肝切除术有着类似的肿瘤学结果[2]。对于合适的病例,联合肝脏离断和门静脉结扎的二步肝切除术(associating liver partition and portal vein ligation for staged hepatectomy, ALPPS)为肝脏外科治疗提供了新的技术,通过改变肝脏血流动力学和原位分离能在短期内刺激剩余肝脏快速增生,手术分为两步进行,第一步手术结扎门静脉右支后于镰状韧带右侧原位劈离肝脏实质,1~2周后待预保留剩余肝脏体积增大至安全范围内,继续行第二步手术切除复杂的肝脏恶性肿瘤。随着腹腔镜技术的发展,全腹腔镜下ALPPS也相继在国内外多个中心开展,2019年中国科学技术大学附属第一医院肝脏外科为1例直肠癌术后肝脏多发转移和2例右肝巨块型肝癌伴门静脉右支癌栓的病人成功实施了全腹腔镜下ALPPS,现报告如下并进行文献复习,以评估ALPPS治疗肝脏恶性肿瘤的可行性、安全性及有效性。
资料与方法
一、临床资料
病例1,女性,56岁。因“直肠癌姑息性术后伴肝脏多发转移1年余”于2019年3月14日入院。既往乙型肝炎“小三阳”,口服拉米夫定抗病毒治疗。2017年11月21日于外院行“直肠癌姑息性切除术”,术中见直肠约5 cm×6 cm菜花样肿物,肝脏可见多发癌性转移结节。术后病理:直肠中分化腺癌。2017年12月至2019年1月期间共行8次化疗和4次介入治疗。体格检查:身高158 cm,体重67 kg,腹部无明显阳性体征。实验室检查:HBsAg、HBeAb、HBcAb均(+),甲胎蛋白(AFP) 2.56 μg/L、癌胚抗原(CEA) 33.47 μg/L,血红蛋白(Hb)133 g/L,血小板计数(PLT) 64×109/L,生化及凝血功能正常,Child-Pugh A级。术前上腹部CT平扫+增强示左内叶及右肝多发转移癌(图1A),胆囊结石。普美显MRI提示:结肠癌术后多发肝转移,较大者3.3 cm×2.7 cm(图1B)。诊断:直肠癌术后肝脏多发转移,胆囊结石。
病例2,男性,54岁。因“右上腹疼痛不适1周”于2019年5月15日入院。既往乙型肝炎“小三阳”,未规律治疗。体格检查:身高177 cm,体重70 kg,右上腹压痛阳性。实验室检查:HBsAg、HBeAb、HBcAb均(+),AFP 18.68 μg/L、CEA 0.79 μg/L,丙氨酸转氨酶(ALT) 93 U/L,天冬氨酸转氨酶(AST) 114 U/L,总胆红素(TBIL) 8.7 μmol/L,直接胆红素(DBIL) 3.7 μmol/L,血清白蛋白(ALB) 42.5 g/L,血常规及凝血功能正常,Child-Pugh A级。腹部增强CT及普美显MRI均提示肝脏左内叶及右肝巨大占位伴门静脉右支癌栓(图1C、D),大小约15.5 cm×10.0 cm。诊断:巨块型肝癌伴门静脉右支癌栓。
病例3,女性,49岁。因“上腹部不适半年余,加重1周”于2019年10月10日入院。既往乙型肝炎感染史,未治疗。2019年1月因甲状腺良性病变行手术治疗。体格检查:身高150 cm,体重48 kg,右上腹可触及肿块伴有压痛。实验室检查:HBcAb(+),AFP >1 210 μg/L,CEA、CA199正常。ALT 36 U/L,AST 106 U/L,TBIL 15.8 μmol/L,DBIL 5.5 μmol/L,ALB 48.5 g/L,血常规及凝血功能均正常,Child-Pugh A级。腹部增强CT+MRI均显示肝右前叶巨大占位伴门静脉右支癌栓(图1E,F),大小约11.0 cm×10.6 cm,胆囊炎。诊断:巨块型肝癌伴门静脉右支癌栓,甲状腺术后,胆囊炎。
为保证肝癌根治性效果,需行肿瘤R0切除,同时必须保证足够的剩余肝体积,防止术后出现小肝综合征甚至肝衰竭。无基础疾病的正常肝脏,在行肝切除术后的剩余肝体积至少需达到25%,有慢性肝病无肝硬化需达到30%,合并肝硬化无门脉高压需达到40%才能避免术后肝衰竭的发生[3]。病例1系直肠癌肝转移,肝脏无硬化,病例2和3系巨块型肝癌伴门静脉右支癌栓,伴有肝硬化。术前计算标准肝脏体积(standard liver volume, SLV)分别为1 192 ml、1 318 ml和996 ml [Urata's公式:标准肝脏体积(ml)=706.2×BSA(m2)+2.4,其中BSA(m2)=体质量(kg)0.425×身高(cm)0.725×0.007 184],通过混合现实手术规划模拟系统(昆华,微乐)根据薄层CT为3个病例模拟解剖性右三叶肝切除术(图2),测量剩余肝脏体积(RLV)分别为221 ml、320 ml和332 ml,占标准肝体积比仅18.54%、24.28%和33.33%。为避免引起术后肝衰竭,必须保证有足够的剩余肝脏体积,上述3例病例行一期R0切除剩余肝脏体积不足,经治疗组充分术前准备及讨论后一致决定行全腹腔镜ALPPS。
二、方法
1.ALPPS第一步手术 3例病人分别于2019年4月23日、5月29日、10月21日在全麻下行全腹腔镜下门静脉结扎及肝实质离断+胆囊切除术。病人取平卧位,脐上置入气腹针建立气腹,于右侧肋缘下与锁骨中线交点处建立主操作孔,并于右腋前线、胸骨下及中腹部取3个副操作孔,探查:病例1肝脏无硬化改变,腹腔镜超声示右肝及左内叶可见多个肿瘤,左肝外叶未见占位;病例2右肝见多发肿物,肝中叶见一巨大肿瘤,大小约15 cm×11 cm,探查其他脏器未见转移;病例3右肝见一巨大肿瘤,主要位于右前叶,大小约11 cm×10 cm,探查左肝外叶及其他脏器未见病灶和转移。遵循“no-touch”原则,不游离肝脏,先解剖胆囊动脉和胆囊管,切除胆囊。超声刀离断肝圆韧带和镰状韧带之后,预置第一肝门阻断带,解剖第一肝门、在Glisson鞘内依次解剖出肝左动脉和肝右动脉,游离肝右动脉后丝线标记(图3A)。解剖分离门静脉右支,采用丝线结扎后再用Hem-o-lok夹闭(图3B)。采用肝圆韧带入路,依次解剖分离门静脉左内叶数支分支,Hem-o-lok夹闭后离断。显露并保留肝中动脉。控制术中CVP<5 cmH2O,沿镰状韧带右侧,超声刀及双极电凝的配合下逐步离断肝实质(图3C),遇到较大的脉管以Hem-o-lok夹闭后离断,至肝后下腔静脉前方。氩气刀喷凝处理肝脏断面,妥善止血、检查无胆漏后断面放置止血纱布,肝脏创面及右膈下各放置引流管一根。术毕安返病房,监测生命体征,动态复查血常规、肝功能及凝血象。
2.ALPPS第二步手术 第一步术后定期复查CT并评估RLV,复查CT见预留肝脏较前增生明显(图4A、C、E),二期术前多次评估剩余肝脏体积。接下来分别于2019年5月22(首次术后1个月)、6月13日(首次术后2周)和11月6日(首次术后2周)行全腹腔镜下解剖性右三叶肝切除术。沿原腔镜孔进腹,超声刀钝性分离腹壁与肝脏间轻度粘连,可见预留的肝脏体积较前增大明显(图3D),寻找首次手术标记的肝右动脉和肝中动脉,予以夹闭、离断。游离部分右侧肝周韧带,解剖显露肝下下腔静脉、离断若干支肝短静脉。直线切割闭合器离断右侧肝蒂,沿原左肝内叶分离处离断肝组织(图3E),直线切割闭合器依次离断肝中静脉和肝右静脉,继续离断右侧肝周韧带,移除标本(图3F)。止血满意,放置双套管。术后监测生命体征及血液学指标。
结 果
一、第一步手术及术后情况
第一步平均手术用时和出血量为270 min及133 ml,均未输血及行肝门阻断。术后平均最高体温37.8 ℃,心率、血压正常范围内,视觉模拟量表(VAS)疼痛评分为2~4分。贯彻术后加速康复理念,术后第1天即下床,开始进食。术后血常规、肝功能、凝血象及腹腔引流液变化见表1~3。术后予以抗感染、保肝、补充白蛋白等对症支持治疗。白细胞、中性粒细胞百分比、转氨酶及胆红素术后第1天达峰值后逐渐降低至正常水平。术后腹腔引流液最高为每天300 ml、300 ml及100 ml,按照围手术期并发症Clavien-Dindo分级标准[4],并发症等级为Ⅰ~Ⅱ级。病例1术后复查B超及CT结果未见明显异常,于4月30日出院,嘱门诊复查CT评估剩余肝脏体积择期住院行二期手术,病例2和病例3术后1周、2周复查CT评估剩余肝脏体积,围术期剩余肝脏体积变化见图5。
二、第二步手术结果
第二步平均手术用时和出血量为355 min及700 ml,平均输血2.3 U。病例1肝门阻断25 min,病例2及病例3未行阻断。术后体温分别波动于36.1~38.4 ℃、36.4~37.3 ℃及36.2~38.2 ℃。术后次日下床、进食。术后血常规、肝功能、凝血象及腹腔引流液变化见表1~3,术后感染控制良好,病例2 WBC第2天达15.13×109/L后逐渐恢复。ALT、AST、TBIL、DBIL在第2天一过性上升后持续下降。每日腹腔引流量为350~600 ml、280~1 050 ml及150~450 ml,引流液颜色正常、引流量逐天减少,后于术后1周左右拔管。
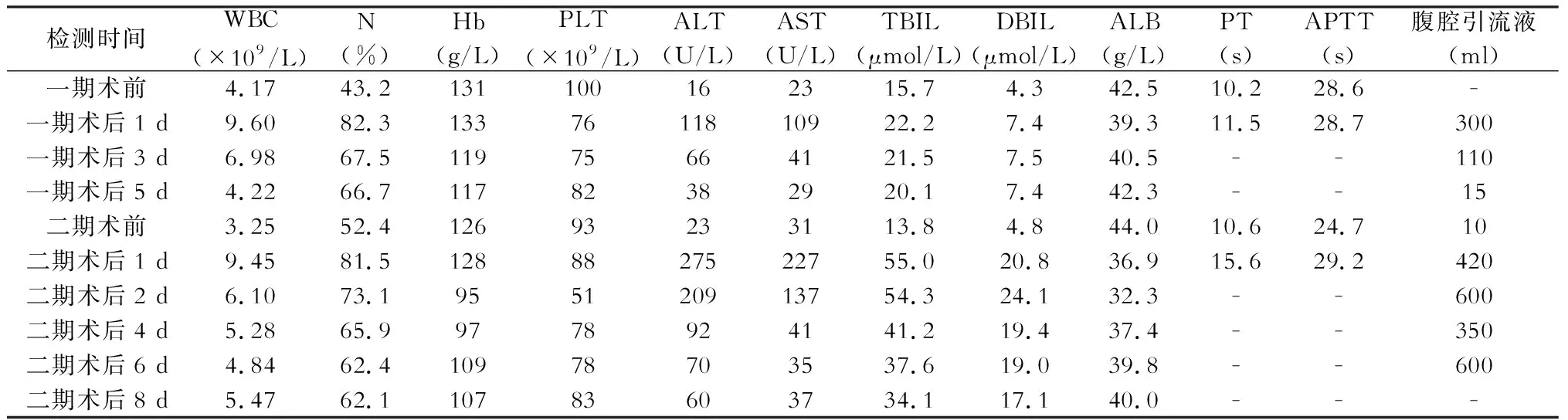
表1 病例1围手术期监测指标

表2 病例2围手术期监测指标
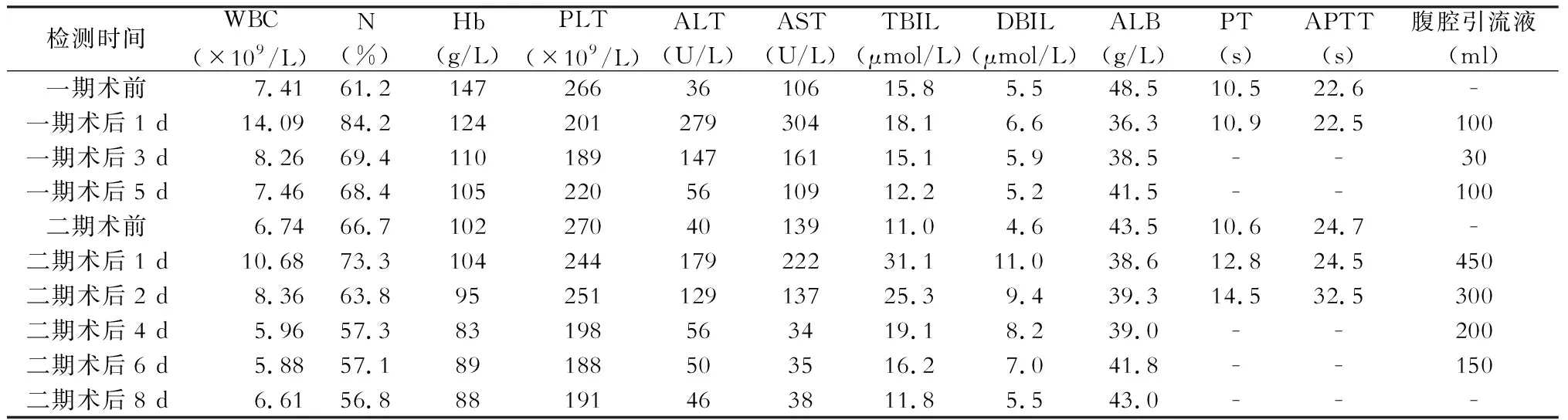
表3 病例3围手术期监测指标
注:正常参考值,白细胞计数(WBC)为(3.50~9.50)×109/L;中性粒细胞百分比(N) 40%~75%;血红蛋白(Hb) 130~175 g/L;血小板计数(PLT)(125~350)×109/L;丙氨酸转氨酶(ALT) 9~50 U/L;天冬氨酸转氨酶(AST) 15~45 U/L;总胆红素(TBIL) 3.4~21 μmol/L;直接胆红素(DBIL) 0~5.0 μmol/L;血清白蛋白(ALB) 40~55 g/L;凝血酶原时间(PT) 8.0~14.0 s;活化部分凝血活酶时间(APTT) 20.0~40.0 s
三、病理报告
病例1:中-低分化腺癌,可见结节8枚,直径0.5~5 cm;病例2:低-中分化肝细胞肝癌,大小14 cm×10 cm×7 cm;病例3:中分化肝细胞肝癌,大小10 cm×10 cm×9 cm。
四、术后随访
病例1术后10 d出现间断性发热,体温最高38.4 ℃,转感染科进一步治疗,6月14日因胸腔积液行穿刺置管,一般情况良好,术后2个月复查CT(图4B)未见复发与转移。病例2术后血氨波动于97.2~122 μmol/L,门冬氨酸鸟氨酸、乙酰谷酰胺联合乳果糖治疗后降至正常,并于6月25日出院,门诊随访1月余未见复发(图4D)。病例3术后出现血红蛋白降低,最低83 g/L,术后次日输注RBC 2 U,术后1周间断输注冰冻血浆共1 700 ml,复查凝血功能满意于11月13日出院,随访至今无明显异常(图4F)。二步术后均无明显出血、胆漏及感染发生,术后恢复满意。
讨 论
肝切除术仍然是肝癌根治性治疗的首选方式[5],腹腔镜因其微创优势受到肝脏外科医生的重视。腹腔镜肝切除由最初的左侧肝段切除和肝脏病灶的局部切除发展至解剖性左、右半肝切除,目前腹腔镜肝切除可实现亚肝段切除,甚至是尾状叶切除以及ALPPS[6]。中国的腹腔镜肝切除术水平飞速发展,全国各大中心相继开展各种全腹腔镜下复杂肝脏恶性肿瘤的手术治疗。肝切除的安全性主要取决于剩余肝脏体积的大小[7],实现累及多个肝叶的肝转移癌与巨块型肝癌的根治性切除面临着同样的挑战,因需要切除肝脏及肿瘤的体积大、残肝体积小,术后出现小肝综合征及肝衰竭的风险极大。三维可视化技术在复杂肝脏肿瘤的应用发展可以精确地将肝脏占位、脉管系统的形态及其相互间的毗邻关系清晰、直观地显示,通过软件分析计算能够获得预切除后剩余肝脏体积[8],这能够指导我们是行一次性根治性肝切除还是选择分期肝切除术。ALPPS是不可一期切除的复杂肝脏肿瘤的治疗新策略,ALPPS分两步走,第一步结扎患侧门静脉分支加原位离断部分肝实质,增加健侧门静脉血流的同时切断了患侧与健侧肝脏之间的交通支,促使肝脏门静脉血流重新分布,主要供应健侧肝脏,离断肝实质也一定程度上刺激了肝脏的再生。第二步将患侧肝脏的肝动脉、肝静脉血供切断,并移除患侧肝脏。两次手术的过渡期患侧肝脏仍然可以发挥部分代谢、合成及解毒的功能,维持了肝脏的正常生理功能[9],从而避免术后肝衰竭的发生,提高了手术的安全性。
2012年Machado等[10]首次报道了腹腔镜下ALPPS治疗结直肠癌肝转移的病例,提出腹腔镜的微创优势既降低了二期手术难度,又提高了手术安全性;同时建议弃用生物活性胶袋包裹残肝,以免增加异物感染的发生。郑树国等[11]在全腹腔镜下治疗肝硬化肝癌的结果表明肝硬化肝癌病人可适当延长两期手术的间隔时间,剩余肝脏体积同样可增生至安全标准,同样在结直肠癌肝转移中应用ALPPS也是安全的、可行的[12]。合并肝硬化者和/或门静脉癌栓行ALPPS依然需慎重,其可能无法完成第二步手术及出现严重并发症。针对合并门静脉癌栓的病人,累及门静脉主干以下的可尝试ALPPS,侵犯门静脉主干及肠系膜上静脉不宜行ALPPS[13-14]。多名研究者在传统ALPPS术的基础上进行方法的改良及技术的创新,Cai等[15]开创性地行腹腔镜下绕肝止血带取代肝实质离断,结果在短期内肝脏增大明显,避免了一期术后的胆漏、出血及腹腔感染的发生。有学者报道了同期ALPPS联合结肠癌根治术治疗结肠癌伴肝转移效果满意[16]。Pekolj等[17]在ALPPS一期手术尽量减少肝实质离断,并经皮经肠系膜下静脉穿刺栓塞门静脉右支,有效地避免了肝脏多余的损伤。Jiao团队[18]和Donati团队[19]在一期手术中分别使用射频与微波消融代替肝实质离断,传统ALPPS与消融技术的结合,丰富了ALPPS的术式,值得同道们研究探讨。
笔者所在中心2019年至今已完成3例全腹腔镜下ALPPS,1例系直肠癌肝脏多发转移,另2例系巨块型肝癌,术前应用三维可视化技术对剩余肝脏体积充分评估,3例在过渡期剩余肝脏体积分别增加了143 ml、212 ml和90 ml,剩余肝脏体积比达标。腹腔镜放大了手术视野,肝内脉管解剖结构更清晰,降低了术中及术后出血和胆漏的风险。第二步手术见腹腔粘连轻、少量腹腔积液,大大简化了再次手术的难度。总体来说,腹腔镜ALPPS具有术中出血量少、疼痛轻、并发症发生率低的微创优势[2]。贯彻加速术后康复(enhanced recovery after surgery, ERAS)理念,术后次日即下床、进食,术后疼痛评分2~4分。病例1两期手术间隔时间长,究其原因考虑与原发病直肠癌及其治疗史密切相关,入院前共8次化疗和4次介入治疗,多次药物及手术的打击打破了肝脏的生理平衡、限制了肝脏再生的能力,因其无明显肝硬化,在一期术后1个月评估剩余肝脏体积达30%时果断行右三叶切除术,术后出现了间断性发热、胸腔积液等并发症。适当延长间隔时间、加强术后营养支持及优化围术期管理是本例成功施行二期手术的关键。病例2在术前精细的三维可视化指导下手术进程顺利,术后因肝脏硬化和切除肝脏体积较大出现肝功能受损、血氨升高,降氨等对症治疗后肝功能恢复,顺利出院。病例3术后早期进食出现了轻度呕吐,对症治疗后好转,另外积极输注RBC和血浆有助于改善凝血功能及促进术后恢复。
总之,腹腔镜下ALPPS的治疗选择应以病人的安全为前提,参考已报道的文献严格把握适应证,术前规范化的三维可视化以了解肝脏肿瘤的位置毗邻、脉管的变异与否以及精密计算剩余肝脏体积,术中精细操作,一期手术减少对肿瘤的压迫,血管解剖后应以丝线标记,离断肝脏时超声刀和双极电凝默契配合,肝脏断面填塞止血纱布,预防出血和胆漏。术后医护团队的管理是围手术期重要的一环,倡导ERAS理念[20],鼓励病人早期下床、进食,积极镇痛、止吐,预防感染等其他并发症发生。本研究证实全腹ALPPS是晚期肝脏恶性肿瘤的一种治疗选择。目前文献报道比较单一,缺少大样本、多中心的研究,手术流程有待进一步规范化,以便普及。
