长期大强度耐力运动引起右心室重塑的特征、机制及影响研究进展
2020-05-21饶志坚郑莉芳常芸于涛史仍飞
饶志坚 郑莉芳 常芸 于涛 史仍飞
1 上海师范大学体育学院(上海200234)
2 上海体育学院运动科学学院(上海200438)
3 国家体育总局体育科学研究所(北京100061)
1 前言
规律性耐力运动有利于保护心血管系统,降低心血管疾病的发病率,同时也是大多数心脏疾病的一级和二级预防手段。然而,能将运动的效果最大化的最佳运动强度仍然未知。短期内(2~4 个月)每周大强度运动4 小时或以上能导致心脏结构、功能和电传导的变化,这些变化统称为运动员心脏[1]。这些变化是应对运动时心脏超载发生的一系列适应性重塑,大多数情况下运动员心脏是可逆的良性重塑。然而,研究发现长期大强度耐力运动可能会导致不良的心脏重塑,如心肌纤维化[2]、心功能下降[3]和心律失常[4]等。进一步的研究发现,这些不良的心脏重塑可能并不是全心性的,而是有部位特异性:相比于其他部位,右心室更容易受到影响[5,6]。一项纵向研究以20 名划船运动员为研究对象,采用心脏超声的手段发现,经过90 天的训练之后,运动员心脏环向应力下降,尤其是右心室和室间隔[7]。一项meta 分析也发现长时间大强度耐力运动后右心室扩张且其收缩和舒张功能下降,而左心室功能却不受影响[8]。这些结果表明右心室可能是心肌的易受损区域。虽然有报道更大强度的耐力运动后在右心室受损的同时左心室射血分数也会下降,但一般而言,左心室能很好地适应大强度耐力运动,发生增大、增厚的重塑以保障运动时心输出量的需求,该作者认为大强度耐力运动后出现左心室功能障碍并不是因为左心室损伤,而是可能由受损的右心室通过室间相互依赖作用影响到左心室的功能[9]。可见,右心室可能是大强度耐力运动员运动表现的重要限制因素。因此,越来越多的心脏学家更加关注大强度运动对右心室的影响,并取得了一些进展。本文通过中国知网和Pubmed,以“运动”、“大强度运动”、“心室”和“右心室”为关键词检索文献,围绕大强度耐力运动对右心室的影响展开阐述,为今后进行大强度耐力运动与心脏重塑的研究提供参考。
2 大强度耐力运动对右心室结构重塑的影响
耐力运动会导致心脏发生适应性变化,采用听诊和叩诊的方法对划船运动员进行体检,发现他们的心脏内径比对照人群大[10]。随后很多研究采用心电图[11]和胸腔X 线成像[12]检测运动引起的心脏结构变化,之后,超声心动图技术能进一步检测出运动性心脏重塑的程度和比例特征[13]。最初的研究主要集中于探究耐力训练对左心室重塑的影响,然而近些年研究人员也意识到右心室也会对耐力训练产生结构上和功能上的重塑。而且随着新的诊断技术逐渐被用于运动员心脏的研究,如多普勒心肌成像(doppler myocardial imaging,DMI)、二维斑点追踪成像(two-dimensional speckle tracking imaging,2D-STI)、三维(3D)实时超声心动图和心脏磁共振(cardiac magnetic resonance,CMR),研究人员能更早、更准确地检测到心室结构变化和功能障碍。下文将重点描述长期大强度运动后右心室结构的变化。
2.1 人体实验研究
尽管标准多普勒心脏超声图广泛用于区分运动员心脏和病理性左心室肥厚,但只有较少的研究报道右心室对大强度耐力运动的适应性变化。而且非侵入手段难以检测右心室的厚度,因此很少有研究报道运动后右心室厚度是否增加,目前的文献表明在没有肺动脉高压的情况下,运动后出现右心室肥厚是不正常的。因此,大部分研究报道的都是大强度耐力运动后右心室内径的变化。
标准心脏超声图很清晰地显示了右心室是如何参与到运动员心脏的扩张,包括内径和自由壁厚度的增加,很多研究发现,与对照人群相比,运动员具有更大的右心室流入道和流出道,但两组右心室收缩功能并没有显著性差异[14-16]。另外,Baggish等[17]采用多普勒超声检测40名划船运动员右心室的结构和功能参数,其中20名为优秀奥运选手水平,另外20名为大学校队水平。他们的结果显示,与校队水平的运动员相比,奥运水平的运动员具有更大的右心室舒张末期内径,且其右心室收缩功能和舒张末期舒张功能显著增强。Oxborough 等[18]以102 名运动员为研究对象,发现57%的运动员右心室流入道大于正常值;40%的运动员右心室流出道大于正常值;69%的运动员右心室长度超过正常值;还有59%的运动员收缩面积大于正常值。其中28%的运动员右心室流出道的值甚至大于致心律失常性右心室心肌病的诊断标准。奥运水平的运动员大强度运动后尽管左右心室都会扩张,但是右心室比左心室扩张的程度更大[19]。另一项研究也证实在长时间大强度运动过程中,右心室逐渐扩张到大于左心室,以充分地容纳静脉回流[15]和适应收缩期三尖瓣血流模式的改变[14]。
运动类型是运动性心肌重塑的重要决定因素之一。在力量训练时,其主要特征是血压增加,而心输出量变化不大,腔室会出现轻微的扩张。相比之下,耐力运动过程中心脏容量超载,这一特征决定了心脏重塑的方向且可能是导致左右心室不同重塑的主要因素。考虑到运动类型对心脏重塑的影响,有研究报道由于运动时血流量增加,耐力运动员左右心室的舒张期内径变大;而力量训练的运动员通常具有正常大小的腔室,但是他们的左心室壁更厚[20,21]。D’Andrea等[22]采用心脏超声检测顶尖竞技运动员(耐力运动员32 名,力量运动员26名)右心室的结构以研究不同类型大强度运动对右心室临床参数的影响,结果显示耐力运动员右心室的所有参数数据都显著性大于力量运动员以及对照人群。他们还发现耐力运动员右心室横径显著增加,且其球形指数较高。舒张早期右心室功能增强,这可能与右心室扩张有关,而右心室收缩功能的指标正常。
考虑到性别对长期大强度耐力运动后右心室重塑的影响,Sanz-de la等[23]对比了40名运动员(其中20名女性运动员)和40名对照人群(其中20名女性)右心室的结构,发现长期大强度运动后男女运动员两心室发生相似的重塑,相较于女性,男性具有更大的右心室且其两心室的变形较小。D’Ascenzi 等[24]以1009 名奥运水平的运动员为研究对象,也证实了右心室重塑主要发生在男性运动员和耐力性运动员,表明性别对运动性心脏重塑有影响,提示在今后对运动员心脏的研究过程中应该考虑性别因素。
2.2 动物实验研究
如上所述,在人体研究中几乎所有的研究都发现长期大强度耐力运动会导致右心室扩张,相同的结果在动物实验研究中得到验证。
Benito等[25]研究8周或16周大强度运动对SD大鼠心脏重塑的影响时发现,无论经过8 周还是16 周的大强度训练,大鼠右心室内径与安静组比并没有显著性差异;而16周大强度运动后左心室内径显著增加。而Maria 等[26]发现Wistar 大鼠经过16 周大强度运动后右心室内径显著大于中强度组和安静组,且中强度组也显著大于安静组;而大强度运动组的左心室内径与中强度运动组没有差异,同时两种强度的运动都可以使左心室扩张。我们的前期研究结果[27]与Maria 等的结果相似,大鼠长期大强度运动后左右心室内径都显著大于对照组;不同的是,我们并未观察到大强度运动组的右心室内径大于中强度组,相反地,我们发现大强度运动组左心室内径显著大于中强度组。Maria 等认为大强度运动对右心室造成的负荷比中强度更大,而两种强度对左心室造成的负荷差别不大,因此长期大强度运动可导致右心室扩张得更严重。而我们考虑到中强度运动对右心室的刺激是适宜的,可导致右心室扩张,继续加大强度后可能会超过右心室的承受能力,因此右心室并不会继续扩张反而可能会对室壁造成一定的损伤,并出现纤维化以阻止右心室过度扩张、减轻右心室损伤。
可见,尽管动物实验也观察到大强度运动后右心室扩张,但对于扩张程度的结果还不一致,鉴于目前此类动物实验有限,而且样本量都相对较少,因此今后仍需更多大样本的研究以阐明其中关系。
3 大强度耐力运动对右心室功能重塑的影响
3.1 急性大强度运动对右心室功能重塑的影响
大强度运动后右心室可能更容易受到损伤,在评估大强度耐力运动的长期利益或潜在风险时右心室应该被重点检查,然而在运动心脏的研究中右心室通常会被忽视。目前有大量的研究报道了耐力运动对左心室的影响,但是这些结果不尽一致。一项meta 分析纳入23 项研究,最后得出结论,大强度耐力运动可导致左心室射血分数略微下降(2%),可能原因是运动后心脏负荷发生变化[28]。另一项meta 分析纳入29 篇文献,证实了长时间大强度运动之后左心室功能下降,作者认为可能机制与左右心室相互影响有关[29]。相比之下,一些研究检测了运动后右心室的功能变化,这些研究一致发现大强度运动后右心室功能发生显著性下降,与运动前相比运动后右心室面积变化分数降低了12%~32%,而三尖瓣偏移值降低了4%~22%[30-32]。这些变化可能是由长时间运动后负荷急剧增加引起的,而心脏变形的指标(如应变和应变率)受负荷变化的影响比较小。几项研究评估了运动后右心室自由壁的变形,结果表明与运动前相比,运动后右心室应变下降了15%,而右心室应变率的变化则不一致[30-33]。一些研究发现大强度运动后右心室自由壁应变率下降[32,33],而另外一些研究却没有观察到一致结果[30,31],可能是由于应变率这个指标的变化性比较大,或者说应变率可能有一定的负荷依赖性。如果右心室的这些变化只是因为脱水,自主神经变化或者其他影响负荷的因素发生变化,那么左右心室应该发生相同的变化。然而事实上并非如此,文献报道大强度运动后右心室应变率下降,而左心室应变率保持不变[33,34]。30年前Douglas[15]等采用M型超声心动图发现完成铁人三项比赛后运动员右心室扩张而左心室内径不变,研究采用2D和3D心脏超声图验证了这一结果,右心室的扩张加上心包的限制,使得室间隔偏向左心室导致左心室偏心指数增加[30,32]。有人认为舒张早期左心室被挤压可能解释了所观察到的左心室功能参数变化。
有学者提出采用心脏超声心动图评估右心室功能具有很大的局限性,然而采用CMR的检测方法验证了相似的结果,大强度运动后左心室功能不变,而右心室射血分数下降[35,36]。心功能的下降可能与心肌损伤有关,因此多项研究分析了心肌损伤标志物水平和左右心室功能的相关性,多数研究发现心脏损伤生物标志物和左心室功能变化之间没有关联[37],而有两项研究却发现右心室功能下降和肌钙蛋白及B 型钠尿肽(Type B natriuretic peptide,BNP)的释放呈中高度的负相关[31,32]。
心功能短暂性变化与大强度耐力运动有关,但是这种变化的临床意义还不明确,只有依靠后期大样本长期跟踪研究才能揭示这种变化的临床意义。
3.2 大强度耐力运动对右心室功能重塑的影响
3.2.1 大强度耐力运动对右心室整体收缩功能的影响
耐力训练可导致左心室和右心室慢性结构改变。正如上文所阐述的,在运动员心脏中最典型的发现是大多数耐力运动员右心室扩张[38,39]。对于右心室整体收缩功能而言,一些小样本研究检测右心室整体功能发现右心室收缩功能增强[22,40]。然而,大多数的研究发现,与非运动员相比,安静状态下运动员右心室整体收缩功能略微下降。这种右心室整体收缩功能下降主要发生在那些右心室扩张的运动员当中。这一发现也被一项更大样本量(300 名受试者)的CMR 研究所证实,这项研究发现耐力运动员右心室射血分数较低(男性运动员50%、男性对照52%;女性运动员53%、女性对照55%)[41]。Elliott等进行的一项meta分析纳入14篇文献共计329 名受试者,最后归纳总结出长期大强度运动会导致右心室功能降低,而左心室功能却不受影响[8]。此外,本课题组[27]前期及其他人[25,26]进行的动物实验都发现长期大强度运动后右心室射血分数出现显著性下降,然而我们仍然不知道反复大强度运动导致右心室功能障碍后,经过充分休息是否能恢复过来。
D’Andrea[42]等采用3D实时超声心动图评估430名运动员的右心室结构和功能,这种方法克服了2D成像的部分局限性,在3D空间下计算整个心脏周期中右心室容积和功能,从而消除了对右心室几何形状的假设需求。在这项研究中,与对照人群相比,耐力运动员具有更大的右心室内径以及3D 容积,而两组的2D 和3D右心室收缩指数(射血分数)相似。
因此,耐力运动员右心室功能略微下降可能是一种生理现象,因为每搏输出量不变而舒张末期容量增加导致计算的射血分数偏低。相反,必须强调的是,在任何运动员身上发现较为严重的右心室整体功能下降应该被视为不正常现象。
3.2.2 大强度耐力运动对右心室局部收缩功能的影响
多普勒组织成像能有效地检测出右心室局部收缩功能,而且被用于探究运动员和非运动员之间的差异[43,44]。80%的射血分数由右心室纵轴缩短产生,这一参数能反映所分析部位的心肌细胞的功能[45]。在耐力运动员中,多普勒和2D应变所得到的局域性参数显示耐力运动员和运动员之间存在很大的差异[39]。在右心室的入口或基底部以及自由壁中段耐力运动员的收缩变形显著低于非运动员的相同部位。La Gerche[46]等验证了在运动员身上的这种发现是因为生理性重塑还是长期大强度运动造成心肌损伤的一种信号。他们发现心脏功能降低的部位在运动时功能完全正常(表明收缩功能恢复正常),这一发现提示心脏的局部功能降低是应对右心室扩张的一种生理性适应。
3.2.3 大强度耐力运动对右心室舒张功能的影响
目前评估运动员右心室舒张功能的研究有限,且现有研究的结果也不一致。有些研究报道运动员充盈增强[22,47,48],而另一些研究发现运动员与非运动员并没有差异[49,50],无论是左心室还是右心室都报道过这些不一致的结果。
多普勒超声心动图应用于检测运动员右心室局部功能,这在很大程度上增加了我们对功能变化的理解。速度模式组织多普勒的检测已经证实了右心室早期舒张期充盈增多和等长舒张时间延长,与左心室的变化类似[22,51]。这种功能特征与运动员胰岛素样生长因子升高有关[52]。而且,右心室自由壁舒张早期速度和局部舒张的时间与左心室每搏输出量之间高度相关[51]。这些独立的关联揭示了运动员心脏两个心室之间的相互影响,通常是由耐力运动员容量超载所引起的[53,54]。事实上,左心室容量增加影响室间隔的厚度及大小,且能引起右心室室壁的变形,这一系列的变化与腔室内压力变化有关:右心室等容舒张延长使得舒张充盈更有效,结果导致更大的右心室每搏输出量。左心室也有相似的变化,然而左心室每搏输出量自身可引起右心室静脉回流增加,这可能会导致局域性右心室舒张时间延长[51]。
随着年龄的增加,左心室的功能会下降,少数研究检测右心室是否有相同的情况,但是所得到的结果不是很一致。一项大样本研究发现,与非运动员的对照组相比,运动员的右心室舒张功能并未发生显著性变化[51]。这项研究发现,除了年龄和心率外,其他的因素包括训练量并不能影响舒张功能。这表明当检测耐力运动员安静状态下舒张功能时,可参考健康非运动员的数值,如果发现运动员心脏舒张功能降低,则可能存在潜在的心脏病,应进行进一步分析。
3.3 结构重塑与功能重塑之间的联系
结构决定功能,功能又反过来影响结构。关于右心室扩张和右心室收缩或舒张功能障碍之间的联系,目前的研究结果不是很一致。一项研究发现大强度运动后,尽管运动员右心室扩张了,但是并未发现右心室收缩或舒张功能障碍[19,55,56]。另一方面,研究发现经耐力训练后右心室扩张伴随着右心室局部变形,且变形率提示收缩功能下降主要发生在基底节段[39]。对于运动员而言,左心室不太可能会发生收缩和舒张功能障碍,甚至那些左心室肥厚的运动员也不太可能发生[57]。目前仍不清楚这些不一致的结果是不是由运动员训练项目不同引起的。
4 大强度耐力运动影响右心室重塑的可能机制
大强度运动对循环系统要求很高,高水平运动员运动时骨骼肌需要更多的氧供来保证有氧代谢,因此心输出量将会上升5~8 倍,这可能是由于静脉回流增加,心肌收缩能力增强以及肺动脉和全身动脉扩张引起的。此外,心输出量决定于心率和每搏输出量,反过来又依赖于心肌重塑和腔室大小[58,59]。大强度耐力运动时需要心输出量持续几小时的增加,这种增加需求可通过增加心率、腔室大小和心肌重塑来满足;大多数情况下,需要结合这几种变化来满足增加心输出量的需求。为满足长期运动时这种高需求,耐力运动后导致左右心室都扩张,因此在运动时心脏可增加每搏输出量,代价就是室壁压力增大[58,60]。但是研究表明左右心室压力的变化不完全相同,La Gerche 等[61]发现运动时右心室压力比安静时增加了125%,而左心室只增加了14%;Stewart 等[62]也发现大强度耐力运动时左右心室及室间隔应力变化最大,再加上右心室室壁薄、本身的几何形状以及运动时剧增的腔内压力,将导致右心室工作负荷显著增加。短时间大强度运动时,健康运动员可通过增强右心室功能以满足这些工作需求。在持续时间小于30分钟的大强度运动中,右心室收缩能力的两个指标(应变率和收缩末期血压容量关系)逐渐增加。然而,这种工作需求的增加不能无限制地持续下去。如上所述,很多研究发现长时间大强度运动会引起右心室功能障碍,表明可能存在一个时间点,超过之后右心室将不能再维持运动时的生理需求。这种情况下,过大的右心室压力可能对右心室心肌细胞造成一定的损伤,长期反复地出现这种损伤则会导致右心室炎症和不良右心室心肌重塑,最终影响右心室功能和运动表现(如图1),表明右心室可能是耐力运动员运动心脏的潜在致命弱点。
研究发现大强度耐力运动后,心肌肌钙蛋白(cardiac Troponin,cTn)急性升高,尤其是采用高灵敏的ELISA 试剂盒进行检测[63-65]。心脏肌钙蛋白是心脏损伤的特异性标志物,运动过程中cTn 的释放机制仍不清楚,关于这种现象是生理性的还是病理性的这一核心问题仍处于激烈讨论中。cTn 病理性地升高主要涉及三个机制:一、冠状动脉斑块破裂与冠状动脉闭塞导致的缺血和坏死;二、在斑块没有破裂的情况下,氧供需失衡导致的缺血与坏死;三、直接源于心肌细胞的非缺血性损伤[66]。健康运动员运动过程中释放的cTn 并不适合上述任何一个分类,也不一定代表一种病理过程。当然,运动后肌钙蛋白的升高也有可能代表了凋亡导致的心肌细胞死亡。在骨骼肌中,多种行为可导致骨骼肌细胞死亡,但骨骼肌细胞具有修复和再生能力,这一修复过程加强了骨骼肌对这一强度或更大强度负荷的耐受性(超量恢复的生理学原理),因而可实现功能上和结构上的适应性变化[67]。这一概念可能同样适用于心肌细胞,从这一角度来讲,运动后检测到心脏损伤在某种程度来说是期待出现的现象。但是也有可能大强度或者频繁的运动刺激导致的恢复程度不足以补偿损伤程度。在动物模型中,前负荷和牵拉程度的增加引起肌钙蛋白释放,这一过程可能与凋亡调控的细胞死亡有关[68]。相似的机制可能可以用来解释为什么耐力比赛和大强度间歇运动后肌钙蛋白释放增多,而在力量训练后肌钙蛋白水平却不会变化。
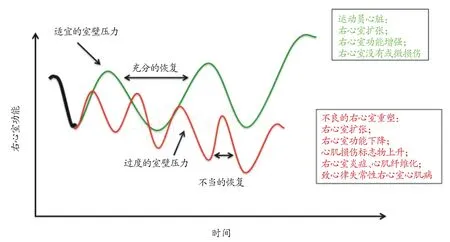
图1 长期大强度耐力运动导致右心室不良重塑的可能机制
大强度运动引起的细胞凋亡可能在心脏修复过程中发挥重要作用,类似于骨骼肌,这一过程发生在大强度运动之后,这一功能上和结构上的变化机制可能就是运动员心脏的特性。然而,一些心脏疾病的患者在运动后肌钙蛋白水平上升,其意义是不同于运动员身上发生的变化。特别是长期大强度运动引起心肌病理学变化,可能会导致炎症和异常的修复过程,最终形成有害的心肌重塑[69,70]。尽管这一假设还未被完全证实,但是耐力运动员心律失常(如房颤)的发病率很高,这一现象促使研究人员更加关注大强度耐力运动引起心脏重塑的机制及其影响。
5 右心室重塑的临床影响
5.1 右心室心肌纤维化
一般而言,运动员心脏是一种好的现象,代表了心脏对长期运动的一种正常的适应性变化,这种情况下不会发生心肌细胞减少和胶原纤维的异常堆积。病理性的肥厚通常与心肌细胞凋亡和坏死有关,这种情况下,减少的心肌细胞为过量的胶原纤维所替代。过量堆积的胶原纤维增加了心室的僵硬度,损害心室的收缩和舒张能力,电传导系统的纤维化及毛细血管密度,从而导致心肌缺血,最后从心肌肥厚发展为心衰[71]。心肌纤维化主要有两种类型:替代性和间质性[72]。替代性心肌纤维化主要特征是由细胞坏死导致集中区域的瘢痕组织。而间质性心肌纤维化呈现出胶原堆积伴随着间质扩张,但不会发生细胞坏死。核磁共振的延迟性钆增强反映了集中型瘢痕的形成、表明替代性心肌纤维化;而核磁共振的新技术T1 Mapping 能够检测间质性心肌纤维化。
对运动员进行心肌活检时检测到了纤维化和炎症的浸润[73]。活检组织学切片提供了确实的证据证明心肌纤维化,但是这种炎症浸润和纤维化并没有特异性。而且心肌活检是一种具有很大风险的侵入性手段,在没有高度怀疑心脏病的情况下不适用于进行心肌活检。核磁共振成像技术钆剂对比是一种精确的非入侵式检测心肌纤维化的手段。钆剂是一种细胞外造影剂,主要集中于纤维化区域,因此可被用于描述心肌损伤。在使用钆剂作为对比剂的核磁共振成像中,与黑色的正常心肌相比,纤维化部位比较明亮,钆显示出来的时间延长因此被称为延迟性钆增强[34]。多项研究在老运动员身上发现其心脏出现延迟性钆增强,大多数情况下,这种增强形状很小且主要位于室间隔和右心室插入部位[34]。最初,Wilson等[74]采用心脏核磁共振成像技术发现12名老运动员中有6名出现不明原因的心肌纤维化,而没有任何一个年轻运动员或者是与老运动员年龄匹配的普通受试者出现心肌纤维化。随后,La Gerche等[32]发现长期训练的运动员在CMR检测下出现心肌纤维化,且右心室收缩功能下降,表明心脏对运动超载的耐受性有限,且心肌纤维化可能导致室性过速和猝死。据此,一些研究者提出:长期大强度运动能引起心脏扩张,并激活肥大细胞、周细胞和成纤维细胞,最终导致胶原沉积和纤维化[75,76]。
然而,并不是所有的研究结果都支持大强度耐力运动会导致右心室心肌纤维化。Bohm等[77]得到的结果与La Gerche和Wilson的完全不同,他们以耐力运动员(33人)及对照人员(33人)为研究对象,心脏超声的结果显示心脏扩张,心脏核磁共振成像并未发现运动员出现心肌纤维化(只有一名运动员左心室出现心肌纤维化,可能与之前患过心包炎有关)。这项研究发现尽管耐力运动员出现右心室内径增大,但是与对照组相比并未出现右心室心功能障碍。Sanchis-Gomar等[78]也未在53名运动员中观察到心肌纤维化,同时血液中心肌纤维化的生物标志物也没有显著性变化。还有其他几项采用CMR 的研究也并未发现耐力运动员出现心肌纤维化[35,79,80]。
这些不一致的结果使得科研人员不能确定长期大强度耐力运动和右心室纤维化之间的关系。此外,还有一些其他独立于运动之外的因素可能会导致小部分老运动员出现心肌纤维化,比如不良的训练习惯及不充分的恢复时间,感染期间进行训练或比赛和不健康的生活习惯(如酗酒、不健康的饮食等)。因此,只有严格控制变量并对运动员进行长期观察的研究才有可能精确地找出导致这种病理学变化的因素和潜在机制。
在动物模型中,所用实验对象具有相同的基因背景,且运动方案一致,在一定程度上能克服上述人体研究的缺陷。有动物实验研究发现长期大强度运动会导致心肌炎症和纤维化,Chen 等[81]发现大鼠在经过长期大强度游泳训练后其心肌细胞损伤、坏死,并出现炎症浸润。Benito等[25]迫使大鼠进行长期大强度跑台训练,结果大鼠心房和心室出现纤维化,且其室性心律失常的风险增高。本课题组[27,69,82]以及Maria等[26]的研究也发现长期大强度运动后右心室出现心肌纤维化而左心室未出现,且中强度运动也不会造成右心室心肌纤维化。值得指出的是,虽然几乎所有的动物实验都发现长期大强度运动会导致右心室心肌纤维化,但是这些动物都是非自主运动,而且样本量也都相对较少,因此不能直接推理到人类身上。
在健康耐力运动员身上出现的心肌纤维化是否代表一种临床问题?目前仍然不是很清楚[32]。但是大多数的研究都支持心肌纤维化是心律失常的结构基础,如心房纤维化通常与房颤相关[83,84],表明右心室心肌纤维化也有可能会导致室性心律失常,增加大强度耐力运动过程中猝死的风险。
5.2 致心律失常性右心室心肌病
致心律失常性右心室心肌病(arrhythmogenc right ventricular cardiomyopathy,ARVC)主要依靠以下几个方面的证据,包括患者的个人和家族病史、心电图特征、组织学观察、超声心动图或磁共振成像得到的形态学和功能数据。其中,超声心动图诊断标准包括右心室局部运动不全或运动障碍,流出道增大以及右心室收缩功能下降。
ARVC 通常与右心室扩张、右心室功能障碍、右心室心律失常及心源性猝死有关。从基因上讲,ARVC的产生与桥粒及粘附分子相关蛋白的基因突变密切相关,桥粒及粘附分子相关蛋白负责肌细胞与肌细胞的结合[85]。桥粒蛋白功能失调导致心肌细胞被脂肪和纤维组织破坏和替代,此外,桥粒蛋白基因缺陷,包括桥粒芯糖蛋白、桥粒芯胶蛋白、桥粒斑蛋白和桥粒斑珠蛋白,被认为是ARVC 的诱因[85]。与左心室相比,右心室的室壁更薄,在大强度耐力运动时右心室更容易过度扩张进而造成桥粒蛋白的损伤。
ARVC在家族内的发病率并无规律可言,表明这种疾病可能受外部环境的影响较大[86]。目前已有研究在人体[86]和动物[85]中发现,运动训练能促进ARVC的发生和发展。
桥粒斑珠蛋白连接桥粒的细胞质成分,并与细胞内细胞骨架和肌动蛋白等收缩性肌纤维相连接。桥粒斑珠蛋白缺陷小鼠表现出更大的右心室内径、右心室功能下降且伴随右心室心律失常,这些现象与临床上ARVC 的表现很相似[85]。在这种模型的动物实验中发现耐力运动可加重右心室的扩张和功能障碍[85]。
运动训练似乎也能增加人类ARVC 的发病率。桥粒基因突变携带者中,那些有耐力运动习惯的人(30.1岁)比那些不参加耐力运动的人(40.6岁)出现ARVC症状的时间更早[86]。而且这些基因突变的人群中,参加耐力运动的人达到ARVC 诊断标准的比例(82%)也比不运动的人(35%)高。把运动强度进行四等分后,第二、三、四分位的人群达到ARVC诊断标准的风险分别比最小强度运动的人群高6.64、16.7 和25.3 倍。此外,对于那些运动强度最大的人群,如果降低他们的活动量,则可降低他们室性心动过速和室颤的风险。
一项动物实验发现[25],大鼠被强制性地在跑台上大强度运动16周,结果发现这些大鼠右心室出现胶原沉积且促纤维化因子表达上调,但左心室并未出现这些变化。而且他们还发现大强度训练后42%的大鼠出现室性心动过速,而安静组只有6%的大鼠出现。
总之,长时间大强度耐力运动可能会促进ARVC的发展。在没有右心室心肌病遗传病的情况下,长期大强度耐力运动会导致右心室损伤和心肌纤维化。
6 总结与展望
大强度耐力运动时右心室压力急剧增加,导致右心室过度扩张,对右心室心肌细胞造成一定的损伤,进而降低心肌细胞的收缩能力,表现为右心室功能下降。另一方面,长期规律性大强度运动会反复引起这种右心室心肌细胞损伤,在没有适当恢复的情况下,右心室会发生不恰当的修复最终形成心肌纤维化,增加运动员室性心律失常的风险。值得指出的是,大强度耐力运动后有些运动员会出现左心室功能下降,这可能并不是由左心室心肌细胞损伤或收缩功能下降引起的,而是由于右心室心肌细胞功能下降通过室间隔传导到左心室,从而导致左心室功能下降,最终影响运动员的运动表现。因此,右心室功能可能是耐力运动员进行大强度耐力运动的重要限制因素,也是易损部位。
此外,随着大强度耐力运动的参与人数越来越多,尤其是马拉松运动在我国呈井喷式发展,马拉松赛事过程中医疗事故频发,包括参赛者猝死等,表明大强度耐力运动的风险尚未引起足够的重视。马拉松参赛人员在没有专业指导的情况下盲目地进行训练和参赛,可能会导致不良的心脏重塑,以右心室最为容易受损,可能发生右心室扩张、功能下降和纤维化,进一步引起心律失常,为运动中心源性猝死埋下隐患。因此,今后应加强对耐力运动员右心室的医务监督,这对预防大强度耐力运动过程中心血管事故的发生具有重要意义。
