红球菌PB-1对高浓度苯酚及苯系物的降解研究
2020-05-21马馨月魏思洁叶超然陈兰洲
马馨月,魏思洁,柯 檀,叶超然,陶 越,陈兰洲
(武汉大学资源与环境科学学院,湖北 武汉 430079)
我国水体主要的有机污染物包括酚类化合物、苯胺类物质以及其他苯环类物质[1-2]。酚类化合物被认为是水体中存在最广泛、潜在危害最大的污染物之一[3],是废水中常见的难降解和高毒性的有机物[4]。苯酚作为化工合成中常用的反应底物,常存在于农药、医药、焦油和染料工业废水中,同时还会伴随着其他苯系物质的污染,典型的有喹啉、吲哚、萘和苯酚衍生物等[5],一些废水中还包含苯胺类物质[6]。这些化合物的联合毒性作用一般会增强[7],因而需要开发出能在去除废水中苯酚的同时还能有效去除或耐受其他组分的方法。目前常用于去除废水中酚类、苯胺类等芳香族化合物的方法包括化学氧化、材料吸附等,但存在费用高、污染物去除不彻底、容易产生二次污染等缺点[8]。微生物修复技术一直以来以低廉的成本、高效的降解率、无二次污染等特点受到越来越多的关注[9]。包括细菌、真菌和藻类在内的多种微生物均可降解废水中的苯酚[10],但降解苯胺的微生物主要是在细菌中发现的[11],而Mucha等[12]发现一株假丝酵母菌BP-6可以降解废水中的苯胺。但在实际废水处理中,往往存在成分复杂的复合污染,不利于具有单一降解性能的菌株的存活。很多文献报道了微生物降解废水中苯酚的有效性,但很少同时研究菌株对废水中多种组分的降解情况,特别是对高浓度苯胺。有研究很早指出红球菌属细菌,既能降解苯酚,又能降解苯胺、苯甲酸酯等物质[13]。但在高浓度苯酚条件下,尤其是在焦化、医药和煤化等行业的废水中,苯酚的浓度可高达1 000~5 500 mg/L[14],而当苯酚浓度超过1 000 mg/L时,微生物活性受到抑制,生物降解过程会明显减弱[10]。
本研究经筛选分离得到一株苯酚高效降解菌PB-1,该菌株可降解高浓度(>1 000 mg/L)苯胺,且对喹啉有一定的耐受作用。本文主要研究了该菌株对高浓度苯酚的去除特性及其作用底物的多样性,并揭示了该菌株降解苯酚、苯胺的途径,以为使用微生物修复技术处理含高浓度苯酚的复杂工业废水提供依据。
1 材料与方法
1. 1 样品采集
试验土样采自湖北省某焦化厂含煤焦油底泥和岸边土壤,采集的土样放置于塑封袋内,并封口扎严。土样经粉碎后去除其中植物根茎、碎石子及多余残渣,置于4℃低温保存。
1. 2 高效降解菌的驯化筛选
先称取10 g 土样,加入到含500 mg/L 苯酚的MSM培养基[15]中至总体积为100 mL,放入适量灭菌玻璃珠后,于28℃、150 r/min下振荡培养5 d;然后取10 mL MSM培养液,加入到含1 000 mg/L苯酚的MSM培养基中至总体积为100 mL,并依次提高新配置的MSM培养基中苯酚的浓度,分别为1 500 mg/L、2 000 mg/L、2 500 mg/L,相同条件下振荡培养5 d。同时,每次转接均吸取1 mL混合液,按照稀释涂布平板法,取200 μL 涂布在含相同苯酚浓度的MSM固体培养基上,28℃恒温培养5 d,观察并记录菌落数量及其生长情况。以此方式,驯化到苯酚浓度最高为2 500 mg/L,最终可得到高效降解菌若干[16]。
1. 3 菌株的鉴定
菌株的理化性质鉴定包括碳源利用、氮源利用和生理生化测试。细菌16S rDNA测序包括菌株纯化、DNA提取、16S rDNA体外PCR扩增(使用16S通用引物1492R和27F,27F:5′-AGAGTTTGATCCTGGCTCAG-3′,1492R:5′-TACCTTGTTACGACTT-3′),细菌DNA经PCR扩增获得1 050bp的基因片段,将测序得到的序列结果代入NCBI的数据库中进行BLAST基因序列比对,并经过MEGA软件分析,与数据库中相似菌株的16S rDNA序列进行比对,建立菌株的16S rDNA分子生物学系统发育树。
1. 4 菌悬液的制备
先将在LB培养基富集培养的菌液于6 000 r/min下离心10 min,倒去上清液,菌体用适量灭过菌的MSM培养基清洗3遍;然后将所有菌体合并至1支离心管中,用适量MSM培养基重悬,使用旋涡混合仪混合均匀;再吸取100 μL菌悬液,纯水稀释至10 mL,混合均匀后在波长600 nm处使用纯水作参比测量吸光度值。根据下面公式计算反应体系的菌液加入量:
A测×V加×100=A×V
(1)
式中:A测为测得的菌液OD600吸光度值;V加为加入的菌液体积(mL);A为试验设定的菌液OD600值;V为反应体系的体积(mL)。
1. 5 菌株对苯酚的降解
对菌株降解苯酚条件进行优化,选择菌体浓度、苯酚浓度、温度和pH值作为研究的单因素变量,试验均在180 r/min的恒温避光摇床内进行,不涉及温度和pH值变量,均为30℃和pH值=7.0条件。设置菌体浓度OD600为0.1、0.2和0.3,苯酚浓度为1 000 mg/L、1 500 mg/L、2 000 mg/L、2 500 mg/L,温度梯度选择20℃、25℃、30℃、35℃、40℃,调节培养基pH值分别为5、6、7、8、9、10。取样1 mL,于8 000 r/min下离心10 min收集菌体。苯酚浓度的检测采用4-氨基安替比林法[17],使用紫外分光光度计(Spectrum SP-752)于波长510 nm处进行比色测定。
1. 6 降解底物广谱性检测
对试验样品进行了GC-MS检测,其污染物包括氯代酚、硝基酚、多酚、喹啉、萘等苯系物质。根据检测结果,设置几种芳香类物质的初始浓度为100 mg/L,菌体浓度OD600为0.1,并设置对照组为不加碳源的MSM培养基,于30℃、180 r/min条件下培养3~5 d,观察细菌生长情况,对比培养液颜色及浑浊度。
菌株对不同浓度苯胺的降解:依次配制含苯胺浓度分别为300 mg/L、500 mg/L、800 mg/L、1 200 mg/L、1 500 mg/L的MSM培养基,设置菌体浓度OD600为0.3,于30℃、180 r/min条件下培养,每组设置3个平行样。苯胺浓度测定在pH值为8.0的硼砂-盐酸缓冲液体系进行,使用紫外分光光度计于波长230 nm处进行比色测定[18]。
1. 7 双加氧酶活性检测
分别配制含1 000 mg/L苯酚、1 000 mg/L苯胺的MSM培养基和LB 培养基,加入菌液使菌体浓度OD600为0.3,于30℃、180 r/min条件下培养48 h 后,并于6 000 r/min离心10 min收集菌体;采用pH值为7.5的磷酸缓冲液洗涤菌体2次,之后悬浮在相同的磷酸缓冲液中,利用超声波细胞粉碎机进行破碎(超声4 s,间隔6 s,总时间为10 min),并于10 000 r/min离心20 min,上清液即为细胞裂解液,用于粗酶活性测定。粗酶液蛋白质浓度按Bradford法测定[19]。酶活单位(U)定义为每分钟催化生成1 μmol产物所需的酶量。
反应混合物共3.0 mL,含有2.0 mL磷酸盐缓冲液(pH值为7.5)、0.6 mL的1 mM邻苯二酚、0.2 mL去离子水和0.2 mL细胞裂解物,反应在室温下进行。使用紫外分光光度计,通过测定波长为375 nm处的2-羟基黏康半醛的吸光度和波长为260 nm处的黏康酸的吸光度,计算邻苯二酚2,3-双加氧酶(C23O)和邻苯二酚1,2-双加氧酶(C12O)的活性。每分钟读数1次,记录前5 min的数值。根据下面公式计算酶的反应速率[20-21]:
(2)
式中:v为酶的反应速率(μmol/L·min);A′为吸光度的变化率(min);b为比色皿内腔厚度(cm);ε260和ε375为常数,ε260为 16 000 L/(mol·cm),ε375为 12 000 L/(mol·cm)。
2 结果与分析
2. 1 菌株的鉴定
2.1.1 菌株的理化性质鉴定
在固体LB培养基上,该菌落约3 d成熟,其大小规则,圆形,橘红色,中部隆起,边缘光滑,不透明,直径约为0.2 cm,湿润黏稠易挑取。菌株PB-1的理化性质鉴定包括碳源利用、氮源利用和生理生化测试,其结果见表1。

表1 菌株PB-1碳源利用、氮源利用和生理生化检测结果
注:“+”表示菌株培养5 d内检测结果为阳性;“-”表示菌株培养5 d内检测结果为阴性。
由表1可知,该菌株的碳源、氮源利用效率较高,不能以NaNO3、KNO3为氮源,为革兰氏阳性菌,有水解淀粉和油脂等能力,能产过氧化氢酶。
2.1.2 细菌16S rDNA测序
细菌DNA经PCR扩增获得1 050bp的基因片段,将测序得到的序列结果输入NCBI的数据库中进行BLAST基因序列比对,该菌株与红球菌属同源性很高,相似度高达99.9%,获得的序列号为MK040534,并经过MEGA软件分析,与数据库中相似菌株的16S rDNA序列进行比对,建立菌株PB-1的16S rDNA分子生物学系统发育树,见图1。同时,结合生理生化测试和形态结构观察结果分析,将该菌株确定为红球菌属,分类命名为红球菌PB-1(Rhodococcussp.PB-1),已保藏于武汉大学中国典型培养物保藏中心(简称CCTCC,地址为:中国· 武汉· 武汉大学),保藏号为CCTCC NO.M2019472。
2. 2 苯酚降解单因素影响试验
本文通过苯酚降解单因素影响试验对菌株降解苯酚的条件进行优化,分别研究了菌体浓度OD600、温度、pH值和苯酚浓度对苯酚降解率的影响,单因素影响试验结果见图2。
将苯酚浓度设置为1 000 mg/L,研究菌体浓度OD600对苯酚降解率的影响,其结果见图2(a)。由图2(a)可见,该浓度苯酚在菌体浓度OD600为0.1时,

图1 菌株PB-1的16S rDNA分子生物学系统发育树Fig.1 Phylogenetic tree of strain PB-1 based on 16S rDNA gene sequence
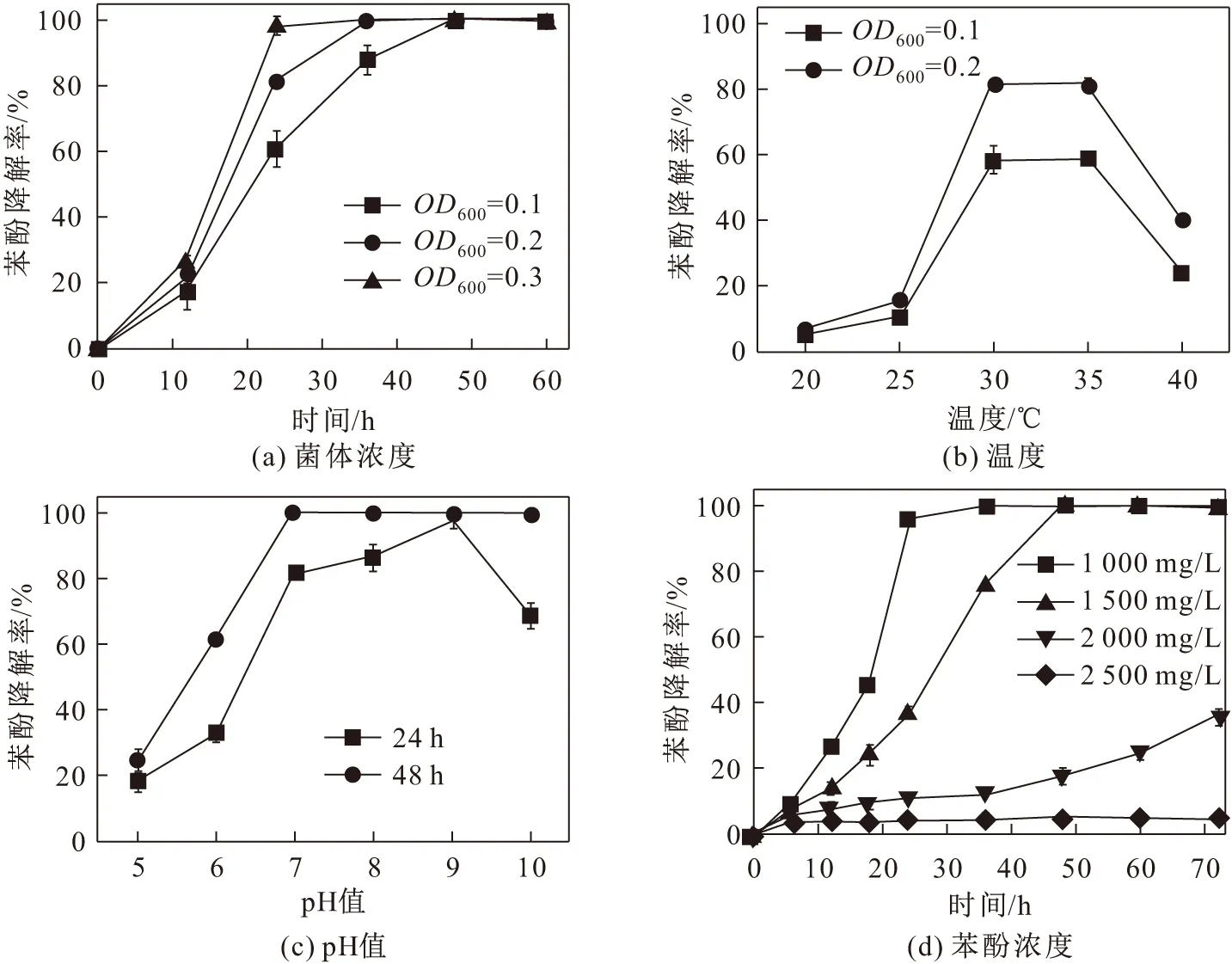
图2 苯酚降解单因素影响试验结果Fig.2 Results of the single factor experiment of phenol degradation
48 h内可完全降解,在菌体浓度OD600为0.2时,36 h内可完全降解,在菌体浓度OD600为0.3时,24 h几乎可完全降解。说明在试验设置范围内,菌体浓度OD600越高,苯酚降解效果越好。
设置菌体浓度OD600分别为0.1和0.2,用于降解1 000 mg/L苯酚,测定24 h苯酚的降解率,研究温度对苯酚降解效果的影响,其结果见图2(b)。由图2(b)可见,菌株PB-1降解苯酚的最适温度范围为30~35℃,低温或高温能明显抑制该菌株的活性。
设置菌体浓度OD600为0.2,苯酚浓度为1 000 mg/L,分别研究pH值对苯酚降解率的影响,其结果见图2(c)。由图2(c)可见,该菌株适宜pH值范围为7.0~10.0,为一株嗜碱菌,该pH值范围内48 h均可完全降解1 000 mg/L苯酚;该菌株降解苯酚最适pH值为9.0,24 h几乎可完全降解该浓度的苯酚。
将菌体浓度OD600设置为0.3,研究苯酚浓度对苯酚降解率的影响,其结果见图2(d)。由图2(d)可见,该菌株48 h可完全降解1 500 mg/L苯酚;该菌株耐受2 000 mg/L苯酚,72 h降解率可达35.76%;该菌株不能在2 500 mg/L苯酚浓度下生长。一些研究显示,菌株降解苯酚的最高浓度不超过1 000 mg/L[10];He等[22]研究发现,红球菌DP-2最高可降解1 300 mg/L的苯酚,表明红球菌属细菌对苯酚有较强的降解能力。
2.3 菌株PB-1降解底物的广谱性
2.3.1 菌株PB-1降解底物的广谱性检测
设置几种苯环类物质的初始浓度为100 mg/L,按100 mg/L梯度增加,加菌培养后与不加碳源的MSM培养基的浑浊度进行对比,并根据培养液细菌生长情况(如颜色、浊度等),可快速判断菌株PB-1对其他苯系物的降解能力,其结果见2。

表2 菌株PB-1对多种苯系物的降解能力检测
由表2可知,菌株PB-1不能降解苯、二氯苯酚、硝基酚、萘等化合物,稍微耐受间苯二酚;对300 mg/L的喹啉可耐受,对1 000 mg/L的苯胺有很高的耐受性。可见,该菌株有望用于高浓度苯胺的去除,以及含喹啉类难降解物质废水中苯酚的去除。
2.3.2 菌株PB-1的喹啉胁迫和苯胺降解
苯酚工业废水的污染组成成分较为复杂,由于菌株PB-1对难降解化合物喹啉有一定的耐受作用,故本文研究了其在喹啉胁迫下对苯酚的降解效果;同时,由于该菌株可降解浓度为1 000 mg/L以上的苯胺,故本文还研究其对不同浓度苯胺的降解效果。
喹啉共同培养时,苯酚浓度设置为1 500 mg/L,依次加入0 mg/L、100 mg/L、300 mg/L、500 mg/L浓度的喹啉,菌体浓度OD600为0.2。喹啉胁迫下,菌株PB-1对苯酚的降解效果见图3。

图3 喹啉胁迫下菌株PB-1对苯酚的降解效果Fig.3 Degradation of phenol by stain PB-1 under quinoline stress
由图3可见,喹啉的添加会显著降低菌株PB-1对苯酚的降解效果,反应48 h时100 mg/L和300 mg/L浓度的喹啉使苯酚降解率分别下降了46.62%和75.31%;当100 mg/L浓度的喹啉存在时,该菌株78 h能完全降解1 500 mg/L苯酚;当300 mg/L浓度的喹啉存在时,该菌株对苯酚的降解率为40.77%;当500 mg/L浓度的喹啉存在时,该菌株不能降解苯酚。这是由于较高浓度喹啉对细胞产生的毒性较大,严重抑制了菌株PB-1的代谢活动。喹啉常出现于焦油生产、印染行业及农药制造等成分极为复杂的工业废水中,微生物可降解的喹啉浓度一般为300~700 mg/L[23]。红球菌PB-1在喹啉类难降解污染物存在下仍能高效地去除苯酚,为复杂废水中苯酚的去除提供了潜在的可能性。
将菌体浓度OD600设置为0.3,菌株PB-1对不同浓度苯胺的降解效果见图4。

图4 菌株PB-1对不同浓度苯胺的降解效果Fig.4 Degradation of aniline using strain PB-1
由图4可见,菌株PB-1 24 h可完全降解300 mg/L苯胺,48 h可完全降解800 mg/L苯胺,72 h可完全降解1 200 mg/L苯胺;该菌株耐受苯胺的浓度为1 500 mg/L,72 h对苯胺的降解率达68.06%。Zhuang等[24]研究发现,红球菌AN5 去除500 mg/L苯胺至少需要32 h,而红球菌PB-1能在30 h内完全降解相同浓度的苯胺。一些研究表明,一些菌株不能耐受浓度超过1 500 mg/L的苯胺[11],而菌株PB-1耐受苯胺的浓度超过1 500 mg/L,因此菌株PB-1在治理含高浓度苯酚、苯胺废水中具有广阔的应用前景。
2. 4 苯酚和苯胺的降解机理
苯酚和苯胺的微生物降解分别通过苯酚羟化酶和苯胺双加氧酶催化,形成共同的中间代谢产物邻苯二酚,然后邻苯二酚经间位或邻位途径开环裂解[20,25]。邻苯二酚1,2-双加氧酶(C12O)在两个羟基之间开环(邻位途径),产物为黏康酸;邻苯二酚2,3-双加氧酶(C23O)在两个羟基之旁开环(间位途径),产物为2-羟基黏康半醛。因此,通过测定邻苯二酚代谢的中间产物,对应新分离菌株的C12O和C23O活性,即可推测其对苯酚和苯胺的降解路径。
将菌株PB-1在LB培养基以及苯酚、苯胺分别为唯一碳源的MSM培养基中培养48 h,收集菌体并破碎细胞,提取粗酶液,测定蛋白质浓度,并进行酶活力测试。通过紫外分光光度计读取前5 min内酶活反应引起的示数变化,记录数值,并根据公式(2)计算酶反应速率。红株菌PB-1在不同培养基中两种双加氧酶的活性检测结果,见表3。
表3 红球菌PB-1在不同培养基中两种双加氧酶的活性检测结果

Table 3 Detection of two dioxygenase activities in different media by strain PB-1
由表3可知,在以苯酚或苯胺为唯一碳源的MSM培养基中仅检测到C12O的活性,表明菌株PB-1对苯酚和苯胺的降解均通过C12O催化的邻位途径,该途径的产物最终进入三羧酸循环[20,25],苯酚和苯胺均能被菌株PB-1彻底降解;同浓度苯酚和苯胺对细胞的刺激水平不同,可能由于苯胺对菌株的毒性作用较大,细胞的应激反应强烈,导致苯胺培养基中的酶活力(352.5 U/μg蛋白质)远远高于苯酚培养基中的酶活力(105.0 U/μg蛋白质n)[22];在LB培养基生长的菌液中未检测到双加氧酶的活性,说明该酶是一种诱导酶。
3 结 论
从污染环境中分离得到一株苯酚高效降解菌,经分离鉴定为一株红球菌,命名为PB-1。该菌株24 h可完全降解1 000 mg/L苯酚,能降解浓度高达2 000 mg/L的苯酚和1 500 mg/L的苯胺,其对苯酚和苯胺72 h的降解率分别达到35.76%和68.06%;在300 mg/L浓度的喹啉存在下,该菌株对1 500 mg/L苯酚78 h的降解率仍能达到40.77%;红球菌PB-1对苯酚和苯胺的降解效率高,底物降解彻底,环境友好,同时耐受难降解的喹啉类杂环芳香物质,对治理成分复杂的相关有机物污染工业废水,如焦油、印染等行业废水,具有极高的应用价值。
