丰富环境对脑缺血再灌注损伤大鼠血管内皮生长因子表达的影响
2020-05-20张莹陶陶张继荣周文美
张莹 陶陶 张继荣 周文美
缺血性脑卒中是一种常见的脑血管病[1],主要病因为动脉粥样硬化或血栓导致脑血供责任动脉管腔狭窄甚至完全阻塞,引起脑组织血氧供给不足,进而造成局部脑组织发生损害和细胞坏死。丰富环境(enriched environment,EE)是一种康复治疗的一种干预技术,使动物暴露在一个复杂的、高度刺激和社会环境中,被广泛用于动物实验研究。环境因素和活动可能影响脑损伤大鼠的功能结局、组织完整性和脑损伤后的恢复[2-3]。
血管内皮生长因子(VEGF)是血管生长因子中最重要的成员,对内皮细胞的生长和分化起关键作用。脑缺血再灌注(cerebral ischemia reperfusion,CIR)损伤后,低氧诱导因子表达增加,上调其下游靶基因VEGF的表达[4],通过VEGF与血管内皮细胞膜上的相应受体结合引发下游信号级联,促进血管新生[5],对缺血后神经功能的恢复起关键作用[6]。本实验通过观察EE干预对CIR模型大鼠脑组织缺血半暗带VEGF表达的影响,旨在探索EE对CIR损伤的改善机制,为其治疗缺血性脑卒中提供理论依据和实验基础。
1 材料和方法
1.1 动物及分组SPF级成年雄性Sprague-Dawley(SD)大鼠64只,体质量220~250 g,实验动物生产批号:SYXX(黔)2018-0001。将大鼠随机分为正常组、假手术组、 CIR模型组和EE干预组,每组16只。大鼠术前禁食12 h,禁水8 h。动物的使用符合贵州省动物管理委员会管理条例。
1.2 主要试剂与仪器RT-qPCR试剂盒、PrimeScriptTM RT reagent Kit with gDNA Eraser 和SYBR Green试剂盒均为TaKaRa公司产品,VEGF抗体购于Proteintech公司,引物由上海生工设计合成。
1.3 方法
1.3.1CIR造模:采用Longa等[7]法建立大脑中动脉栓塞(MACO)再灌注模型。简要步骤如下:按体重0.35 mL/100 g给予大鼠腹腔注射10%(质量浓度)水合氯醛,颈部剃毛,皮肤消毒后行正中切口,钝性分离右侧颈总动脉、右颈外动脉及右颈内动脉。结扎右颈总动脉近心端,动脉夹暂时夹闭右颈内动脉起始处,于颈总动脉插入消毒的线栓,松开动脉夹后将线栓轻柔插入大脑中动脉起始处。缺血60 min后,再次进行麻醉,然后缓慢轻柔拔出线栓,结扎右颈总动脉,缝合颈部切口。待动物苏醒后观察其步态和行为,按照Longa等法[7]评分标准判断造模是否成功,评分为1~3分的大鼠进入后续实验,如大鼠死亡或造模失败,用备用大鼠补齐数量。假手术组大鼠插入线栓后随即马上轻柔拔出,不滞留大脑中动脉,其余操作同模型组。正常组不做任何处理。
1.3.2饲养环境:(1)标准环境:大鼠置25 cm×15 cm×20 cm塑料笼,笼内放置垫料无玩具,2只/笼,予以饲料和饮用水;(2)EE:大鼠置75 cm×25 cm×60 cm 金属网格笼,笼内放置饲料、垫料、水及各类球形、积木类等玩具,4只/笼,饲养14 d。
1.3.3取材:EE干预的第1天,各组随机抽取8只大鼠麻醉处死;余大鼠于EE干预的第14天处死。取造模大鼠脑缺血半暗带组织,取正常组及假手术组大鼠对应造模大鼠梗死灶位置脑组织。取部分脑组织置含4%(质量浓度)多聚甲醛的PBS溶液中固定24 h,二甲苯透明,石蜡包埋,5 μm切片,行HE染色及免疫组化检测。余脑组织存-80℃冰箱用于实时荧光定量PCR (qRT-PCR)检测。
1.3.4HE染色:取各组大鼠脑组织石蜡切片,二甲苯脱蜡,梯度乙醇脱苯,苏木精染核,10 mL/L盐酸乙醇返蓝,至水洗,入10 mL/L伊红水溶液染色,梯度乙醇脱水,二甲苯透明后封片镜检,观察组织细胞形态的改变。
1.3.5qRT-PCR检测VEGF mRNA表达:取大鼠脑组织和0.5 mL Trizol溶液置于研磨器中,置冰上充分研磨后静置10 min,将研磨液转移至洁净EP管;加入氯仿200 μL充分混匀,于4℃下以12000 r/min 离心15 min(离心半径=8.4 cm);取上层水相转移至新EP管内,加入500 μL异丙醇混匀,冰上静置10 min;于4℃下以12000 r/min 离心5 min(离心半径=8.4 cm),去上清液,用预冷的75%(体积分数)乙醇洗涤,于室温下风干;再用DEPC水20 μL溶解沉淀。采用紫外分光光度计测定样本RNA浓度及纯度,纯度为1.8~2.0时可用于检测。采用TakaRa逆转录试剂盒,将RNA逆转录成cDNA分子;采用TaKaRa的SYBR Green试剂盒进行实时定量聚合酶链反应。VEGF上游引物为5′-ACCAGCGCAGCTATTGCCGT-3′,下游引物为5′-CACCGCCTTGGCTTGTGACA-3′;内参GAPDH 上游引物为5′-GACATGCCGCCTGGAGAAAC-3′,下游引物为5′- AGCCCAGGATGCCCTTTAGT-3′。采用2-ΔΔct值计算各组大鼠VEGF mRNA的相对表达量。
1.3.6免疫组化检测VEGF表达:取各组大鼠脑组织石蜡切片,经脱蜡、梯度脱水、抗原修复,以30 mL/L H2O2去离子水灭活内源性过氧化物酶,正常山羊血清封闭,滴加一抗VEGF稀释液(1∶50),置4℃冰箱过夜。37℃复温45 min,按链霉亲和素-生物素复合物(SABC)法完成免疫组化染色(中杉金桥免疫组织化学试剂盒),苏木素复染,盐酸乙醇分化,梯度脱水,二甲苯透明,中性树胶封片。置200倍显微镜下计数VEGF阳性细胞(呈棕黄色)数量,每张切片取3个不重复视野,计算均值,应用Image J软件进行分析。
1.4 统计学处理采用GraphPad Prim7.0软件进行分析,服从正态分布的计量资料以均数±标准差表示,多组均数比较采用单因素方差分析,两两比较采用LSD法。以P<0.05为差异具有统计学意义。
2 结果
2.1 脑缺血半暗带病理改变正常组与假手术组大鼠脑组织结构清晰,神经元规则排列,细胞核仁清晰;EE干预第1天时,CIR模型组与EE干预组大鼠脑缺血半暗带出现水肿、组织结构呈稀疏的网格状或空泡样排列、神经元脱失、核固缩、核仁消失等病理改变;EE干预的第14天时,CIR模型组和EE干预组脑组织水肿减轻,神经元脱失减少,且EE干预组较CIR模型组改善明显。结果见图1。
2.2 各组脑组织VEGF及其mRNA检测EE干预第1天时,正常组、假手术组、CIR模型组及EE干预组大鼠脑组织VEGF mRNA及VEGF阳性细胞数比较差异均有统计学意义(F=27.41,P<0.01;F=67.83,P<0.01);两两比较显示,CIR模型组与EE干预组大鼠其mRNA表达水平及阳性细胞数均高于正常组和假手术组(均P<0.05),而CIR模型组和EE干预组间及正常组与假手术组间其表达水平比较差异无统计学意义(均P>0.05)。EE干预第14天时,4组大鼠脑组织VEGF mRNA及VEGF阳性细胞数表达比较差异有统计学意义(F=4.98,P<0.05;F=12.19,P<0.01);两两比较显示,EE干预组脑缺血半暗带VEGF mRNA表达及VEGF阳性细胞数均高于正常组、假手术组和CIR模型组(均P<0.05),余3组间两两比较差异均无统计学意义(均P>0.05)。结果见图2~4。
3 讨论
EE通过改变生活环境使个体从环境中接收更多的感觉输入,增加动物间的社会交流,加大运动量的这一方式可促进机体恢复。Jiang等[8]研究结果表明,EE干预能有效防止大鼠CIR引起的星形胶质细胞肿胀,减少脑损伤。作者课题组前期研究证实,EE可上调大鼠CIR引起的内源性脑源性神经营养因子表达进而快速启动内源性保护机制,改善大鼠神经功能,提高学习记忆能力[9]。
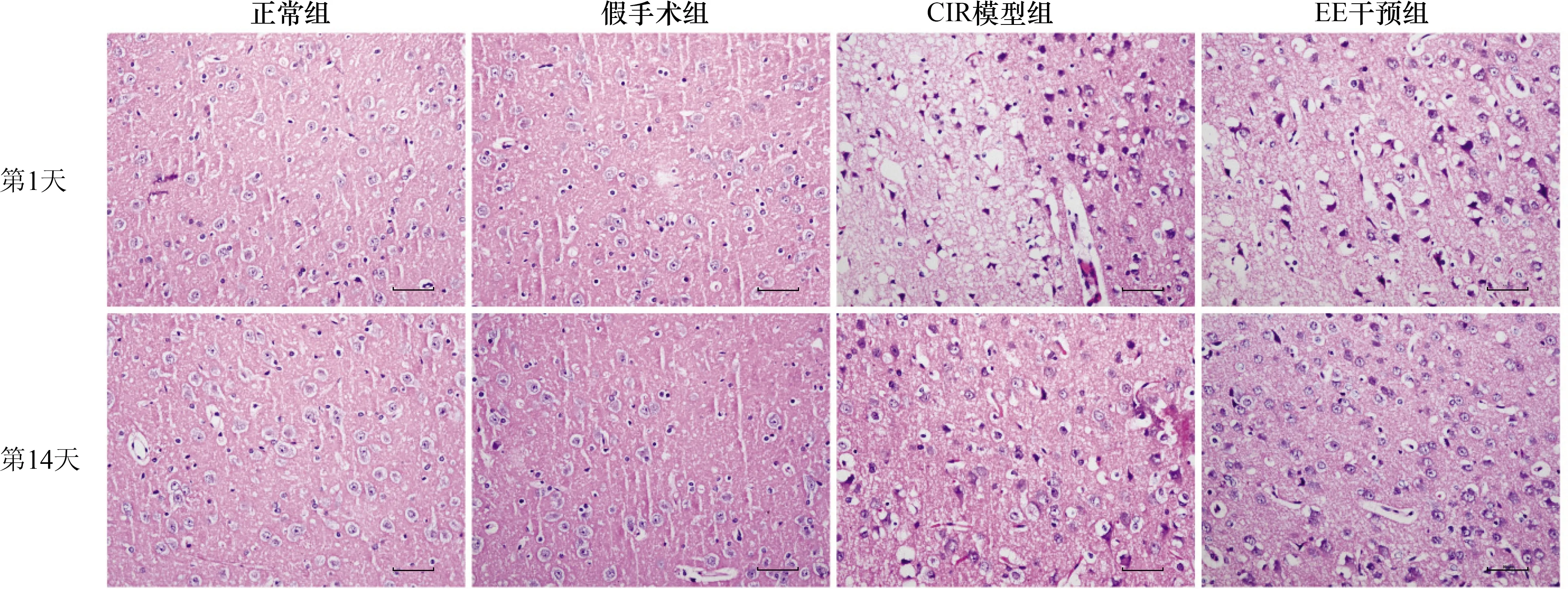
注:CIR:脑缺血再灌注,EE:丰富环境;图2~4同 图1 各组大鼠脑缺血1 h EE干预不同时间脑组织病理改变(HE染色,比例尺=50 μm)
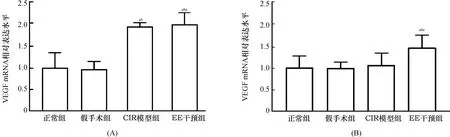
注:VEGF:血管内皮生长因子,图3~4同;与正常组比较,aP<0.05;与假手术组比较,bP<0.05;与CIR模型组比较,cP<0.05 图2 各组大鼠脑缺血1 h EE干预第1天(A)、第14天(B)脑组织VEGF mRNA表达变化
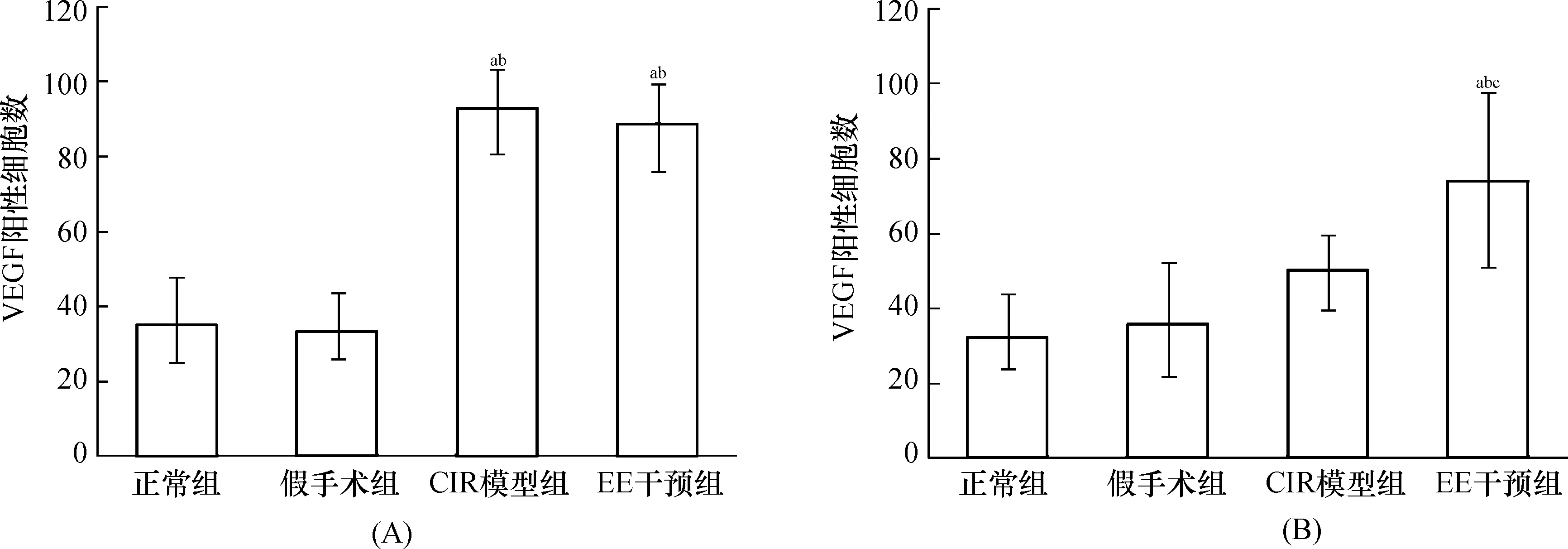
注:与正常组比较,aP<0.05;与假手术组比较,bP<0.05;与CIR模型组比较,cP<0.05 图3 各组大鼠脑缺血1 h EE干预第1天(A)、第14天(B)脑组织VEGF阳性细胞计数
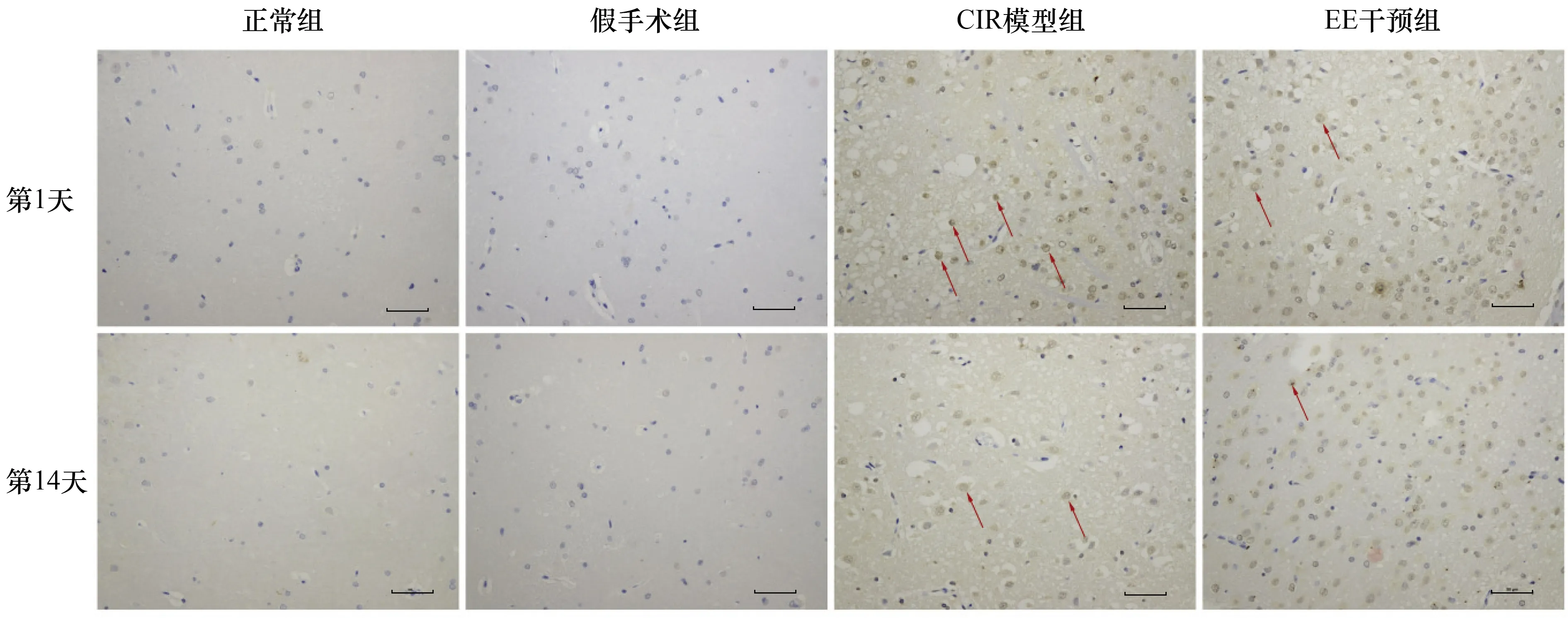
图4 各组大鼠脑缺血1 h EE干预不同时间脑组织VEGF阳性细胞(箭头所示)表达情况(免疫组化,比例尺=50 μm)
VEGF于1983年由Senger等发现的一种促内皮细胞分裂因子[10]。关于VEGF的研究一直是众多学者的研究方向。Lee等研究发现,沙鼠脑缺血后CA1锥体层VEGF免疫反应活性升高[11],提示VEGF可能参与缺血后的机体调节机制。Zhang等通过给予脑缺血损伤模型大鼠外源性VEGF发现,外源性VEGF可促进大鼠脑组织新生血管形成,明显改善脑缺血状态,减少脑缺血损伤[12]。在脑缺血期间,VEGF通过刺激血管生成和调节血管通透性、直接神经保护和促进神经生成等机制发挥对脑组织的保护作用[13]。另有研究结果显示,VEGF预处理暴露于低氧葡萄糖剥夺环境的A1人杂交克隆神经元(人大脑神经元+神经母细胞瘤细胞),可降低A1细胞的死亡,表明VEGF可保护人大脑神经元在体外缺血损伤后免于细胞死亡,具有神经保护作用,且这种保护与VEGFR-2/Flk-1受体的表达增加和细胞内VEGF的增加有关[14],证实VEGF表达增加是保护损伤神经元作用的关键。
本研究结果显示,EE干预的第1天时,CIR模型组和EE干预组大鼠脑缺血半暗带中VEGF mRNA及其蛋白表达明显高于正常组和假手术组,而CIR模型组和EE干预组间比较无统计学差异;EE干预的第14天,EE组大鼠脑缺血半暗带中VEGF阳性细胞数及VEGF mRNA表达高于CIR模型组,而CIR模型组、正常组和假手术组两两比较无统计学差异。提示大鼠CIR后的急性期内源性VEGF增加,CIR急性期后VEGF表达会下降,但EE可增加内源性VEGF的表达,可能通过上调VEGF表达启动内源性保护机制。机体内血管新生依赖血管外促血管生成因子的刺激,在细胞外基质蛋白酶的作用下先引起血管基底膜被溶解,促进血管内皮细胞向血管外游离形成新生血管,而VEGF介导的各信号级联分别参与上述血管新生的各个过程,直接控制血管新生的发生发展,在一定程度上决定了血管新生的结果[5]。Zhang等[15]借助激光扫描共聚焦显微镜和三维定量分析小鼠的大脑微血管发现,小鼠脑组织缺血边界区总血管表面积和分支点数量在EE干预后增加,证明了EE作为一种强化环境的康复策略,可能有助于脑组织缺血半暗带毛细血管血运重建,从而保护脑组织。
综上所述,EE可能通过上调CIR损伤引起的内源性VEGF的表达诱导血管新生,重建脑组织缺血半暗带毛细血管血运,进而保护脑组织,改善CIR。有关EE干预对脑组织缺血缺氧的具体调节机制尚需进一步研究。
