珍稀濒危植物独叶草SCoT-PCR反应体系的建立与优化
2020-05-20
(山西运城农业职业技术学院,山西 运城 044000)
独叶草(KingdoniaunifloraBalf.F.et W.W.Smith)隶属于毛茛科(Ranunculaceae)独叶草属(KingdoniaunifloraBalf. F. et W. W. Smith),是我国特有的珍稀濒危单种属多年生草本植物,自然分布于云南、四川、陕西以及甘肃等4省的局部区域[1]。该植物进化地位原始,生境特殊,分布区狭小,已被列为我国的一级重点保护植物和生物多样性的关键类群[2-3]。目前,关于独叶草的研究主要集中在种群的分布[4-6]、种群生态[7-8]、繁育生物学[9-11]、组织培养[12]等方面;在遗传多样性和遗传关系方面的研究也有一定的报道[13-14],但相对于其他植物则较为滞后。因此,进一步研究独叶草的遗传多样性,有助于科学评估该植物的遗传背景,为后续的保护、研究、开发与利用提供可能的理论基础。
目前,研究植物遗传多样性和居群结构最常用的检测方法是采用DNA分子标记技术[15]。诸如SSR[16]、ISSR[17]、SCoT[18]。SCoT(start codon targeted polymorphism,目标起始密码子多态性标记)具有操作简单、引物通用性强、多态性高、稳定性好等优点[18-19]。该标记已成功应用于粉枝莓[19]、枸杞[20]、五角枫[21]、辣木[22]、彩叶芋[23]等植物种质资源遗传多样性方面的研究,但不同植物的最佳SCoT-PCR反应体系存在较大的差异[18]。SCoT标记在独叶草方面的应用尚未见报道。因此,以独叶草为供试材料,建立并优化其SCoT-PCR反应体系,初步筛选SCoT引物,旨在为独叶草种质资源的遗传多样性研究提供理论基础。
表1 SCoT引物的序列

序号引物序列1CAACAATGGCTACCACCG2ACCATGGCTACCACCGAC3CAACAATGGCTACCACGA4CAACAATGGCTACCACGC5CAACAATGGCTACCACCT6CAACAATGGCTACCACGT7CAACAATGGCTACCAGCA8AACCATGGCTACCACCAC9AAGCAATGGCTACCACCA10ACGACATGGCGACCAACG11ACGACATGGCGACCATCG12ACGACATGGCGACCGCGA13ACCATGGCTACCACCGAG14ACCATGGCTACCACCGGC15ACGACATGGCGACCCACA16CAACAATGGCTACCACCA序号引物序列17CACCATGGCTACCACCAG18ACCATGGCTACCACCGGG19ACCATGGCTACCACCGCC20ACCATGGCTACCACCGTG21CCATGGCTACCACCGCCA22CCATGGCTACCACCGGCC23CCATGGCTACCACCGGCG24CCATGGCTACCACCGCAC25CAACAATGGCTACCACCC26CAACAATGGCTACCACGG27CAACAATGGCTACCAGCC28ACGACATGGCGACCACGC29ACCATGGCTACCACCGCG30CACCATGGCTACCACCAT31CCATGGCTACCACCGCCT32ACCATGGCTACCACCGTC
表2 SCoT-PCR反应体系的因素和水平

水平Mg2+(25mmol·L-1)/μLdNTPs(2.5mmol·L-1)/μLTaq酶(5U·μL-1)/μLPrimer(10μmol·L-1)/μLDNA(10ng)/μL11.50.500.10.4122.01.000.20.8232.51.500.31.2343.02.000.41.64
1 材料和方法
1.1 材 料
供试材料采自于陕西省太白山(107°77′E;33°96′N)。选取长势好的植株,采集无病虫害的新鲜叶片而迅速放入硅胶干燥剂中保存,做好相应的标记。采集完毕后,迅速将材料带回实验室,经过液氮冷冻后,放入-80 ℃的超低温冰箱冷冻保存备用。SCoT 标记引物由上海生工生物工程有限公司合成(表1)。10×Buffer、dNTPs 及TaqDNA 聚合酶等PCR试剂均购自天根生化科技(北京)有限公司。
1.2 方 法
1.2.1基因组DNA的提取与检测
独叶草的基因组DNA提取采用改良的CTAB法[14]。用0.8%的琼脂糖凝胶电泳检测所得的样品基因组DNA质量。同时,用可见光分光光度计(ND-1000 Spectrophotometer)检测样品DNA的浓度。将样品的浓度稀释至10 ng·μL-1,保存于-80 ℃的超低温冰箱中备用。
1.2.2独叶草SCoT-PCR体系的正交设计
根据正交设计表,对SCoT-PCR反应体系的各个因子(dNTPs、Mg2+、TaqDNA聚合酶、Primer和模板DNA等5个因子)的浓度进行优化。每个因子有4个水平,共5个因子(表2)。根据正交表,选择L16(45)处理,即总共16个处理组合(表3)。SCoT-PCR反应体系总共为20μL, 10×Buffer都是2.0μL。PCR反应程序参照张若晨等[21]的方法,扩增结果在1.2%的琼脂糖凝胶电泳中进行检测,凝胶成像系统摄像并保存。
1.2.3独叶草SCoT-PCR最佳反应体系的验证
随机选取多条引物,以所有的样品为对象,对优化而得的独叶草SCoT-PCR最佳反应体系验证。SCoT-PCR反应程序和电泳检测同上。
2 结果与分析
2.1 基因组DNA提取与检测
影响PCR扩增的因素比较多,基因组DNA是其中之一。基因组DNA的浓度和完整性都会对扩增效果有影响。因此,在实验前,都对基因组DNA的完整性和浓度进行检测。由样品基因组DNA的电泳结果看出(图1),每个加样孔均没有杂质残留,电泳条带整齐而略有拖尾,除了第7号样品的亮度较弱、第10号较亮以外,其余样品条带的亮度适中。这初步表明所得的基因组DNA无蛋白质和RNA的污染,其质量和浓度可以满足PCR实验的需要。同时,用可见光分光光度计(ND-1000 Spectrophotometer)检测样品DNA的浓度,并根据检测结果,将样品的浓度浓缩或稀释至10 ng·μL-1,保存于-80 ℃的超低温冰箱中备用。
表3 SCoT-PCR反应体系的L16(45)正交设计表

处理组合Mg2+dNTPsTaq酶PrimerDNA1111112122223133334144445212346221437234128243219313421032431113312412342131341423144231415432411644132

图1 部分样品基因组DNA的电泳结果

图2 独叶草SCoT-PCR体系优化的扩增结果
2.2 正交设计试验结果
通过正交试验,得出独叶草SCoT-PCR体系优化的扩增结果(图2)。根据图2的电泳结果可以看出,在16个组合中,除了4号和12号未能扩增出结果以外,剩下的14个组合都能扩增出大小不一、数量不同、亮度迥异、效果不一的条带。条带的大小介于200~2 000 bp之间。进一步分析发现,1、8组合的条带清晰度低,而且数量较少;2、7、11、14、16组合的条带相对较为清晰,但集中在1 000~2 000 bp之间;9、10、13组合的条带则相对模糊;3、5、6、15组合的电泳效果最好,不仅条带数量丰富,而且主条带清晰而明显,分散性好而亮度适中。通过综合比较3、5、6、15组合电泳条带的丰富性、大小、亮度等,初步认为组合3最优。
2.3 正交试验的直观分析
根据正交试验的结果,可以主观地对每一个组合的电泳效果进行评分。电泳条带数量丰富、大小合适、清晰度高、分散性好、亮度适中的最优组合记为16,最差组合则记为1分[18]。同时,基于主观评分结果,计算出各因素的极差值(R值)。R值的大小与该因素对试验结果影响的程度成正比。根据直观分析表的R值(表4)可以得知,在各个因子中,对独叶草SCoT-PCR反应体系影响最大的是dNTPs和引物,二者的极差值均为7.25;其次是镁离子,再次是TaqDNA聚合酶;影响最小的是基因组DNA。
进一步对各因子的每个水平的主观评分(表4),各因子的最适加样量为:Mg2+为2.0μL或3.0μL、dNTPs为1.50μL、Taq酶为0.2μL、Primer为1.2μL、DNA为3.0μL。L16(45)正交设计表却没有与之完全吻合的处理,只是和组合3的相近。该组合的各因子最适加样量:Mg2+为1.5μL、dNTPs为1.50μL、Taq酶为0.3μL、Primer为1.2μL、DNA为3.0μL。两者在Mg2+和Taq酶的用量上有差异,但这2个因子对体系的影响力均排在dNTPs和Taq酶后面;单因子最适加样量:Mg2+为2.0μL或3.0μL,Taq酶为0.2μL;而组合3最适加样量:Mg2+为1.5μL,Taq酶为0.3μL。同时,曲线效应图(图3)表明,Mg2+随着加样量的增加,效应曲线呈现Z字型,但加样量为1.5μL时的效果,与单因子最优加样量的差异不大;而dNTPs、Taq酶、Primer和DNA等4个因子的效应曲线均随着加样量的增加而呈先增后减的趋势。因此,确定珍稀濒危植物独叶草SCoT-PCR最佳反应组合为第3组合,即总体积25μL:Mg2+为1.5μL、dNTPs为1.50μL、Taq酶为0.3μL、Primer为1.2μL、DNA为3.0μL。
表4 正交设计直观分析

结果Mg2+dNTPsTaq DNA聚合酶引物DNAk17.256.259.504.506.00k29.758.509.755.758.25k33.7511.506.7511.89.25k49.754.254.508.507.00R6.007.255.257.253.25
2.4 独叶草SCoT-PCR最佳反应体系的验证
反应体系的稳定性影响到后续实验。因此,对优化的体系进行验证有其必要。实验结果(图4)表明:在优化而得的体系中,36份独叶草样品均能扩增出数量不同、清晰适中、分散性好的条带,而且条带的多态性丰富。扩增条带数大多为2~4条,片段大小大多介于750~2 000 bp之间。这表明,试验所建立的独叶草SCoT-PCR最佳反应体系的效果好、稳定性高,可用于后续的种质资源遗传多样性评价,亲缘关系和遗传结构等方面的研究。
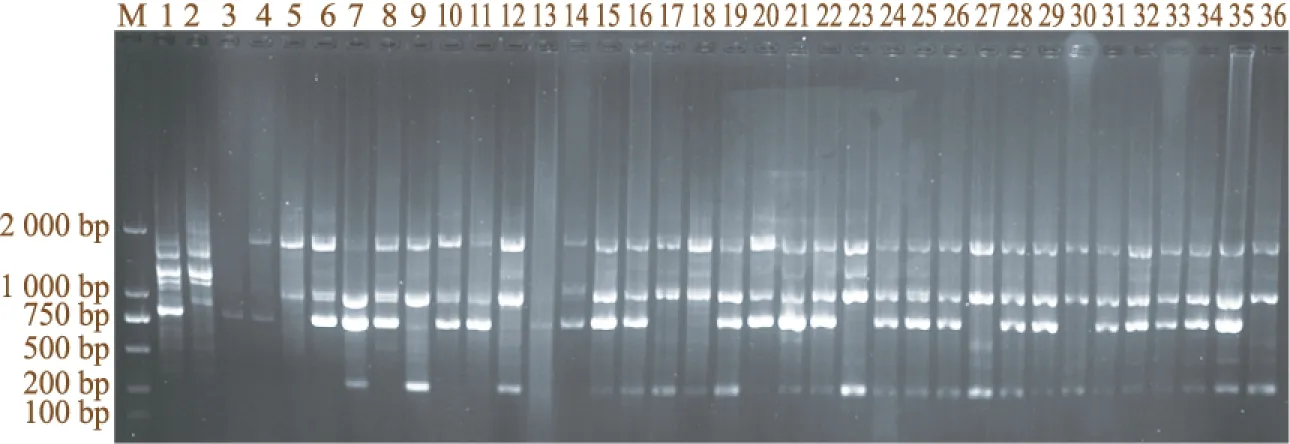
图4 最佳反应体系的验证
3 讨 论
独叶草生境特殊,分布区狭小,已被列为我国的一级重点保护植物;而且进化地位原始,对研究被子植物的进化和毛茛科的系统发育具有重要的科学意义[24]。该植物在遗传多样性和遗传关系方面的研究相对于其他植物则较为滞后,而基于SCoT标记的相关研究也未见报道。SCoT标记的引物通用性强,但是不同材料的最佳体系则有一定的差异。彩叶芋等[23]的SCoT标记最佳反应体系为(20μL):引物浓度0.7μmol·L-1,dNTPs浓度0.5 mmol·L-1,TaqDNA 聚合酶1.25 U,DNA 模板80 ng,Mg2+浓度1.5 mmol·L-1;而粉枝莓[19]的则为(20μL):引物浓度1.0μmol·L-1,dNTPs浓度0.125 mmol·L-1,TaqDNA 聚合酶0.15μL,DNA 模板40 ng,Mg2+浓度1.5 mmol·L-1。
同时,各个因素对反应体系的影响大小也因材料的不同而有差异。研究表明:独叶草SCoT-PCR反应体系各因子的影响大小为:dNTPs =引物>Mg2+>TaqDNA聚合酶> 模板DNA。彩叶芋等[23]的SCoT-PCR反应体系中,dNTPs影响最大,接下来依次为Mg2+、模板DNA、Taq酶和引物浓度;而辣木[22]的PCR反应中各个因素对反应体系的影响程度为dNTP>Mg2+>Taq>引物>DNA 浓度。通过综合直观分析、电泳图等结果,建立了珍稀濒危植物独叶草的SCoT-PCR最佳反应体系,即第3组合(25μL):Mg2+为1.5μL、dNTPs为1.50μL、Taq酶为0.3μL、Primer为1.2μL、DNA为3.0μL。为后续独叶草种质资源遗传多样性的评价、亲缘关系和遗传结构的研究等方面提供了技术支持。
