基于金纳米粒子/Fe-MIL-88-NH2的比率型C反应蛋白免疫传感器
2020-05-19邓燕马玉婵王敏谷梦巧迟宽能胡蓉杨云慧
邓燕 马玉婵 王敏 谷梦巧 迟宽能 胡蓉 杨云慧


摘 要 以金纳米粒子(Au nanoparticles,AuNPs)功能化的金属有机骨架材料(Fe-MOFs,Fe-MIL-88-NH2)为基质材料,构建了双信号比率型免疫传感器,用于C-反应蛋白(C-reactive protein,CRP)的检测。八面体结构的Fe-MOFs不仅提供了较大的有效表面积,可增加固定生物分子的量,促进电子和离子的传输,而且表现出良好的导电性。将AuNPs修饰到Fe-MOFs上可以进一步增加比表面积,以捕获大量抗体以及提高电子转移能力。随CRP浓度的增加,K3Fe(CN)6/K4Fe(CN)6的氧化峰电流减小,而Fe-MOFs的氧化峰电流相对恒定。采用K3Fe(CN)6/K4Fe(CN)6响应电流与Fe-MOFs的响应电流比值作为定量测定CRP的响应信号。以K3Fe(CN)6/K4Fe(CN)6作为信号探针(K3Fe(CN)6/K4Fe(CN)6-sP),AuNPs 修饰的Fe-MOFs作为内参比探针(Fe-MOFs-rP),这种比率探针将sP和rP整合到一个结构中,确保了完全相同的修饰条件以及sP和rP在同一个传感界面上的相互依赖性,因此具有更强的消除环境干扰的能力。所构建的免疫传感器线性响应范围为1~200 ng/mL,检出限为0.3 ng/mL(S/N=3)。此傳感器具有良好的选择性,有望用于心血管疾病的早期筛查和诊断。本研究为制备检测其它生物标志物的比率信号放大传感器奠定了基础。
关键词 C-反应蛋白;金属有机骨架材料;比率型电化学免疫传感器
1 引 言
心血管疾病是造成人类死亡的主要原因之一。欧洲心脏病学会和美国心脏病学会建议根据C-反应蛋白(C-reactive protein,CRP)水平范围评估患者心血管疾病的严重程度[1,2]。CRP是一种分子量约为120 kDa的急性期炎症蛋白,主要由肝脏中响应白细胞介素6(IL-6)的刺激而产生。近年来,许多研究证实,根据CRP的测定可有效预测人群中的心血管疾病[3,4]。CRP水平还与炎症性肠病[5]、结肠癌[6]有很强的相关性。所以,临床医生可通过测量CRP值了解疾病活动。在健康人血清中,CRP的浓度不超过1 μg/mL,当机体有急性炎症、冠心病及肿瘤发生时,血清中的CRP含量可增加近1000倍[7]。由于人血清基质复杂,且生物标志物的浓度较低,因此,发展灵敏、准确、快速的CRP检测方法在临床上具有重要意义。
金属有机骨架(MOFs)是含有芳香酸或碱的氮、氧多齿有机配体,通过配位键与无机金属中心杂化自组装而成的具有立体微孔结构的晶体材料[8,9]。研究表明,相比较于传统的多孔配位化合物或多孔材料而言,MOFs 晶体材料具有很多独特的特征,如超高孔隙率、大的比表面积、良好的热稳定性、均匀的结构以及易于制造和结构可控[10,11]。功能性MOFs已经被应用在气体储存和分离[12]、样品前处理[13]、癌症治疗[14]、催化[15]、药物输送[16]和化学传感[17]等领域。由于MOFs的构建是通过金属单元与有机连接体连接,因此氧化-还原型MOFs中具有氧化-还原性的金属离子可以产生较大的电流响应。但大多数MOF材料由于其水溶性差,且棒状结构限制了电子转移,使其自身的导电性较差。Fe-MIL-88-NH2是一种不规则的八面体形态的Fe-MOFs,在水溶液中具有较高的催化活性和稳定性,以及良好的生物相容性,可用于生物传感器的制备[18]。
近年来,多种比率型电化学检测的“信号放大”与“信号减小”策略已用于对肿瘤标志物的定量检测[19]。含有不同电活性物质的比率型电化学传感器具有双信号输出,并可通过测量不同氧化还原电位下的双氧化还原电流峰值强度的比率确定分析物的浓度,可以对内在背景信号的影响提供内置校正,以减少环境影响和背景噪声,提供更准确的信号,有利于提高电化学传感的准确度和灵敏度[20~22]。比率法已经被广泛应用于各种分析技术,如荧光、电化学和化学发光[23~25]。
本研究构建了双信号比率型电化学免疫传感器,采用金纳米粒子(AuNPs)功能化的Fe-MIL-88-NH2作为基质材料,利用AuNPs和抗体中的巯基形成金硫键固定CRP抗体,Fe-MOFs可以产生较大的电流响应,作为内部参考探针(Fe-MOFs-rP);而K3Fe(CN)6/K4Fe(CN)6作为信号探针(K3Fe(CN)6/K4Fe(CN)6-sP),设计了一种新颖的双信号比率型电化学非标记免疫传感策略。AuNPs被修饰到Fe-MOFs中,增加材料的电导率,以促进电子的转移,进一步提高所制备的生物传感器的灵敏度。此策略将Fe-MOFs-rP和K3Fe(CN)6/K4Fe(CN)6-sP组合作为比率测定探针,可以确保完全相同的修饰条件和Fe-MOF-rP和K3Fe(CN)6/K4Fe(CN)6-sP之间的直接相互依赖关系,显著减少环境干扰。
2 实验部分
2.1 仪器与试剂
使用CHI660D电化学工作站(上海辰华仪器有限公司)进行电化学测量,采用三电极体系(玻碳电极(GCE)、饱和甘汞电极、铂丝辅助电极);CS501超级恒温器(重庆实验设备厂); ST2200HP超声波清洗器(上海科导超声仪器有限公司); ME104E电子分析天平(博特勒-托利多仪器(上海)有限公司);TGL16离心机(长沙湘智离心机仪器有限公司);VTX-E混旋仪(倍捷科技公司);DZF-6020型真空干燥箱(上海博讯实业有限公司);TTRⅢ型X射线衍射仪(日本理学公司);JEM2100透射电镜(日本电子株式会社);扫描电子显微镜(日本Hitachi Science Systems公司)。
C-反应蛋白(CRP)与C-反应蛋白抗体(anti-CRP)购于上海领潮生物科技有限公司;2-氨基对苯二甲酸(C8H7NO4,武汉阿瑞斯生物科技有限公司); FeCl3·6H2O(上海江富实业有限公司);HAuCl4·3H2O(上海国药集团有限公司);乙醇(C2H5OH)、柠檬酸三钠(天津市风船化学试剂科技有限公司);谷氨酸(L-Glutamic acid,Glu)、甘氨酸(Glycine,Gly)、癌胚抗原(Carcinoembryonic antigen,CEA)、壳聚糖(Chitosan,CHIT)、牛血清蛋白(Bovine serum albumin;BSA)、磷酸盐缓冲溶液(Phosphate buffer solution,PBS,pH 7.4)均购于美国Sigma公司;K3[Fe(CN)6]、K4[Fe(CN)6]·3H2O、KCl(天津大茂化学试剂科技有限公司); N,N二甲基甲酰胺(DMF,天津津东天正精细化学试剂厂)。除特殊说明外,所使用的试剂均为分析纯,实验用水均为超纯水(电阻>18 M Ω·cm)。人血清样品由云南师范大学校医院提供(所有实验均在相关法律规定要求下进行)。
2.2 实验方法
2.2.1 Fe-MOFs( Fe-MIL-88 NH2)的合成 参照文献[26]的方法合成Fe-MIL-88 NH2。称取0.126 g 2-氨基对苯二甲酸和0.187 g FeCl3·6H2O置于三颈烧瓶中,加入15 mL DMF,超声数分钟,使其分散均匀。在搅拌的条件下,取197 μL乙酸加入到上述混合溶液中。然后,将混合溶液于120℃油浴4 h 以结晶,冷却到室温后,分别用DMF和无水乙醇离心洗涤3次(8000 r/min,5 min)。最后,将所得样品在真空干燥箱中60℃干燥12 h,得到红棕色晶体。
2.2.2 CRP传感器的制备 将玻碳电极用金相砂纸和不同粒径的Al2O3抛光粉依次打磨成镜面后,分别用50% (V/V) HNO3、乙醇、超纯水超声洗涤5 min,自然晾干。取8 mg Fe-MIL-88-NH2分散到2 mL灭菌水中,超声处理得到分散液。将10 μL 0.5%(w/V)壳聚糖-分散液(1∶1,V/V)的混合液滴加到处理过的玻碳电极表面,自然晾干。根據文献[27]报道的方法制备金纳米溶胶。滴加20 μL 1% 金纳米溶胶,使金纳米颗粒(AuNPs)吸附在Fe-MOFs(Fe-MIL-88-NH2)上,用PBS溶液冲洗,晾干后,再滴加10 μL 60 μg/mL CRP抗体(anti-CRP),于4℃保存过夜,干燥,将抗体固定在AuNPs/Fe-MIL-88-NH2上。用PBS缓冲溶液冲洗电极,自然晾干后,再滴加10 μL 1%(w/V)BSA,在37℃恒温培育1 h,封闭非特异性结合位点。继续用PBS缓冲溶液冲洗,自然晾干后,与不同浓度的C-反应蛋白抗原孵育 30 min,可制得CRP免疫传感器。其制备流程如图1所示。
2.2.3 CRP的电化学检测
在制备好的传感器上滴加10 μL不同浓度的CRP抗原进行孵育,将修饰好的电极浸入10 mL含有5 mmol/L K3Fe(CN)6/K4Fe(CN)6和0.1 mol/L KCl 溶液中,检测电活性探针的差分脉冲( Differential pulse voltammetry,DPV)信号,电压范围0.2~1.2 V,振幅50 mV,脉冲宽度0.05 s,脉冲周期0.1 s。采用K3Fe(CN)6/K4Fe(CN)6响应电流与Fe-MOFs的响应电流比值作为定量测定CRP的响应信号。
3 结果与讨论
3.1 材料的表征
3.1.1 Fe-MIL-88-NH2和AuNPs/Fe-MIL-88-NH2的微观形貌 图2A和2B均为Fe-MIL-88-NH2的透射电镜图,可见所合成的Fe-MIL-88-NH2 显示出不规则的八面体结构,其平均直径约为200 nm,与文献[28]报道一致。图2C和2D 为AuNPs/Fe-MIL-88-NH2的透射电镜图,可以发现,由于AuNPs与氨基具有强烈的吸附能力,平均直径约为5~10 nm的AuNPs被均匀分散到Fe-MIL-88-NH2上。
3.1.2 Fe-MIL-88-NH2的粉末-X 射线衍射(XRD)表征 对合成的Fe-MIL-88-NH2材料进行了XRD表征,并与文献中的标准图谱比较。图3中曲线a为本研究合成的材料的XRD图谱,曲线b是文献[18]中Fe-MIL-88-NH2的XRD图谱。曲线a在11.10°处有很强的特征峰,与文献[27]报道的结果一致。XRD的表征结果说明成功合成了Fe-MIL-88-NH2材料且结晶度较好。
3.2 Fe-MIL-88-NH2和AuNPs对免疫传感器的信号放大作用
为了考察Fe-MIL-88-NH2和AuNPs对响应信号的放大作用,测定了有无AuNPs和Fe-MIL-88-NH2修饰电极在K3Fe(CN)6/K4Fe(CN)6溶液中的差分脉冲响应(图4)。曲线a为通过戊二醛将抗体固定在壳聚糖修饰的电极上的DPV响应,此时只有K3Fe(CN)6/K4Fe(CN)6的氧化峰(0.2 V)。曲线b为抗体通过戊二醛被固定在Fe-MIL-88-NH2 /壳聚糖修饰的电极上的DPV响应,与曲线a相比,在0.9 V处新出现了一个Fe-MOF(Fe-MIL-88-NH2)峰,并且K3Fe(CN)6/K4Fe(CN)6在0.2 V的电化学信号明显增强,这是因为Fe-MIL-88-NH2对K3Fe(CN)6/K4Fe(CN)6的氧化还原反应有一定的催化作用,因此响应信号被放大。曲线c为抗体固定在AuNPs/Fe-MIL-88-NH2/壳聚糖修饰的电极上的响应信号,与没有AuNPs(曲线b)相比,信号明显增强,这是由于AuNPs与Fe-MIL-88-NH2对K3Fe(CN)6/K4Fe(CN)6的氧化还原反应具有协同催化作用,从而使响应信号增强。Fe-MOF可以作为导电基质,有效降低复合材料的电子转移阻力,AuNPs可以降低MOFs的尺寸,有利于增加复合材料的活性位点和比表面积。AuNPs-Fe-MOF独特的异质结构有助于加快工作电极与溶液中K3Fe(CN)6/K4Fe(CN)6之间的电子转移,进一步改善Fe-MOF的电催化性能。
为了考察在0.9 V处新出现的Fe-MOF(Fe-MIL-88-NH2)峰是铁离子还是配体2-氨基对苯二甲酸产生的,将配体溶解于灭菌水中(2 mg/mL),与壳聚糖混合滴在玻碳电极上,在PBS中进行DPV测试,结果见图5。在0.9 V处有一个氧化峰,说明图4中Fe-MOF的峰是2-氨基对苯二甲酸产生的。
3.3 氧化还原峰电流与扫描速度的关系
在含有5 mmol/L K3Fe(CN)6/K4Fe(CN)6和0.1 mol/L KCl 溶液中考察了扫描速度对免疫传感器电化学行为的影响。如图6所示,在20~140 mV/s范围内,随着扫描速度的增加,氧化还原峰电流增大,而且氧化还原峰电流值与扫描速度的平方根呈线性关系(图6内插图),说明传感器的电流受扩散控制,此电化学过程是可逆过程。
3.4 不同修饰电极界面的交流阻抗行为和循环伏安行为分析
在5 mmoL/L K3Fe(CN)6/K4Fe(CN)6和0.1 mol/L KCl 溶液中,采用电化学交流阻抗(EIS)和循环伏安法考察了不同电极修饰界面的电化学行为。图7A为不同修饰电极的电化学阻抗谱,内插图为EIS模型的等效电路图。等效电路包含Warburg阻抗(ZW)、电荷转移电阻(Rct,大小相当于高频区阻抗曲线的半圆直径)、溶液电阻(Rs,阻抗曲线的直线部分)和双层电容(Cd1)。理想情况下,Rs和Zw不受电极表面的影响,因为它们代表探针的扩散和溶液的特性[29]。
在图7A的阻抗谱中,曲线a为裸玻碳电极(GCE),接近一条直线,说明电子传递几乎没有阻碍,修饰Fe-MIL-88-NH2 /CHIT的玻碳电极由于覆盖了Fe-MIL-88-NH2和壳聚糖,阻碍了电子的传递,阻抗增加(Rct=1100 Ω)(图7A曲线b);修饰了AuNPs/Fe-MIL-88 NH2/CHIT的玻碳电极,
由于AuNPs比表面积大、催化效率高、传导电子的能力强,从而使电极阻抗值减小(Rct=600 Ω)(图7A曲线c);图7A曲线d为抗体固定在AuNPs/Fe-MIL-88 NH2/CHIT/GCE的Nyquist曲线,由于CRP抗原与CRP抗体的特异性结合,使得电极表面的传质阻力增大,阻抗值增加(Rct=1400 Ω);使用1%BSA封闭anti-CRP/AuNPs/Fe-MIL-88-NH2/CHIT/GCE电极表面的非特异性结合位点后,电极阻抗值进一步增加(Rct=1900 Ω)(图7A曲线e);在anti-CRP/AuNPs/Fe-MIL-88 NH2/CHIT/GCE孵育CRP抗原后,阻抗又进一步增加(Rct=4800 Ω)(图7A曲线f),说明抗原与抗体特异性结合后形成绝缘的免疫复合物,阻碍K3Fe(CN)6/K4Fe(CN)6电子传递。交流阻抗实验与循环伏安实验的結果一致,说明传感器构建成功。
图7B为不同电极的循环伏安曲线。裸GCE(图7B曲线a)呈现一对氧化还原峰,为探针[Fe(CN)6]3/4的电化学氧化还原峰;修饰Fe-MIL-88-NH2 /CHIT的GCE,电极的峰电流降低(图7B曲线b),说明Fe-MIL-88-NH2被很好地固定在电极表面,阻碍了电子的传递;在GCE 上修饰AuNPs/Fe-MIL-88 NH2/CHIT后,由于AuNPs比表面积大、催化效率高、传导电子的能力强,峰电流相应增加(图7B曲线c);进一步将抗体固定在AuNPs/Fe-MIL-88 NH2/CHIT/GCE上,由于CRP抗原与CRP抗体的特异性结合,阻碍了K3Fe(CN)6/K4Fe(CN)6的电子传递,峰电流值降低(图7B曲线d),也说明抗体被固定在电极表面;使用1%BSA封闭anti-CRP/AuNPs/Fe-MIL-88-NH2/CHIT/GCE电极表面的非特异性结合位点后,峰电流值进一步降低(图7B曲线e)。将anti-CRP/AuNPs/Fe-MIL-88 NH2/CHIT/GCE CRP与抗原孵育后,峰电流信号值最低(图7B曲线f),说明抗原与抗体特异性结合后形成绝缘的免疫复合物,阻碍K3Fe(CN)6/K4Fe(CN)6电子传递。这与循环伏安实验与交流阻抗实验的结果一致,说明传感器构建成功。
3.5 实验条件的优化
3.5.1 固定抗体浓度对免疫传感器的影响 考察了免疫传感器在不同固定抗体浓度(20、40、60、80和100 μg/mL)下的电流比值。由图8可见,传感器响应电流的比值随着固定抗体浓度的增加而变小,当抗体浓度为60 μg/mL时,响应电流的比值最小,之后响应电流又随固定抗体浓度的增加而增加。由于本实验为信号减小型,响应电流的比值最小时所对应的固定抗体浓度为最佳。因此,选择60 μg/mL作为本实验的最佳固定抗体浓度。
3.5.2 抗体培育时间对传感器响应电流比值的影响
在固定60 μg/mL抗体浓度和其它条件不变的情况下,改变抗体培育时间,通过测定K3Fe(CN)6/K4Fe(CN)6响应电流与Fe-MOFs(Fe-MIL-88 NH2)响应电流比值(IK3Fe(CN)6/K4Fe(CN)6/IMOFs)的大小,考察抗体培育时间对传感器响应电流的影响。由图9可见,随着抗体培育时间延长,响应电流的比值先减小后增加,在10 h时达到最小值。所以,最佳抗体培育时间选择10 h。
3.5.3 抗原培育时间对传感器电流的影响 固定60 μg/mL抗体浓度,抗体培育时间为10 h,在其它条件保持不变的情况下,改变抗原培育时间,通过测定K3Fe(CN)6/K4Fe(CN)6响应电流与Fe-MOFs(Fe-MIL-88 NH2)响应电流比值的大小,考察不同抗原培育时间对传感器的影响。由图10可知,随着抗原培育时间延长,响应电流的比值先增加后减小,在30 min时达到最小值后,响应电流的比值随培育时间的延长而变大。因此,最佳抗原培育时间选择30 min。
3.6 免疫传感器的校正曲线
在最佳实验条件下,测定电极对不同浓度的CRP抗原的响应信号,每个浓度平行测定3次。结果如图11所示,随着抗原浓度增加,K3Fe(CN)6/K4Fe(CN)6响应电流与Fe-MOFs响应电流的比值(IK3Fe(CN)6/K4Fe(CN)6/IMOFs)相应减小,且与CRP抗原浓度在1~200 ng/mL范围内呈线性关系,线性相关系数为0.9989,线性回归方程为IK3Fe(CN)6/K4Fe(CN)6/IMOFs=0.00559C+1.14714,检出限为0.3 ng/mL(3σ)。
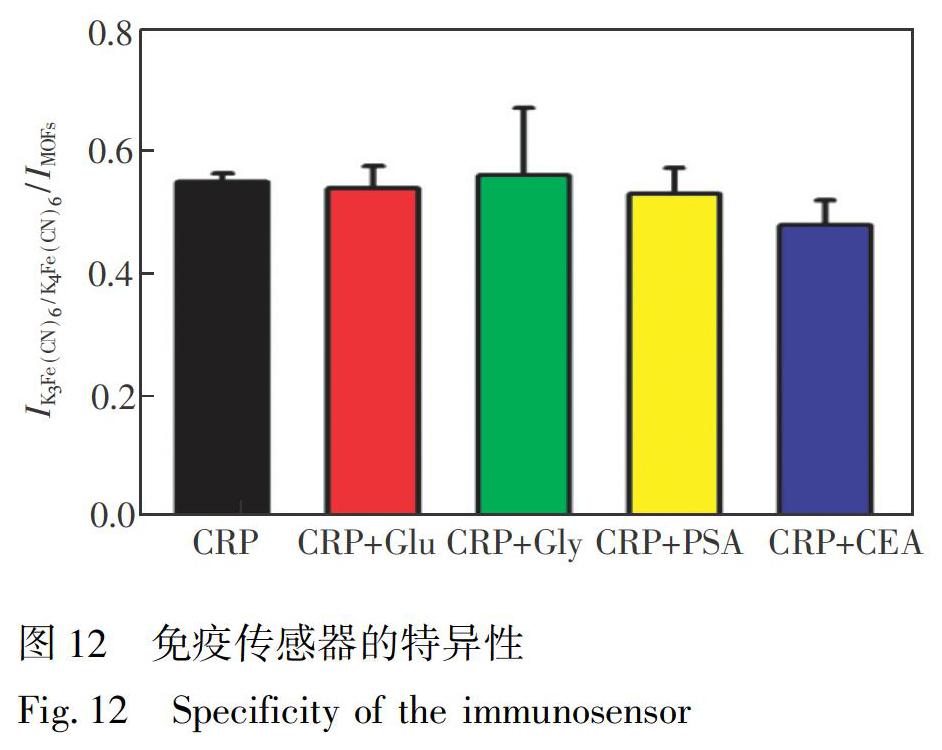
3.7 免疫传感器的特异性
为了研究此免疫传感器的特异性,将10 ng/mL CRP抗原分别与100 ng/mL谷氨酸(Glu)、甘氨酸(Gly)、前列腺特异性抗原(PSA)及癌胚抗原(CEA)按体积比1∶1混合。
然后,测量DPV响应电流,并与由CRP抗原产生的响应电流进行比较。由图12可知,10倍浓度的干扰物仅引起峰值电流的轻微变化,说明谷氨酸、甘氨酸、前列腺特异性抗原和癌胚抗原对CRP的检测几乎不造成干扰,表明此免疫传感器具有良好的选择性。
3.8 免疫传感器的稳定性和重复性
在5 mmol/L K3Fe(CN)6/K4Fe(CN)6和0.1 mol/L KCl溶液中,传感器在扫速0.1 V/s下,采用循环伏安法扫描200圈,电流保持原来的94.3%,使用3根电极平行测定3次,相对标准偏差为4.6%,长时间检测后未发现电流有明显改变,表明此纳米复合材料具有良好的稳定性。
3.9 加标回收实验
为考察所研制的传感器对实际样品的测试性能,采用标准加入法,在1%的血清中加入等体积不同浓度的CRP抗原,在最佳实验条件下,每个浓度平行测定3次,结果见表1,加标回收率分别为99.80%、99.92%、99.99%,说明此传感器对CRP的响应性能良好,可用于实际样品中CRP的测定。
4 结 论
基于比率探针,将内部参考探针(Fe-MOF-rP)和信号探针(K3Fe(CN)6/K4Fe(CN)6-sP)组合,形成比率探针,并将其用于构建集成的双信号非标记免疫传感器。与非比率传感器相比,比率型电化学传感器具有更高的准确度、灵敏度、稳定性和选择性。本研究使用AuNPs功能化的不规则的八面体形态的Fe-MOFs(Fe-MIL-88-NH2)作为固定基质,其在水溶液中具有高催化活性、高稳定性和良好的生物相容性,有利于生物分子的固定,并可以保持其生物活性。AuNPs/Fe-MIL-88-NH2复合材料作为电化学平台具有好的性能和較高的灵敏度,用于实际血清样品中CRP的测定,回收率令人满意。本研究提供了一种新的比率探针,可为临床上CRP的检测提供参考。
References
1 Thygesen K,Mair J,Katus H,Plebani M,Venge P,Collinson P. Eur. Heart J.,2010,31(18): 2197-2204
2 Thygesen K,Alpert J S,Jaffe A S,Simoons M L,Chaitman B R,White H D. J. Am. Coll. Cardiol.,2012,60(16): 1581-1598
3 Pereira J,Ribeiro A,Ferreira-Coimbra J,Barroso I,Guimaraes J T,Bettencourt P,Lourenco P. BMC Cardiovas. Disorders,2018,18(1): 40-47
4 Avan A,Sany S B T,Ghayour-Mobarhan M,Rahimi H R,Tajfard M,Ferns G. J. Cell Physiol.,2018,233(11): 8508-8525
5 Henderson P,Kennedy N A,Van Limbergen J E,Cameron F L,Satsangi J,Russell R K,Wilson D C. Inflamm. Bowel. Dis.,2015,21(3): 596-605
6 Erlinger T P,Platz E A,Rifai N,Helzlsouer K J. JAMA-J. Am. Med. Assoc.,2004,291(5): 585-590
7 Clyne B,Olshaker J S. J. Emerg. Med.,1999,17(6): 1019-1025
8 Eddaoudi M,Kim J,Rosi N,Vodak D,Wachter J,OKeeffe M,Yaghi O M. Science,2002,295(5554): 469-472
9 Davydovskaya P,Ranft A,Lotsch B V. Anal. Chem.,2014,86(14): 6948-6958
10 Yu L Q,Yan X P. Chem. Commun.,2013,49(21): 2142-2144
11 Wang H,Wang Q,Teat S J,Olson D H. Cryst. Growth Des.,2017,17(4): 2034-2040
12 Gassensmith J J,Furukawa H,Smaldone R A,Forgan R S,Botros Y Y,Yaghi O M,Stoddart J F. J. Am. Chem. Soc.,2011,133(39): 15312-15315
13 BAI Jing,LIN Zi-An. Chinese Journal of Chromatography,2019,37(12): 1251-1260
白 璟,林子俺. 色谱,2019,37(12): 1251-1260
14 Lian X,Huang Y,Zhu Y,Fang Y,Zhao R,Joseh E,Li J L,Pellois J P,Zhou H C. Angew. Chem. Int. Edit.,2018,57(20): 5725-5730
15 Kuppler R J,Timmons D J,Fang Q R,Li J R,Makal T A,Young M D,Yuan D Q,Zhao D,Zhuang W J,Zhou H C. Chem. Rev.,2009,253(23): 3042-3066
16 Imaz I,Molina D R,Hernando J,Puntes V,Maspoch D. Chem. Commun.,2010,46(26): 4737-4739
17 Zhu X,Zheng H Y,Wei X F,Lin Z Y,Guo L H,Qiu B,Chen G N. Chem. Commun.,2013,49(13): 1276-1278
18 Liu Y L,Zhao X J,Yang X X,Li Y F. Analyst,2013,138(16): 4526-4531
19 Ricci F,Plaxco K W. Microchim. Acta,2008,163(3-4): 149-155
20 Deng C,Pi X,Qian P,Chen X,Wu W,Xiang J. Anal. Chem.,2016,89(1): 966-973
21 Du Y,Lim B,Li B,Jiang Y,Sessler J L. Anal. Chem.,2014,86(15): 8010-8016
22 Ren K,Wu J,Yan F,Zhang Y,Ju H. Biosens. Bioelectron.,2015,66: 345-349
23 Springer T,Bocková M,Homola J. Anal. Chem.,2013,85(12): 5637-5640
24 Yan X,Li H,Han X,Su X. Biosens. Bioelectron.,2015,74: 277-283
25 Shen W J,Zhuo Y,Chai Y,Yuan R. Anal. Chem.,2015,87(22): 11345-11352
26 Taylor-Pashow K M L,Della Rocca J,Xie Z,Tran S,Lin W B. J. Am. Chem. Soc.,2009,131(40): 14261-14263
27 Frens G. Nature,1973,241(105): 20-22
28 Huang H Z,Ran P X,Liu Z G. Bioelectrochemistry,2007,70(2): 257-262
