基于DNA四面体的微流控芯片用于致病性大肠杆菌O157∶H7的检测
2020-05-19朱福琳卞晓军田润李亮颜娟刘刚
朱福琳 卞晓军 田润 李亮 颜娟 刘刚

摘 要 设计了一种微流控芯片,在其通道表面修饰DNA四面体,并通过生物素-链霉亲和素反应连接适配体作为捕获探针,用于大肠杆菌O157∶H7(Escherichia coli O157∶H7,E.coli O157∶H7)的检测研究。微流控芯片鱼骨形结构的设计降低了细菌捕获时受到的剪切力;在其表面修饰DNA四面体,可进一步调节探针之间的距离,提高探针对细菌的识别效率。琼脂糖凝胶电泳表征结果证实了DNA四面体纳米结构的成功制备和DNA四面体-适配体捕获体系的构建。采用荧光显微镜对检测结果进行进一步成像分析,并将此微流控芯片检测平台用于实际样品的检测。结果表明,不需要大型仪器或设备及其它信号放大技术的辅助,在普通光学显微镜下,利用此检测系统即能实现浓度为10 CFU/mL的E.coli O157∶H7的检测,且操作简便,检测耗时少于2 h。实际样品的检测回收率为88.3%~108.3%。本研究基于DNA四面体纳米结构构建的微流控平台,不仅为食源性致病菌的检测提供了一种有效的检测方法,在其它食品安全隐患、疾病早期诊断等研究领域也具有潜在应用价值。
关键词 DNA四面体;微流控芯片;适配体;大肠杆菌O157∶H7
1 引 言
食品安全是全世界共同关注的公共卫生问题,近年来,由于微生物引起的食源性疾病在食品安全事件中的比例不断上升,对人类健康和生命安全构成了严重的威胁[1]。这些致病微生物在食物中生存生长和代谢导致食物变质,而一些致病菌分泌有毒物质,直接或间接导致疾病。常见的食源性致病菌有金黄色葡萄球菌(Staphylococcus aureus,S. aureus)、鼠伤寒沙门氏菌(Salmonella typhimurium,S. typhimurium)、大肠杆菌(Escherichia coli,E.coli)等[2]。食源性疾病的预防与控制已引起了世界各国关注,在工业环境、临床和医学诊断、水和环境质量控制,以及在资源有限的环境中快速检测致病菌对于减少食品和水传播疾病的爆发至关重要[3]。目前,快速检测食源性致病菌的方法主要有免疫学方法和分子生物学检测,如酶联免疫吸附法(Enzyme-linked immunosorbent assay,ELISA)[4,5]、聚合酶链式反应(Polymerase chain reaction,PCR)等[6,7]。然而,这些方法也有自身的局限性,如检测耗时长、灵敏度低、易出现假阳性或假阴性结果;有的则需要大型仪器设备、昂贵的试剂和专业操作人员,其应用范围受到限制。
近年来,各种生物传感器,包括电化学传感器[8~10]、比色传感器[11~13]等,特别是基于适配体(Aptamer)的生物传感器,已被开发用于致病菌的检测[14~16]。寡核苷酸适配体是通过体外选择技术(即指数富集的配体系统进化技术(Systematic evolution of ligands by exponential enrichment,SELEX))筛选出来的对靶标具有特异性的单链寡核苷酸[17],与抗原抗体相比,适配体具有更高的生物稳定性[18,19]。Fang等[20]提出了一种简单灵敏的基于适配体的生物传感器,用于快速检测肠道沙门氏菌(Salmonella enteritidis,S. enteritidis)。此方法避免了繁琐的DNA提取和纯化过程,大大减少了基于传统DNA扩增法导致假阳性结果的出现概率,为传统方法提供了简便、快速的替代方法。然而,这些方法需要复杂的样品预处理过程,仍具有明显的应用局限性。
微流控平台作为一种生物传感器,在微米尺度通道内对液体进行操纵和控制[21]。相对于现有技术的缺陷,微流控芯片技术以其高度的集成化、微型化、分析速度快、准确度高、成本低等特点而受到广泛关注[22~24]。如Wang等[25]提出基于磁珠的微流控芯片用于耐甲氧基西林S. aureus的检测,此方法将核酸提取和目标核酸的等温扩增集成到一张基于磁珠的微流控芯片中,能与S. aureus的DNA相结合的核酸片段连接在磁珠上作为捕获DNA的工具,检测成本低,分析时间短。但是,由于磁珠的不透明性,无法在芯片内检测反应结果,只能通过离心后测OD值或者电泳判定反应结果,实用性不强。因此,合理设计具有理想识别效率和灵敏度的生物传感器一直是生物检测领域,特别是微流控平台面临的关键挑战。
近年来,基于DNA纳米技术已经发展出许多具有良好生物相容性的新型DNA纳米结构,如DNA自组装制备的DNA四面体[26~28]。DNA四面体是一种具有良好刚性的DNA三维结构,有效提高了DNA探針在表面分布排列的均一性,实现了DNA探针之间距离的精确调控,提高了生物检测的灵敏性和特异性[29~32]。目前,已有研究提出基于DNA四面体纳米结构功能化的微通道用于快速、灵敏的重金属离子的检测[33],DNA四面体的存在增强了分子间的相互作用,提高了其探针的识别能力。但是,基于DNA四面体的微流控芯片用于细菌检测的研究较少。本研究基于DNA四面体的微流控系统,提出了检测致病菌的方法。E.coli O157∶H7是一种广泛存在于环境、食品、人和动物中的致病性革兰氏阴性菌,并且已经有筛选出的具有高亲和力的DNA适配体[34,35]。将丙烯酰胺修饰的DNA四面体通过迈克尔加成反应固定在聚二甲氧基硅氧烷(Polydimethylsiloxane,PDMS)微通道的表面[36],为特异性的DNA探针提供了刚性支架。为了提高识别效率,微通道中还设计了鱼骨形结构的图案,增加特异性的适配体与目标细菌的生物识别几率。在最佳条件下,此基于DNA四面体的微流控平台可显著提高E.coli O157∶H7的检测灵敏度,为食品安全领域中食源性致病菌的检测提供了一种新方法,同时也为新型DNA纳米结构在生物传感器制备、生物分析等研究领域的应用提供了新思路。
2 实验部分
2.1 仪器与试剂
UV-2540紫外可见分光光度计(日本岛津公司);FS-5荧光分光光度计(英国爱丁堡仪器公司);琼脂糖凝胶成像系统(美国Bio-Rad公司);生物快速原子力显微镜(美国Bio-FastScan公司);BPZ-6063LC真空干燥箱(上海一恒科学仪器有限公司);PDC-MG型等离子体清洗机(成都铭恒科技发展有限公司);CKX-41倒置荧光显微镜(日本奥林巴斯公司)。
DNA由上海生工生物工程有限公司合成纯化,序列见表1;PDMS预聚体(美国Dow Coming公司);3-甲氧基巯基丙基硅烷(Methoxy mercaptopropyl silane,MPS,美国Sigma-Aldrich公司);牛血清蛋白(Bovine serum albumin,BSA,美国Amresco公司);10×TM缓冲液(500 mmol/L Tris-HCI,80 mmol/L Mg2SO4,pH 7.5)、50×TAE缓冲液(2 mol/L Tris-acetic acid;100 mmol/L EDTA,pH 8.4)、琼脂糖III(TM)、4S Red Plus核酸凝胶染色剂(10000×,0.1 mL)、链霉亲和素(Streptavidin),磷酸盐缓冲液(Phosphate buffer saline,PBS,20×,pH 7.4)、LB肉汤培养基(LB broth powder)、營养琼脂(Nutrient agar)均购自上海生工生物工程有限公司;SYTO 9绿色荧光核酸染料(SYTO 9 Green,美国赛默飞公司)。 实验用的细菌包括E.coli O157∶H7(ATCC 43889)、大肠杆菌O6(E.coli O6,ATCC 25922)、李斯特菌(Listeria monocytogenes,L. monocytogenes,ATCC 19115)、S. aureus(,ATCC 25923),以及S. typhimurium(ATCC 19585),均购自美国菌种保藏中心(American Type Culture Collection,ATCC)。 所用化学试剂至少为分析纯,实验用水均为超纯水。
2.2 实验方法
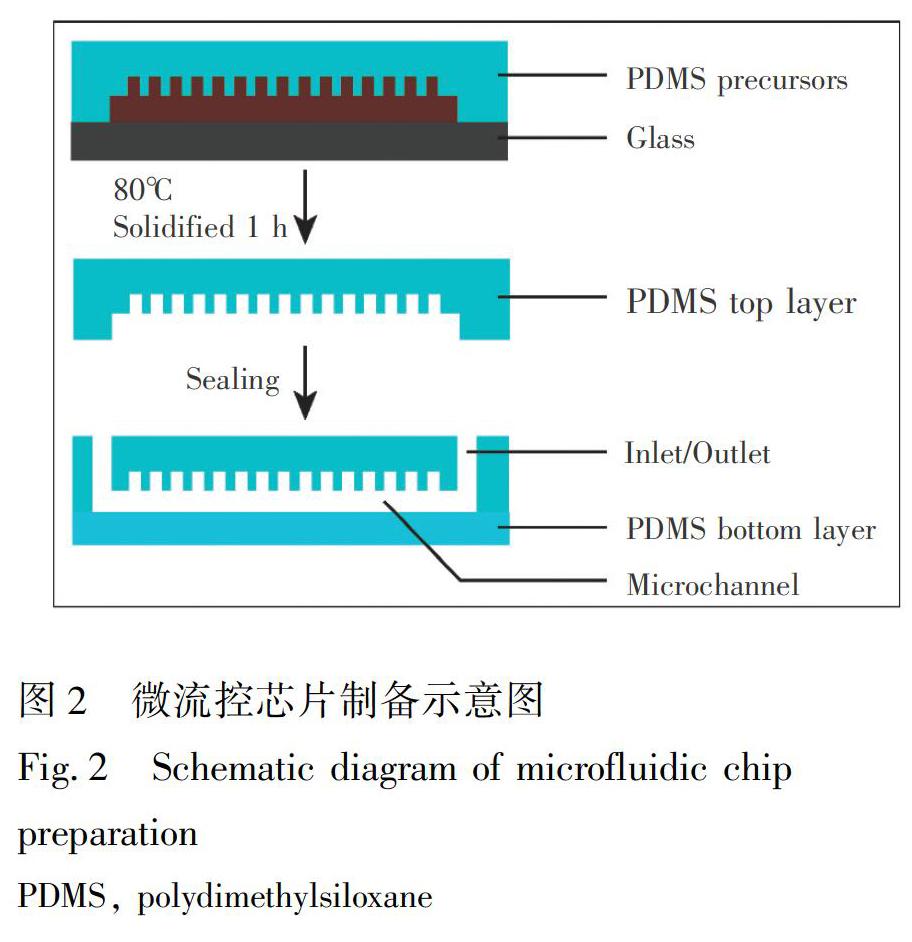
2.2.1 微流控芯片的设计和制备 本实验设计的微流控芯片如图1A所示,根据微流控芯片的设计采用SU-8负性光刻法制作了模具[37],利用模具制作成PDMS芯片,具体制作过程如图2所示,首先,将模具放在培养皿中,将PDMS单体和固化剂按照质量比10∶1搅拌混匀,倒在SU-8模具上,然后将培养皿水平放置在真空干燥器内,通过抽真空除尽气泡,确保体系内没有气泡之后放在恒温真空干燥箱中,80℃固化1 h。将固化后的PDMS从模具上剥离,打孔,切割整齐。将清洁后的此层PDMS与空白PDMS经氧等离子体清洗机处理后贴合在一起,进行永久性封接,形成具有密封通道的完整的PDMS芯片,完成微流控设备的制作。PDMS芯片通道内依次用无水乙醇、超纯水冲洗后,备用。
2.2.2 DNA四面体纳米结构的制备 按文献[38]报道的方法,用4条DNA链自组装合成DNA四面体。首先,用超纯水溶解丙烯酰胺修饰的DNA单链,DNA单链溶液的浓度通过测定其在260 nm处的紫外吸收值进行定量分析,然后将4条DNA单链溶液按1∶1∶1∶1的比例混合于1×TM 缓冲液中,每条DNA单链的终浓度均为1 μmol/L。混合均匀后,置于PCR仪中,按照设定好的程序95℃保持10 min,然后迅速降温至4℃,保持25 min,得到浓度为1 μmol/L的DNA四面体,并通过琼脂糖凝胶电泳和原子力显微镜(Atomic force microscopy,AFM)进行表征。DNA四面体于4℃保存,备用。
2.2.3 PDMS芯片表面的改性 将制备的PDMS芯片用无水乙醇清洗3次,加入20 μL 2% (V/V)无水乙醇配制的MPS溶液,室温反应0.5 h,反应完成后将剩余溶液抽干,用无水乙醇和PBS(1×,pH 7.4)分别清洗3次,成功将巯基修饰在PDMS通道表面。加入20 μL丙烯酰胺修饰的DNA四面体(0.1 μmol/L)室温反应2 h,反应完成后抽干剩余溶液,用 PBS(1×,pH 7.4)冲洗3次,成功将DNA四面体固定在PDMS通道表面。为了减少PDMS芯片表面的非特异性吸附位点,加入1% BSA溶液37℃孵育2 h进行封闭,用 PBS(1×,pH 7.4)冲洗,加入链霉亲和素溶液(0.5 μmol/L )孵育。最后,加入生物素标记的大肠杆菌适配体(Biotin-aptamer)溶液(1 μmol/L),通过生物素-链霉亲和素反应连接到DNA四面体修饰的PDMS表面,反应完成后,用 PBS(1×,pH 7.4)冲洗3次,洗去未反应的适配体,得到修饰有DNA四面体- Streptavidin-Aptamer结构的PDMS芯片。
2.2.4 E.coli O157∶H7的捕获 E.coliO157∶H7首先用SYTO 9绿色荧光核酸染料(SYTO 9 Green)标记(200 r/min,37℃),然后将E.coli O157∶H7细胞悬浮液稀释到101~105 CFU/mL,分别注入到修饰后的PDMS芯片通道内,37℃孵育2 h。E.coli O157∶H7细胞被适配体特异性捕获后,加入PBS(1×,pH 7.4)洗去未被捕获的E.coli O157∶H7细胞,重复洗涤3次,用CKX-41倒置荧光显微镜观察成像。
3 结果与讨论
3.1 微流控芯片的设计和制备
微流控芯片的设计包含有6个相同的结构单元,呈环形阵列排布,每个结构单元为独立的“蛇形”微通道[39],通道包含有鱼骨形结构,此结构的设计基于诱导溶液低雷诺数(Re)条件下混合的策略[40],与传统的直通道微流控装置相比,鱼骨形图案诱导通道内流动的液体产生涡流,打破了流体的层流状态,有利于流体在微通道内均匀混合,增加了细菌细胞在捕获过程中与不同壁面的Aptamer的生物识别几率,降低了其所受的剪切力,从而降低了细菌在捕获过程中的损伤。
3.2 基于Aptamer-Streptavidin-DNA四面体纳米结构的细菌捕获系统的构建
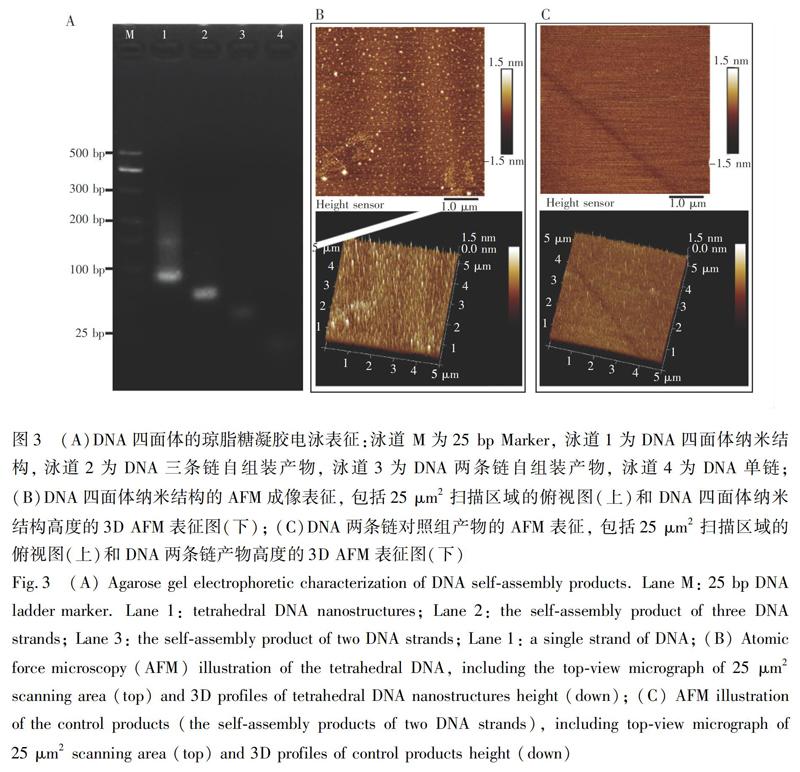
生物素标记的Aptamer通过生物素-链霉亲和素连接到DNA四面体上,此过程对后续细菌的特异性捕獲至关重要。DNA四面体结构的制备通过琼脂糖凝胶电泳和AFM成像进行表征。如图3A所示,琼脂糖凝胶电泳图中,泳道1、2、3、4分别为DNA四条链组合、三条链组合、两条链组合和单链经过相同条件的热变性得到的产物。随着参与自组装的DNA链的增加,制备得到产物的迁移速率减慢。泳道1是四条DNA链组装形成的DNA四面体纳米结构,因其碱基数最多,迁移速率也最慢,并且只在上游出现了微弱的杂带,这与之前报道的结果一致[41],说明DNA四面体的合成率较高。如图3B所示,实验组AFM图像的视野范围内出现了大量相似且相对独立的纳米结构,高度约3 nm;而在对照组中,由两条DNA链自组装形成的产物大部分平铺在表面(图3C),可进一步确定DNA四面体纳米结构的成功制备。
优化了Aptamer-Streptavidin-DNA四面体纳米结构中DNA四面体和链霉亲和素的结合比例,并通过琼脂糖凝胶电泳进行表征。如图4A所示,随着链霉亲和素用量的增加,产物的分子量也在增加,说明生成了更多的Streptavidin-DNA四面体产物。利用琼脂糖凝胶电泳进一步表征了Aptamer-Streptavidin-DNA四面体结构的细菌捕获系统的构建,如图4B所示,Streptavidin-DNA四面体(泳道5)和Aptamer-Streptavidin(泳道6)复合物与没有连接链霉亲和素的单独的DNA四面体(泳道1)和Aptamer(泳道2)相比,由于连接链霉亲和素之后的产物分子量增加,条带位置显著不同。此外,泳道6和泳道7相比,泳道6中存在游离的生物素标记的Aptamer,而泳道7中没有,说明Aptamer与Streptavidin-DNA四面体复合物结合,并在泳道7样品孔处出现明显的Aptamer-Streptavidin-DNA四面体复合物的条带。
3.3 基于Aptamer-Streptavidin-DNA四面体结构的微流控芯片用于E.coliO157∶H7的检测分析
在设计DNA四面体的序列时,DNA四面体的1个顶点标记了生物素,其它3个顶点分别标记了丙烯酰胺基团。因此,DNA四面体纳米结构可通过迈克尔加成反应固定在巯基修饰的PDMS表面。如图5所示,具有鱼骨型图案的微通道采用1% BSA溶液进行封闭后,单独注入Cy3标记的链霉亲和素(Cy3-Streptavidin)进行孵育(图5A),微通道内无明显的荧光信号,向微通道中注入顶点没有标记丙烯酰胺基团的DNA四面体,与Cy3-Streptavidin孵育也产生了类似的结果(图5B)。只有注入顶点标记丙烯酰胺基团的DNA四面体并通过迈克尔加成反应牢牢固定在PDMS表面,再与Cy3-Streptavidin孵育后产生了明显的荧光信号(图5C)。3种方式产生的荧光信号的强度比较也进一步说明,采用BSA封闭处理微通道可有效降低非特异性吸附产生的背景(图5),链霉亲和素可特异性地与固定在PDMS表面的DNA四面体结合。
进一步验证了基于Aptamer-Streptavidin-DNA四面体结构的检测系统对E.coli O157∶H7的特异性识别能力。绿色荧光核酸染料SYTO 9 用于E.coli O157∶H7的染色;红色荧光染料Cy3标记于适配体序列。当具备此捕获系统的微流控芯片完成E.coliO157∶H7的捕获后(细菌浓度为105 CFU/mL),荧光显微镜进行荧光观察、成像,结果如图6所示。图6A中绿色荧光表明利用此芯片可实现E.coliO157∶H7的成功捕获;图6B红色荧光则为同一视野下,Aptamer-Streptavidin-DNA四面体结构所在位置;两者的叠加结果见图6C,表明Cy3-Aptamer-Streptavidin-DNA四面体结构产生的红色荧光信号与同一视野下绿色荧光标记的E.coli O157∶H7细胞的分布一致。此数据充分验证了基于Aptamer-Streptavidin-DNA四面体结构的微流控系统对E.coli O157∶H7细胞的良好特异识别能力和捕获能力。
灵敏度和检测限是影响微流控捕获系统的关键参数。采用此微流控芯片装置检测不同浓度的E.coli O157∶H7,结果如图7中A1~A5所示,随着E.coliO157∶H7细胞浓度增加,普通光学显微镜下即可观察到细菌数量也随之增加,当浓度为10 CFU/mL时,仍然可观察到1~2个E.coliO157∶H7细胞(图7A5)。图7中B1~B5为相应的荧光成像结果。为了进一步验证此微流控芯片装置的检测性能,在不修饰DNA四面体纳米结构的基础上,向PDMS芯片内直接注入标记丙烯酰胺基团的Aptamer,用于不同浓度的E.coliO157∶H7细胞浓度的检测。对比两种检测模式所得荧光信号的相对强度可知,基于DNA四面体纳米结构的微流控装置的检测信号明显高于基于单链Aptamer修饰的微流控装置的检测信号(图7C),信号强度最高增加了约30倍(105 CFU/mL浓度下两种检测方法的信号强度对比)。进一步分析发现,基于DNA四面体检测模式的E.coliO157∶H7细胞的相对荧光检测信号强度与此菌浓度在101~105 CFU/mL范围内呈现良好的线性关系(图7D)。
以上结果表明,在无其它信号放大技术辅助的条件下,仅通过DNA四面体纳米结构与微流控的整合,即可实现浓度为10 CFU/mL的E.coliO157∶H7的检测灵敏度。DNA四面体纳米结构的优点已在许多文献中报道[42~45],例如,为了解决固定在底物表面的单链DNA探针容易相互缠绕、聚集等难题,通过改变DNA四面体的大小,在纳米尺度上精确调控DNA探针之间的横向距离。本研究采用的DNA四面体的每条边包含13个碱基对,长度l ≈ 4.42 nm,假设修饰在PDMS芯片表面的DNA四面体紧密排列,则DNA四面体紧密排列在边长L=1 cm的正方形面积上的密度为5.12×1012/cm2,计算公式如下,S表示边长L=1 cm正方形的面积:
DNA四面體纳米结构的存在缩短了识别时间,提高了识别效率,从而提高了此微流控平台检测细菌的灵敏度。回收实验进一步验证了此检测系统的可靠性。将不同浓度的E.coliO157∶H7细胞添加到空白样品(橙汁)中,依照2.2.4节的方法,在此微流控芯片细菌捕获系统中进行检测,并通过荧光信号强度计算回收率,结果如表2所示,回收此外,选择浓度为103 CFU/mL的E.coliO157∶H7细菌悬液与其它4种细菌,包括E.coli O6、S. typhimurium、S. aureus、L. monocytogenes,对基于Aptamer- Streptavidin-DNA四面体纳米结构的细菌检测系统的特异性进行了研究。如图8所示,非特异性细菌的浓度是E.coliO157∶H7浓度的100倍时,与E.coliO157∶H7产生的信号强度相比,也可忽略不计。此结果进一步说明了基于Aptamer-Streptavidin-DNA四面体纳米结构的微流控检测系统不仅具有较高的灵敏度,而且具有很好的选择性。
4 结 论
构建了一种基于Aptamer-Streptavidin-DNA四面体纳米结构的微流控检测系统,并成功实现了E.coli O157∶H7的高灵敏检测,可检测细菌浓度低至10 CFU/mL。与现有的细菌检测方法相比,本方法具有以下优点: DNA四面体纳米结构的存在可精确调控了Aptamer之间的距离,为细菌细胞检测提供了理想的生物识别效率和灵敏度; DNA四面体与PDMS芯片通道内鱼骨形图案的设计,在提高细菌细胞与特异性适配体的识别几率的同时,也降低了细菌在捕获过程中受到的剪切力,减少了细胞损伤;不需要大型仪器或设备,不需要额外信号放大技术辅助,也不需要繁琐的DNA提取或纯化步骤,操作过程简单,成本较低。本研究不仅为食源性致病微生物的检测提供了一种特异性强、灵敏度高、操作简便的有效方法,同时,微流控芯片6个独立通道单元的设计可通过修饰不同的适配体进行功能化,实现不同目标物的检测,在食品安全、公共卫生安全、临床医学等研究领域中具有良好的应用前景。
References
1 Bush K,Courvalin P,Dantas G,Davies J,Eisenstein B,Huovinen P,Jacoby G A,Kishony R,Kreiswirth B N,Kutter E,Lerner S A,Levy S,Lewis K,Lomovskaya O,Miller J H,Mobashery S,Piddock L J,Projan S,Thomas C M,Tomasz A,Tulkens P M,Walsh T R,Watson J D,Witkowski J,Witte W,Wright G,Yeh P,Zgurskaya H I. Nat. Rev. Microbiol.,2011,9(12): 894-896
2 Tsuchido Y,Horiuchi R,Hashimoto T,Ishihara K,Kanzawa N,Hayashita T. Anal. Chem.,2019,91(6): 3929-3935
3 Chen J,Andler S M,Goddard J M,Nugen S R,Rotello V M. Chem. Soc. Rev.,2017,46(5): 1272-1283
4 Wang C,Xing K,Zhang G,Yuan M,Xu S,Liu D,Chen W,Peng J,Hu S,Lai W H. Food Chem.,2019,281: 91-96
5 Guo Q,Han J J,Shan S,Liu D F,Wu S S,Xiong Y H,Lai W H. Biosens. Bioelectron.,2016,86: 990-995
6 Cho B,Lee S H,Song J,Bhattacharjee S,Feng J,Hong S,Song M,Kim W,Lee J,Bang D,Wang B,Riley L W,Lee L P. ACS Nano,2019,13(12): 13866-13874
7 Rajapaksha P,Elbourne A,Gangadoo S,Brown R,Cozzolino D,Chapman J. Analyst,2019,144(2): 396-411
8 Nodoushan S M,Nasirizadeh N,Amani J,Halabian R,Fooladi A A I. Biosens. Bioelectron.,2019,127: 221-228
9 Kim Y S,Chung J,Song M Y,Jurng J,Kim B C. Biosens. Bioelectron.,2014,54: 195-198
10 Guo Y,Wang Y,Liu S,Yu J,Wang H,Wang Y,Huang J. Biosens. Bioelectron.,2016,75: 315-319
11 Thiramanas R,Laocharoensuk R. Microchim. Acta,2015,183(1): 389-396
12 Bayrac C,Eyidogan F,Avni Oktem H. Biosens. Bioelectron.,2017,98: 22-28
13 Raston N H A,Nguyen V T,Gu M B. Biosens. Bioelectron.,2017,93: 21-25
14 Nemr C R,Smith S J,Liu W,Mepham A H,Mohamadi R M,Labib M,Kelley S O. Anal. Chem.,2019,91(4): 2847-2853
15 Dickey D D,Giangrande P H. Methods,2016,97: 94-103
16 Lin X,Chen Q,Liu W,Yi L,Li H,Wang Z,Lin J M. Biosens. Bioelectron.,2015,63: 105-111
17 Reinholt S J,Craighead H G. Anal. Chem.,2018,90(4): 2601-2608
18 Li M,Guo X,Li H,Zuo X,Hao R,Song H,Aldalbahi A,Ge Z,Li J,Li Q,Song S,Li S,Shao N,Fan C,Wang L. ACS Appl. Mater. Interfaces,2018,10(1): 341-349
19 Zhang H,Ma X,Liu Y,Duan N,Wu S,Wang Z,Xu B. Biosens. Bioelectron.,2015,74: 872-877
20 Fang Z,Wu W,Lu X,Zeng L. Biosens. Bioelectron.,2014,56: 192-197
21 Mehling M,Tay S. Curr. Opin. Biotechnol.,2014,25: 95-102
22 Huang W,Chang C L,Brault N D,Gur O,Wang Z,Jalal S I,Low P S,Ratliff T L,Pili R,Savran C A. Lab Chip,2017,17(3): 415-428
23 Chen Q,Wu J,Zhang Y,Lin Z,Lin J M. Lab Chip,2012,12(24): 5180-5185
24 WANG Zhi-Le,WANG Zhu-Yuan,ZONG Shen-Fei,CUI Yi-Ping. Chinese Optics,2018,11(3): 513-530
王志樂,王著元,宗慎飞,崔一平. 中国光学,2018,11(3): 513-530
25 Wang C H,Lien K Y,Wu J J,Lee G B. Lab Chip,2011,11(8): 1521-1531
26 Lin Y,Jia J,Yang R,Chen D,Wang J,Luo F,Guo L,Qiu B,Lin Z. Anal. Chem.,2019,91(5): 3717-3724
27 Xiao M,Lai W,Man T,Chang B,Li L,Chandrasekaran A R,Pei H. Chem. Rev.,2019,119(22): 11631-11717
28 Zhu B,Wang L,Li J,Fan C. Chem. Rec.,2017,17(12): 1213-1230
29 Zhang Y,Tu J,Wang D,Zhu H,Maity S K,Qu X,Bogaert B,Pei H,Zhang H. Adv. Mater.,2018,30(24): e1703658
30 Wang D,Chai Y,Yuan Y,Yuan R. Anal. Chem.,2019,91(5): 3561-3566
31 Dong S,Zhao R,Zhu J,Lu X,Li Y,Qiu S,Jia L,Jiao X,Song S,Fan C,Hao R,Song H. ACS Appl. Mater. Interfaces,2015,7(16): 8834-8842
32 Zhu D,Pei H,Yao G,Wang L,Su S,Chao J,Wang L,Aldalbahi A,Song S,Shi J,Hu J,Fan C,Zuo X. Adv. Mater.,2016,28(32): 6860-6865
33 Qu X,Yang F,Chen H,Li J,Zhang H,Zhang G,Li L,Wang L,Song S,Tian Y,Pei H. ACS Appl. Mater. Interfaces,2017,9(19): 16026-16034
34 Jiang Y,Zou S,Cao X. Sens. Actuators B,2017,251: 976-984
35 Diaz-Amaya S,Lin L K,Deering A J,Stanciu L A. Anal. Chim. Acta,2019,1081: 146-156
36 Liu D,Perdue R K,Sun L,Crooks R M. Langmuir,2004,20(14): 5905-5910
37 Stott S L,Hsu C H,Tsukrov D I,Yu M,Miyamoto D T,Waltman B A,Rothenberg S M,Shah A M,Smas M E,Korir G K,Floyd F P,Jr,Gilman A J,Lord J B,Winokur D,Springer S,Irimia D,Nagrath S,Sequist L V,Lee R J,Isselbacher K J,Maheswaran S,Haber D A,Toner M. Proc. Natl. Acad. Sci. USA,2010,107(43): 18392-18397
38 Goodman R P,Berry R M,Turberfield A J. Chem. Commun.,2004,12: 1372-1373
39 Hou S,Zhao H,Zhao L,Shen Q,Wei K S,Suh D Y,Nakao A,Garcia M A,Song M,Lee T,Xiong B,Luo S C,Tseng H R,Yu H H. Adv. Mater.,2013,25(11): 1547-1551
40 Forbes T P,Kralj J G. Lab Chip,2012,12(15): 2634-2637
41 Lin M,Wang J,Zhou G,Wang J,Wu N,Lu J,Gao J,Chen X,Shi J,Zuo X,Fan C. Angew. Chem. Int. Ed.,2015,54(7): 2151-2155
42 Li W,Jiang W,Ding Y,Wang L. Biosens. Bioelectron.,2015,71: 401-406
43 Wang J P,Leong M C,Leong E Z W,Sen Kuan W,Leong D T. Anal. Chem.,2017,89(12): 6900-6906
44 Wen Y,Pei H,Wan Y,Su Y,Huang Q,Song S,Fan C. Anal. Chem.,2011,83(19): 7418-7423
45 Wang L,Wen Y,Li L,Yang X,Jia N,Li W,Meng J,Duan M,Sun X,Liu G. Biosens. Bioelectron.,2018,115: 91-96
