基于p38丝裂原活化蛋白激酶通路的胰高血糖素样肽-1对大鼠脑缺血再灌注损伤的影响及机制
2020-05-18张军艳樊玉香栗延伟朱红灿
张军艳,樊玉香,栗延伟,朱红灿
急性脑梗死是临床常见的脑血管疾病。随着近年来肥胖、高脂血症、糖尿病等代谢性疾病的增多,本病的发病率也呈逐年升高趋势。早期再灌注治疗能够及时再通闭塞血管、恢复缺血脑组织血流灌注,进而减轻缺血缺氧对神经功能的损害[1-3]。但是,脑组织在经历缺血再灌注(I/R)的过程中,p38丝裂原活化蛋白激酶(p38MAPK)通路过度激活所介导的炎症反应和氧化应激反应会加剧神经元凋亡,进而加重脑组织的损伤,该过程又被称为I/R损伤[4-5]。因此,抑制p38MAPK通路所介导的炎症反应和氧化应激反应是减轻I/R损伤、改善急性脑梗死再灌注治疗效果的潜在靶点。
胰高血糖素样肽-1(GLP-1)是由肠道L细胞分泌的具有降糖活性的多肽。利拉鲁肽是GLP-1类似物,目前被用于2型糖尿病患者的降糖治疗。近年来GLP-1生物学活性研究发现,GLP-1不仅具有降糖作用,还能在多种组织和细胞内发挥保护作用[6-7]。动物研究证实,GLP-1类似物利拉鲁肽能够减轻高同型半胱氨酸诱导的海马神经元炎症及氧化应激损伤,提示利拉鲁肽对神经元具有保护作用[8]。基于此,本研究将GLP-1类似物利拉鲁肽用于大鼠脑缺血再灌注损伤的干预,从p38MAPK通路介导的炎症反应及氧化应激分析利拉鲁肽对大鼠脑缺血再灌注损伤的影响及机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级别的雄性SD大鼠,体质量200~240 g,购买于上海斯莱克实验动物有限公司,动物许可证号SCXK(沪)2017-0005。将大鼠分为假手术组、模型组、GLP-1组、p38MAPK抑制剂组,每组12只。
1.1.2 实验试剂 利拉鲁肽注射液购自诺和诺德公司,p38MAPK抑制剂SB2020190购自Sigma公司,p38、JNK、ERK1/2的单克隆抗体购自Abcam公司,ELISA试剂盒购自上海西唐公司,活性氧(ROS)检测试剂盒购自上海碧云天公司,丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPx)检测试剂盒购自南京建成公司。
1.2 方法
1.2.1 分组及造模方法 模型组、GLP-1组、p38MAPK抑制剂组按照下列方法建立脑I/R损伤模型:大鼠用10%水合氯醛麻醉后摆放仰卧位,连接小动物呼吸机后做颈正中切口,分离右侧颈总动脉、颈内动脉、颈外动脉,颈外动脉分叉处结扎,颈内动脉分叉处绕线但暂不结扎。在绕线远端做一小切口,将尼龙线栓插入至大脑中动脉,栓线的血管外部分结扎固定,缺血2 h后取出线栓完成再灌注。假手术组按照相同的方法进行麻醉及颈动脉血管分离的操作,但不插入线栓。
1.2.2 给药方法 GLP-1组大鼠在再灌注前30 min给予利拉鲁肽皮下注射(70 μg/kg),再灌注后每天给予70 μg/kg的利拉鲁肽皮下注射,连续7 d。p38MAPK抑制剂组在再灌注前30 min时将5 μl浓度为10 μmol/L的SB202190溶液注入侧脑室。假手术组和模型组按照与利拉鲁肽相同的剂量注射生理盐水,连续7 d。
1.2.3 水迷宫测试方法 各组大鼠于干预后第1~6 d进行Morris水迷宫训练,第7 d进行定位巡航和空间探索测验。水迷宫直径160 cm、高度55 cm、水深30 cm,平台直径12 cm、高28 cm。训练时,分别将大鼠从4个象限放入水中,如大鼠在90 s内爬上平台并停留3 s以上则认为找到平台,并记录逃避潜伏期;如大鼠在90 s内未找到平台,则拖拽其尾部引导至平台并记录逃避潜伏期为90 s,每次训练间隔为5 min。第7 d进行定位巡航测定,记录大鼠从四个象限找到平台的平均逃避潜伏期;撤除平台后记录大鼠在90 s内穿越平台所在位置的次数。
1.2.4 脑梗死体积测定方法 完成行为学评价后过量麻醉处死大鼠,取每组取一半大鼠用于脑梗死体积测定,解剖完整的脑组织后迅速进行冰冻切片,每张厚度5 mm,放置在2%的TTC溶液内、37 ℃染色20 min,4%多聚甲醛固定后拍照记录。用Image J软件计算各个切片的脑组织面积及脑梗死面积,按照脑梗死面积/脑组织面积计算脑梗死体积。
1.2.5 细胞凋亡的检测方法 取组内另一半处死的大鼠,解剖I/R部位的脑组织并等分为两份。其中一份用石蜡包埋后制作石蜡切片,用TUNEL试剂盒进行染色后在荧光显微镜的高倍视野下观察,计数TUNEL阳性染色细胞(凋亡细胞)数目及DAPI阳性染色细胞(总细胞)数目,细胞凋亡率=凋亡细胞数/总细胞数。
1.2.6 蛋白表达的Western-blotting检测 取另一半I/R部位脑组织,加入蛋白裂解液后提取总蛋白。对总蛋白进行定量后,取50 μg总蛋白加入预先配置好的SDS-聚丙烯酰胺凝胶点样孔内,进行垂直电泳后将蛋白样本电转膜至NC膜。NC膜在5%脱脂牛奶中封闭2 h后在4 ℃中孵育p-p38、p38、p-JNK、JNK、p-ERK1/2、ERK1/2的单克隆抗体过夜。第2 d取出NC膜,孵育辣根过氧化物酶第二抗体1 h,最后加入显影液并在化学发光成像系统中曝光得到蛋白条带。用Image J软件扫描蛋白条带灰度值,计算p-p38与p38、p-JNK与JNK、p-ERK1/2与ERK1/2灰度值的比值,以此作为蛋白的表达水平。
1.2.7 细胞因子及氧化应激指标的测定 取蛋白裂解液提取得的总蛋白样本,采用ELISA试剂盒测定TNF-α、IL-1β、IL-6的水平。采用ROS试剂盒测定ROS水平,采用MDA试剂盒测定MDA水平,采用SOD试剂盒测定SOD水平,采用GPx测定GPx水平。
1.2.8 统计学方法 采用SPSS 21.0软件对数据进行统计学分析,多组间比较采用单因素方差分析、两两比较采用LNK法。P<0.05为差异有统计学意义。
2 结 果
2.1 各组间脑梗死体积的比较 见图1。假手术组、模型组、GLP-1组、p38MAPK抑制剂组脑梗死体积分别为0%、(48.59±7.68)%、(14.42±3.28)%、(23.57±4.58)%。与模型组比较,GLP-1组和p38MAPK抑制剂组大鼠的脑梗死体积显著降低(均P<0.05)。

图1 大鼠脑梗死病灶的TCC染色图
2.2 各组水迷宫参数的比较 见表1。与假手术组比较,模型组大鼠的逃避潜伏期明显延长、穿越平台次数明显减少(均P<0.05)。与模型组比较,GLP-1组和p38MAPK抑制剂组大鼠的逃避潜伏期明显缩短、穿越平台次数明显增多(均P<0.05)。
2.3 各组梗死脑组织细胞凋亡率的比较 见图2。假手术组、模型组、GLP-1组、p38MAPK抑制剂组梗死脑组织细胞凋亡率分别为(4.73±0.84)%、(35.37±6.78)%、(11.38±1.84)%、(13.94±2.26)%。与假手术组比较,模型组大鼠梗死脑组织中的细胞凋亡率明显增高(P<0.05)。与模型组比较,GLP-1组和p38MAPK抑制剂组大鼠梗死脑组织中的细胞凋亡率明显减少(均P<0.05)。
2.4 各组梗死脑组织氧化应激指标的比较 见表2。与假手术组比较,模型组大鼠梗死脑组织中MDA、ROS水平明显增多,SOD、GPx水平明显减少(均P<0.05)。与模型组比较,GLP-1组和p38MAPK抑制剂组大鼠梗死脑组织中MDA、ROS水平明显减少,SOD、GPx水平明显增多(均P<0.05)。

表1 各组逃避潜伏期及穿越平台次数的比较(x±s,n=12)组别逃避潜伏期(s)穿越平台次数(次)假手术组22.31±3.2813.41±1.98模型组52.37±8.79*5.67±0.83*GLP-1组37.64±6.72△8.94±1.26△p38MAPK抑制剂组38.12±6.88△8.42±1.09△ 注:与假手术组比较*P<0.05;与模型组比较△P<0.05
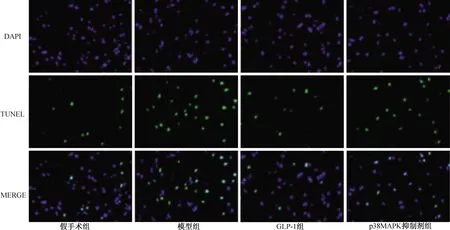
图2 各组间梗死脑组织细胞凋亡(TUNEL染色,×400)
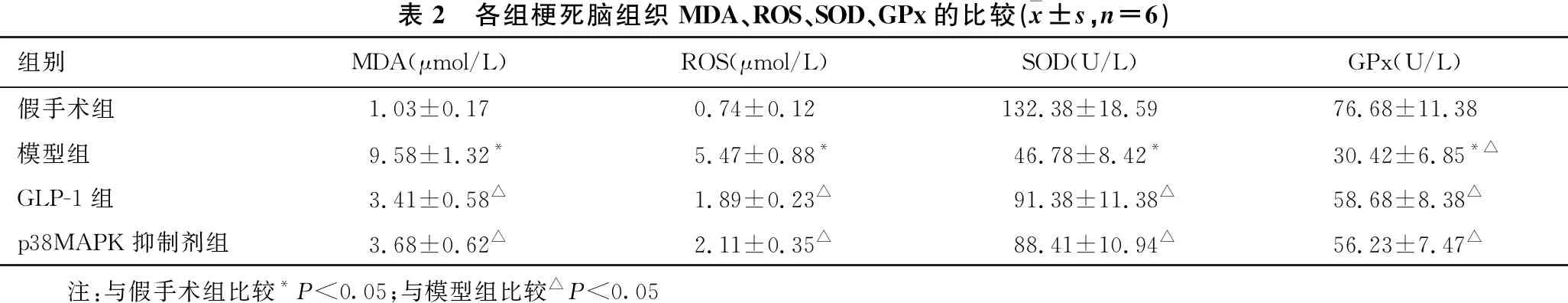
表2 各组梗死脑组织MDA、ROS、SOD、GPx的比较(x±s,n=6)组别MDA(μmol/L)ROS(μmol/L)SOD(U/L)GPx(U/L)假手术组1.03±0.170.74±0.12132.38±18.5976.68±11.38模型组9.58±1.32*5.47±0.88*46.78±8.42*30.42±6.85*△GLP-1组3.41±0.58△1.89±0.23△91.38±11.38△58.68±8.38△p38MAPK抑制剂组3.68±0.62△2.11±0.35△88.41±10.94△56.23±7.47△ 注:与假手术组比较*P<0.05;与模型组比较△P<0.05
2.5 四组间梗死脑组织中炎症指标的比较 见表3。与假手术组比较,模型组大鼠梗死脑组织中TNF-α、IL-1β、IL-6水平显著升高(均P<0.05);与模型组比较,GLP-1组和p38MAPK抑制剂组大鼠梗死脑组织中TNF-α、IL-1β、IL-6水平明显减少(均P<0.05)。
2.6 各组梗死脑组织p38MAPK通路分子表达的比较 见图3、表4。与假手术组比较,模型组大鼠梗死脑组织中p-p38的表达水平明显增多(P<0.05),p-ERK1/2、p-JNK的表达水平无明显变化(均P>0.05);与模型组比较,GLP-1组和p38MAPK抑制剂组大鼠梗死脑组织中p-p38的表达水平明显减少(P<0.05),p-ERK1/2、p-JNK的表达水平无明显变化(均P>0.05)。
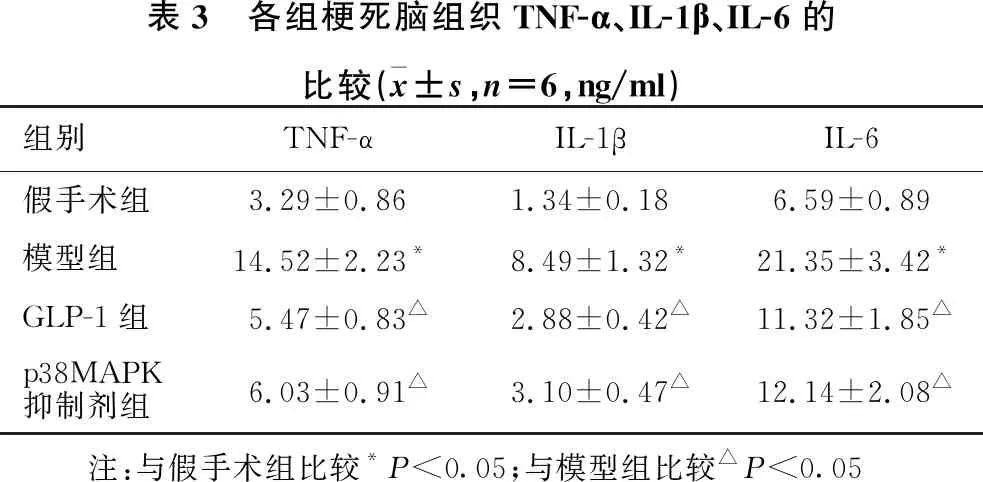
表3 各组梗死脑组织TNF-α、IL-1β、IL-6的比较(x±s,n=6,ng/ml)组别TNF-αIL-1βIL-6假手术组3.29±0.861.34±0.186.59±0.89模型组14.52±2.23*8.49±1.32*21.35±3.42*GLP-1组5.47±0.83△2.88±0.42△11.32±1.85△p38MAPK抑制剂组6.03±0.91△3.10±0.47△12.14±2.08△ 注:与假手术组比较*P<0.05;与模型组比较△P<0.05

图3 各组梗死脑组织中p-p38、p-ERK1/2、p-JNK蛋白电泳图 A:p-p38蛋白电泳图;B:p-ERK1/2蛋白电泳图;C:p-JNK蛋白电泳图
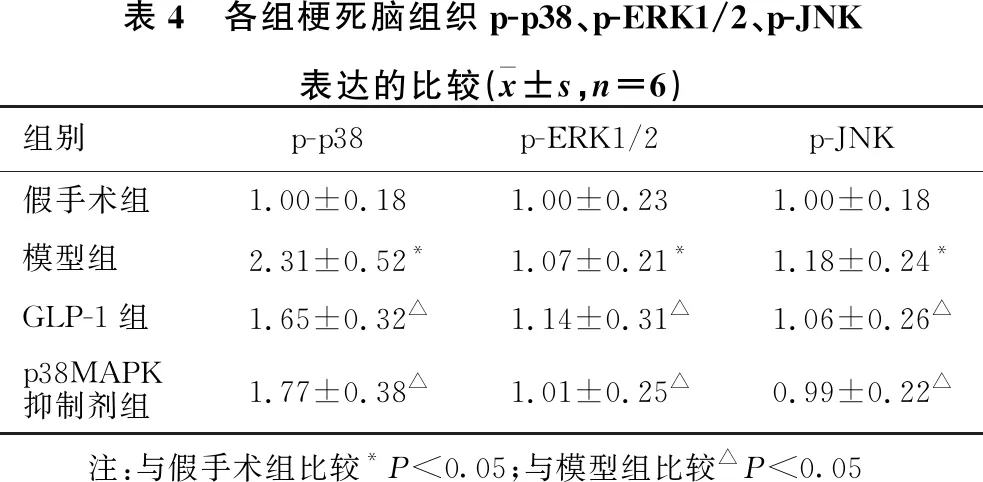
表4 各组梗死脑组织p-p38、p-ERK1/2、p-JNK表达的比较(x±s,n=6)组别p-p38p-ERK1/2p-JNK假手术组1.00±0.181.00±0.231.00±0.18模型组2.31±0.52*1.07±0.21*1.18±0.24*GLP-1组1.65±0.32△1.14±0.31△1.06±0.26△p38MAPK抑制剂组1.77±0.38△1.01±0.25△0.99±0.22△ 注:与假手术组比较*P<0.05;与模型组比较△P<0.05
3 讨 论
I/R是急性脑梗死再灌注治疗后必经的病理生理过程,I/R过程中氧化应激、炎症反应的激活能够引起组织I/R损伤并影响再灌注治疗效果。近年来,如何减轻脑I/R损伤受到了越来越多的关注。GLP-1是具有降糖、抗炎、抗氧化等多种生物学活性的生物多肽[9]。利拉鲁肽作为GLP-1类似物已在高同型半胱氨酸诱导海马神经元损伤模型中被证实能够减轻神经元的炎症及氧化应激损伤[8],但关于GLP-1在脑I/R损伤中所起的作用仍未见明确报道。本研究通过大脑中动脉栓塞及再灌注建立了大鼠脑I/R模型,再灌注后7 d观察到模型组大鼠脑组织存在明显的梗死病灶,且水迷宫试验中逃避潜伏期、穿越平台次数均发生了明显变化,提示大鼠脑I/R模型存在明显的大体形态改变及神经行为改变,发生了I/R损伤。在再灌注前30 min及再灌注后7 d连续给予GLP-1类似物干预发现,GLP-1组大鼠的脑梗死体积明显小于模型组,且水迷宫参数逃避潜伏期、穿越平台次数均优于模型组,提示GLP-1干预能够减轻大鼠脑I/R损伤。
脑I/R损伤过程涉及细胞凋亡、氧化应激、炎症反应、内质网应激等复杂的生物学过程,其中细胞凋亡是多种生物学环节共同作用的下游机制,氧化应激、炎症反应、内质网应激等均能激活细胞凋亡并引起组织损伤[10-11]。本研究通过TUNEL染色明确大鼠脑I/R损伤过程中细胞凋亡的情况,结果显示,模型组大鼠梗死脑组织中的细胞凋亡率明显高于假手术组,提示脑I/R过程中发生了过度的细胞凋亡。在使用GLP-1类似物干预后发现,GLP-1组大鼠梗死脑组织中的细胞凋亡率明显低于模型组,说明GLP-1能够减轻大鼠脑I/R过程中的细胞凋亡。GLP-1减轻脑I/R过程中细胞凋亡的效应与GLP-1减轻I/R损伤程度的效应相一致,也提示减轻细胞凋亡可能是GLP-1减轻大鼠脑I/R损伤程度的机制。
氧化应激及炎症反应是I/R过程中重要的病理变化,该过程中氧自由基及炎症介质的大量产生不仅能够直接破坏神经元及神经胶质,也能通过下游caspase介导的级联放大反应来引起细胞凋亡。ROS是氧化应激过程中最重要的氧自由基,与神经细胞脂质反应后造成细胞损伤,增加MDA释放及SOD、GPx消耗[12-13];TNF-α、IL-1β、IL-6是炎症反应过程中发挥促炎作用的炎症介质,能够介导炎症的级联放大[14-15]。本研究对大鼠脑I/R损伤过程中氧化应激介质及炎症细胞因子的分析显示,模型组大鼠梗死脑组织中ROS、MDA、TNF-α、IL-1β、IL-6水平明显高于假手术组,SOD和GPx水平明显低于假手术组,提示脑I/R过程存在明显的氧化应激及炎症反应激活。GLP-1类似物已经在高同型半胱氨酸诱导海马神经元损伤模型中被证实具有抗炎及抗氧化作用。本研究在GLP-1干预后分析I/R脑组织中氧化应激及炎症的变化可知:GLP-1组大鼠梗死脑组织中ROS、MDA、TNF-α、IL-1β、IL-6水平明显低于模型组,SOD和GPx水平明显高于模型组,提示GLP-1能够减少脑I/R损伤过程中氧自由基及炎症介质的释放,具有抗炎及抗氧化作用。
p38MAPK信号通路是目前已知调节细胞内氧化应激及炎症反应的重要通路。该通路包括p38、JNK、ERK1/2等重要的信号分子,三种不同的信号分子能够通过自身磷酸化的激活来介导细胞外信号向细胞内的级联放大传递,最终造成细胞内氧自由基及炎症介质的改变[16]。本研究对大鼠脑I/R过程中p38MAPK信号通路进行分析发现,模型组大鼠梗死脑组织中p-p38的表达水平明显高于假手术组、GLP-1类似物干预后大鼠梗死脑组织中p-p38的表达水平明显低于模型组,而三组间p-JNK、p-ERK1/2的表达水平无明显差异,提示p38MAPK通路中p38信号分子的磷酸化活化在脑I/R损伤中发挥重要作用,GLP-1类似物能够明显抑制I/R过程中p38的磷酸化。为了进一步验证p38信号分子受抑制在脑I/R损伤过程中所起到的保护作用,本研究在再灌注前将p38的抑制剂SB202190注入侧脑室,结果显示,p38MAPK抑制剂组大鼠的脑梗死体积明显小于模型组,水迷宫参数优于模型组,梗死脑组织中的细胞凋亡率及ROS、MDA、TNF-α、IL-1β、IL-6水平均明显低于模型组,SOD和GPx的含量明显高于模型组,提示抑制I/R过程中p38的磷酸化活化能够减轻大鼠脑I/R损伤及I/R过程中的炎症反应、氧化应激反应。
综上所述,大鼠脑I/R过程中p38介导的氧化应激及炎症明显激活,GLP-1能够通过抑制p38介导的氧化应激及炎症反应来减轻大鼠脑I/R损伤。
