N-2-(3,4-亚甲二氧基苯乙基)-3-(4-甲氧基甲基-1-环戊烯基-1-丙基)胺的合成*
2020-05-18肖和盛王晓季黄双平
肖和盛,王晓季,黄双平
(1. 江西科技师范大学药学院,江西 南昌 330013;2.江西科技师范大学生命科学学院,江西 南昌 330013)
三尖杉碱是天然抗癌产物——三尖杉碱类化合物的母核,其衍生物三尖杉酯碱和高三尖杉酯碱具有很强的抗癌活性,临床运用于急、慢性白血病以及红斑狼疮等疾病的治疗,其作用机制主要有抑制蛋白基因的表达,诱导细胞凋亡和细胞分化[1~9].三尖杉碱的合成重点在于含氮螺环的构建,而已报道的合成路线中,以氮原子为核心来构建螺环的方法最为常用,其中,Tietze等[10]以直链胺为原料通过一种较为独特的方法完成了三尖杉碱的合成.基于此,本文设计了一条以环戊二烯基钠和3-溴丙酸甲酯为起始原料,经6步反应合成了直链胺—— N-2-(3,4-亚甲二氧基苯乙基)-3-(4-甲氧基甲基-1-环戊烯基-1-丙基)胺的合成.合成路线如图1所示:
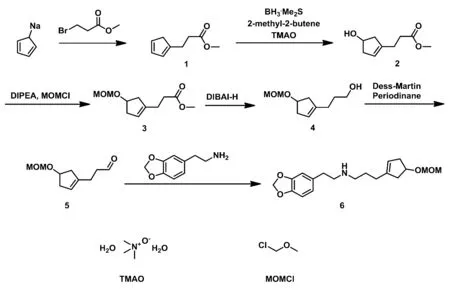
图1 目标化合物的合成路线
1 实验
1.1 主要试剂与仪器
环戊二烯基钠、二水合氧化三甲胺(TMAO),分析纯,百灵威科技有限公司;3-溴丙酸甲酯、硼烷二甲硫醚络合物、2-甲基-2-丁烯、N,N-二异丙基乙胺(DIPEA)、二异丁基氢化铝(DIBAl-H)、3,4-亚甲二氧基苯乙胺、四氢呋喃、戴斯马丁氧化剂(DMP),分析纯,萨恩化学技术(上海)有限公司;二氯甲烷、甲醇,分析纯,西陇科学股份有限公司;硼氢化钠、氯甲基甲醚(MOMCl),分析纯,山东西亚化学股份有限公司.AC-P400型核磁共振仪,德国 Bruker公司.
1.2 实验步骤
1.2.1 3-环戊二烯基丙酸甲酯(1)的合成
在1 000 mL圆底烧瓶中加入33.4 g(0.2 mol)3-溴丙酸甲酯和290 mL四氢呋喃,开启搅拌,降温至-78 ℃.氮气保护下,缓慢滴加17.62 g(0.2 mol)环戊二烯基钠,滴加完,在-78 ℃下搅拌3 h后,往圆底烧瓶内加入100 mL二氯甲烷,用TLC(薄层色谱)监测反应.反应完毕,升温至室温.用硅藻土过滤,减压浓缩溶剂,粗产物经硅胶柱层析分离纯化,得产物22.87 g,淡黄色液体,产率:75.2%.1H NMR (400 MHz, CDCl3), δ 6.45 ~ 6.39 (m, 1H), 6.27 (d,J=5.3 Hz, 1H), 6.19 (s, 1H), 3.69 (s, 3H), 2.99~2.88 (m, 2H), 2.77 (t,J=7.5 Hz, 2H), 2.63~2.54 (m, 2H).
1.2.2 3-(4-羟基-1-环戊烯基)丙酸甲酯(2)的合成
氮气保护下,在洁净干燥的500 mL圆底烧瓶中加入3.00 g(0.04 mol)的硼烷二甲硫醚络合物和160 mL的四氢呋喃,降温至0 ℃,缓慢滴加5.54 g(0.079 mol)2-甲基-2-丁烯,加完,0 ℃下搅拌2 h后,缓慢滴加5 g(0.033 mol)化合物(1),0 ℃下搅拌1 h,升温至常温,搅拌2 h,减压蒸除溶剂四氢呋喃,加入130 mL甲苯.转移至洁净干燥的1 000 mL三口圆底烧瓶中,加入21.93 g(0.197 mol)二水合氧化三甲胺,然后加热回流,反应2 h,TLC(薄层色谱)监测反应.反应完毕,冷却降温,加入30 mL饱和氯化铵溶液,搅拌1 h,用乙酸乙酯进行萃取(3 × 25 mL),合并有机相,用饱和食盐水(1 × 50 mL)洗涤,无水硫酸钠干燥.过滤,减压浓缩溶剂,粗产物经硅胶柱层析分离纯化,得产物4.89 g,无色液体,产率:87.5%.1H NMR (400 MHz, CDCl3), δ 5.32 (s, 1H), 4.48 (d,J=6.1 Hz, 1H), 3.67 (s, 3H), 2.70 ~ 2.55 (m, 2H), 2.52 ~ 2.44 (m, 2H), 2.41 (d,J=7.2 Hz, 2H), 2.30 (dd,J=23.6 Hz,J=15.4 Hz, 2H), 2.20 (s, 1H).
1.2.3 3-(4-甲氧基甲基-1-环戊烯基)丙酸甲酯(3)的合成
氮气保护下,在洁净干燥的500 mL圆底烧瓶中加入4.89 g(0.029 mol)化合物(2)和150 mL二氯甲烷.降温至0 ℃,滴加14.86 g(0.115 mol)的N,N-二异丙基乙胺,加完搅拌15 min,缓慢滴加9.26 g(0.115 mol)氯甲基甲醚,加完,搅拌10 min,升温至室温,TLC(薄层色谱)监测反应.反应完毕,加水淬灭.用二氯甲烷萃取(3 × 25 mL),合并有机相,用饱和食盐水(1 × 50 mL)洗涤,无水硫酸钠干燥.过滤,减压浓缩溶剂,粗产物经硅胶柱层析分离纯化,得产物5.15 g,无色液体,产率:83.7%.1H NMR (400 MHz, CDCl3), δ 5.32 (s, 1H), 4.64 (s, 2H), 4.40 (tt,J=6.5,J=3.1 Hz, 1H), 3.67 (s, 3H), 3.36 (s, 3H), 2.58 (d,J=18.4, 6.7 Hz, 2H), 2.51 ~ 2.44 (m, 2H), 2.40 (d,J=8.9 Hz, 3H), 2.32 (d,J=17.8 Hz, 2H).
1.2.4 3-(4-甲氧基甲基-1-环戊烯基)丙醇(4)的合成
氮气保护下,在洁净干燥的500 mL圆底烧瓶中加入5 g(0.023 mol)化合物(3)和120 mL二氯甲烷,降温至0 ℃,缓慢滴加18.68 mL(0.028 mol,1.5 M)二异丙基氢化铝,加完,0 ℃下搅拌,TLC(薄层色谱)监测反应.反应完毕,在0 ℃下缓慢滴加甲醇至不冒气泡,然后滴加与甲醇相同体积的酒石酸钾钠饱和溶液,升温至室温,搅拌至溶液分层.用硅藻土过滤,无水硫酸钠干燥.过滤,减压浓缩溶剂,粗产物经硅胶柱层析分离纯化,得产物3.92 g,无色液体,产率:90.2%.1H NMR (400 MHz, CDCl3), δ 5.33 (s, 1H), 4.64 (s, 2H), 4.40 (tt,J=6.5,J=3.1 Hz, 1H), 3.64 (t,J=6.4 Hz, 2H), 3.36 (s, 3H), 2.57 (ddd,J=23.3,J=16.7,J=6.5 Hz, 2H), 2.34 (t,J=17.4 Hz, 2H), 2.15 (t,J=7.2 Hz, 2H), 1.77 ~ 1.68 (m, 2H).
1.2.5 3-(4-甲氧基甲基-1-环戊烯基)丙醛(5)的合成
氮气保护下,在洁净干燥的250 mL圆底烧瓶中加入 3.92 g(0.021 mol)化合物(4)和110 mL二氯甲烷,降温至0 ℃,依次加入10.72 g(0.025 mol)戴斯马丁氧化剂和6.19 g(0.074 mol)无水碳酸氢钠,加完,升温至室温,TLC(薄层色谱)监测反应.反应完毕,用水淬灭,用二氯甲烷萃取(3 × 25 mL),合并有机相,用饱和食盐水(1 × 50 mL)洗涤,无水硫酸钠干燥.过滤,减压浓缩溶剂,粗产物经硅胶柱层析分离纯化,得产物3.7 g,无色液体,产率:95.4%.1H NMR (400 MHz, CDCl3), δ 9.77 (d,J=1.4 Hz, 1H), 5.31 (s, 1H), 4.64 (s, 2H), 4.41 (dq,J=10.0,J=3.3 Hz, 1H), 3.36 (s, 3H), 2.61 (d,J=7.4 Hz, 2H), 2.55 (dd,J=19.0,J=4.1 Hz, 2H), 2.43 ~ 2.36 (m, 3H), 2.31 (d,J=16.7 Hz, 2H).
1.2.6 N-2-(3,4-亚甲二氧基苯乙基)-3-(4-甲氧基甲基-1-环戊烯基-1-丙基)胺(6)的合成
氮气保护下,在洁净干燥的50 mL圆底烧瓶中加入3.5 g(0.019 mol)化合物(5),2.19 g(0.019 mol)3,4-亚甲二氧基苯乙胺和20 mL甲醇,常温搅拌4 h,降温至0 ℃,分批加入1.44 g(0.038 mol)硼氢化钠,加完,0 ℃下搅拌,TLC(薄层色谱)监测反应.反应完毕,用2.5 M氢氧化钠溶液淬灭,用二氯甲烷萃取(3×5 mL),无水硫酸镁干燥.过滤,减压浓缩溶剂,粗产物经硅胶柱层析分离纯化,得产物4.46 g,白色粘稠液体,产率:70.5%.1H NMR (400 MHz, CDCl3), δ 6.72 ~ 6.63 (m, 2H), 6.60 (d,J=7.5 Hz, 1H), 5.87 (s, 2H), 4.59 (s, 2H), 4.35 (s, 1H), 3.31 (s, 3H), 2.77 (s, 2H), 2.68 (d,J=5.1 Hz, 2H), 2.52 (dd,J=23.4 Hz,J=13.6 Hz,4H), 2.36~2.20 (m, 2H), 2.03 (s, 2H), 1.59 (d,J=6.2 Hz, 2H).
2 结果与讨论
在合成3-(4-羟基-1-环戊烯基)丙酸甲酯的过程中,发现硼烷和2-甲基-2丁烯的反应合成硼烷试剂时,在-20 ℃下加料比0 ℃加料时能大大提高3-(4-羟基-1-环戊烯基)丙酸甲酯的产率,由30%提升到87.5%.最终以较高收率完成了目标产物的合成,该目标产物的合成为开发一条新的三尖杉碱的合成路线奠定了基础.
3 结论
以环戊二烯基钠和3-溴丙酸甲酯为起始原料,经6步反应完成了目标化合物N-2-(3,4-亚甲二氧基苯乙基)-3-(4-甲氧基甲基-1-环戊烯基-1-丙基)胺的合成,总收率为33.4%.该路线反应条件温和、操作简单、原材料廉价易得、整体反应收率较高.
