贵州省黔南地区猪源肠球菌的分离鉴定及其耐药性分析
2020-05-17罗致茜吕世明谭艾娟董保豫犹银俊杨睿智郑汝青
罗致茜 , 吕世明 , 谭艾娟 , 董保豫 , 犹银俊 , 林 习 , 杨睿智 , 郑汝青 , 周 玲
(1.贵州大学动物科学学院 , 贵州 贵阳 550025 ; 2.贵州大学生命科学学院 , 贵州 贵阳 550025 ; 3.黔南州动物疫病预防控制中心 , 贵州 都匀 558000)
肠球菌(Enterococcus)属肠球菌属,为革兰阳性球菌,广泛分布于环境及人和动物肠道内,是人类和动物肠道正常菌群的一部分。肠球菌为条件致病菌,在正常条件下不致病,但是随着畜牧业中免疫抑制剂及抗菌药物的广泛使用,肠球菌已成为重要的条件致病菌,临床肠球菌所致感染性疾病逐年增多[1-2],感染发生率正在逐年上升,可引起泌尿道感染、败血症及心内膜炎等多种疾病。据中国细菌耐药性监测网(CHINET)数据显示,中国细菌耐药性检测中多药耐药的肠球菌在临床已并不少见[3-5]。大量的抗菌药物用于动物疾病的预防与治疗,对细菌的耐药性产生巨大的选择压力,养殖场已经成为耐药菌产生的主要地方之一,并且肠球菌存在通过食物链传播并转移耐药基因的风险[6]。我国兽医临床上已经在鸡、鸭、绵羊、仔猪等动物中分离出肠球菌,由此可见动物源肠球菌耐药的现状形势严峻,有必要对其耐药性进行监测,及时分析动物源肠球菌的耐药性,对养殖业中肠球菌的临床抗菌药物的用药具有指导意义。本试验针对贵州省黔南地区部分猪场分离的肠球菌的耐药性进行研究,为贵州省肠球菌的控制提供科学依据。
1 材料与方法
1.1 材料
1.1.1 样品来源 2019年1月采集于贵州省黔南地区10个猪场共219份肛门拭子样品。
1.1.2 培养基及试剂 Cary-Blair氏运送培养基、肠球菌肉汤、肠球菌显色培养基、营养琼脂,均购自青岛海博生物技术有限公司;DNA Marker 2 000,购自天根生化科技有限公司;2×TaqPCR Master Mix,购自康为世纪生物科技有限公司;甘油、Gold view Ⅰ型核酸染料,均购自北京索莱宝科技有限公司;琼脂糖,购自西班牙Sigma公司;50×TAE缓冲液,购自生工生物工程(上海)股份有限公司。
1.1.3 主要药品 青霉素、阿莫西林、头孢噻呋、头孢西丁、苯唑西林、庆大霉素、多西环素、氧氟沙星、磺胺异噁唑、复方新诺明、氟苯尼考、红霉素、克林霉素、替米考星、利奈唑胺、万古霉素、金霉素,均购自大连美仑生物技术有限公司。
1.1.4 仪器设备 LDZM-60KCS立式压力蒸汽灭菌锅(上海申安医疗器械厂);电热恒温培养箱(上海贺德试验设备有限公司);ST16R高速冷冻离心机(Thermo Fisher公司);细菌浊度仪WGZ-XT(杭州齐威仪器有限公司);T20型双槽梯度PCR仪(杭州朗基科学仪器有限公司);电泳仪JY600(北京君意东方电泳设备有限公司);凝胶成像系统Gel Doc XR(美国BIO-RAD公司)。
1.2 方法
1.2.1 采样 将猪肛门拭子置于灭菌的Cary-Blair氏运送培养基,运送至实验室。
1.2.2 预增菌 将一次性采样猪肛门棉拭子取出,置于灭菌装有肠球菌肉汤的2 mL EP管中,37 ℃培养16~20 h。
1.2.3 肠球菌显色培养基分离 取预增菌液一环,划线于肠球菌显色培养基上,37 ℃培养24~48 h,挑取单个紫色可疑菌落划线于营养琼脂进行纯化,然后制成25%甘油菌保种。
1.2.4 鉴定 参照王熙楚等[7]对肠球菌的分子鉴定方法,肠球菌属的高度保守的tuf基因组片段的特异性引物序列:上游:5′-TACTGACAAACCATTCATGATG-3′;下游:5′-AATTCGTCACCAACGCGAAC-3′,引物由赛默飞世尔科技(中国)有限公司合成。
细菌DNA模板制备:参照孙硕[8]采用煮沸法提取细菌DNA作为模板。
PCR扩增:15 μL PCR反应体系:2×TaqPCR Master Mix 7.5 μL,ddH2O 5.5 μL,上下游引物各0.5 μL,模板1 μL。扩增条件:94 ℃ 3 min;94 ℃ 30 s, 55 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 10 min。
扩增产物电泳:PCR产物经2%琼脂糖凝胶(含核酸染料)100 V电压下电泳40 min后成像检测。
1.2.5 药敏试验 按照美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)[9]推荐的微量肉汤稀释法进行最低抑菌浓度(MIC)测定,并按照2013年CLSI发布的兽医药物敏感性试验标准—《动物源细菌抗菌药物敏感性试验纸片法和稀释法执行标准(VET01-A4)》和附表(VET01-S2)[10]进行结果判断,其中庆大霉素按CLSI规定的高水平耐氨基糖苷类耐药判定标准。质控菌为肠球菌标准菌株ATCC 29212。
2 结果
2.1 肠球菌的分离鉴定 从10个猪场采集的219份肛门拭子,经增菌、纯化、鉴定,共分离出132株肠球菌,分离率60.27%。肠球菌在肠球菌显色培养基上的典型菌落为紫色,其他菌显无色、黄色。PCR鉴定结果见图1。

图1 贵州省黔南地区猪源肠球菌PCR鉴定结果
2.2 药敏试验 结果见表1,132株肠球菌对青霉素、阿莫西林、头孢噻呋、头孢西丁、苯唑西林、庆大霉素、多西环素、氧氟沙星、磺胺异噁唑、复方新诺明、氟苯尼考、红霉素、克林霉素、替米考星、利奈唑胺、万古霉素、金霉素共17种抗菌药物敏感性有较大差异,其中对克林霉素、磺胺异噁唑、复方新诺明、红霉素耐药最严重,耐药率为100%;对头孢西丁、头孢噻呋、替米考星、苯唑西林、多西环素、金霉素、氧氟沙星、氟苯尼考、青霉素、利奈唑胺、阿莫西林、庆大霉素耐药率分别为99.24%、99.24%、99.24%、97.73%、96.97%、94.70%、84.09%、83.33%、73.47%、69.70%、63.64%、34.09%;对万古霉素的耐药率最低(30.30%)。
结果显示,对磺胺类(磺胺异噁唑、复方新诺明)、大环内酯类(红霉素)、林可霉素类(克林霉素)的耐药率均为100%;有84株肠球菌对3种β-内酰胺类药物(青霉素、阿莫西林、苯唑西林)均耐药,耐药率为63.64%;第2代头孢(头孢西丁)与第3代头孢(头孢噻呋)的耐药率均为99.24%;大环内酯类(红霉素、替米考星)与四环素类(多西环素、金霉素)的耐药率相差不大。
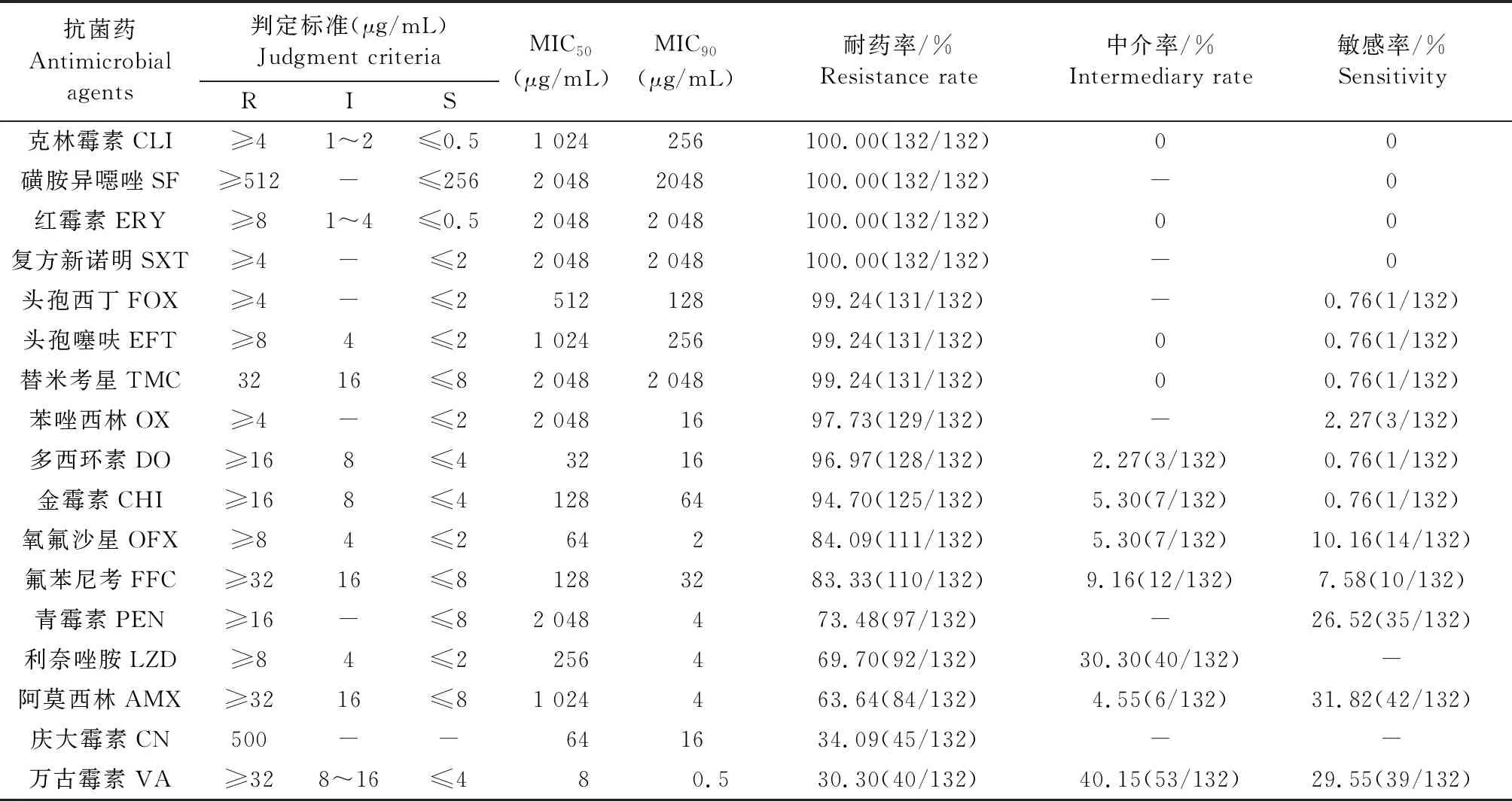
表1 黔南地区132株猪源肠球菌对17种抗菌药物的耐药性结果
2.3 肠球菌多重耐药谱 对临床分离的132株肠球菌进行多重耐药分析,如图2所示,所有菌株均为多重耐药菌 (multidrug-resistant organisma,MDROs),多重耐药谱以耐17种和15种药物为主,分别达30.30%(40株)和29.55%(39株),至少都对4种药物耐药。
3 讨论
抗菌药物的过度使用是肠球菌耐药性增加的重要因素。肠球菌因细胞壁厚,对有些抗菌药物天然耐药,且容易获得性耐药,耐药问题日趋严峻。近些年来,因为耐药菌株不断增多以及新型耐药菌株的出现,使得临床对肠球菌预防与治疗变得更加棘手[11]。

图2 猪源肠球菌的多重耐药菌株
本试验分离的132株肠球菌对克林霉素、磺胺异噁唑、红霉素、复方新诺明4种药物耐药最严重,耐药率均为100%,临床不建议使用;对头孢西丁、头孢噻呋、替米考星、苯唑西林、多西环素、金霉素、氧氟沙星、氟苯尼考、青霉素、利奈唑胺、阿莫西林、庆大霉素耐药率依次降低;对万古霉素的耐药率最低为30.30%。与河南省、江苏省、银川等部分地区[12-14]相比,耐药率均升高,表明不同地区肠球菌对抗菌药物的耐药性程度不同,却也有上升的趋势。
利奈唑胺与万古霉素在兽医临床上都禁止使用,利奈唑胺是第1个噁唑烷酮类抗菌药,2000年在美国首次上市,2007年于我国正式上市,人医上主要用于治疗耐甲氧西林金黄色葡萄球菌和万古霉素耐药肠球菌等[15]。对于兽医临床不使用的利奈唑胺与万古霉素,在本试验中,利奈唑胺的耐药率为69.70%,万古霉素耐药率为30.30%。国内已有报道表明,猪源分离粪肠球菌对万古霉素存在一定程度的耐药率。杨龙斌等[16]对江淮地区分离的40株猪源肠球菌的耐药性分析表明,其对万古霉素敏感率达72.0%以上。钱晓璐等[17]对猪源分离粪肠球菌的耐药性分析表明,40株粪肠球菌中有4株对万古霉素耐药,其中2株表现对万古霉素高度耐药。顾欣等[18]对10个规模化养猪场分离的133株粪肠球菌进行药敏试验,表明分离菌对万古霉素的耐药率为3.01%。王送林等[19]对湖南猪源粪肠球菌的耐药性分析表明,42株分离粪肠球菌对万古霉素的耐药率高达31%。万古霉素耐药肠球菌(Vancomycin-resistant enterococcus,VRE)对人类生命的威胁在逐年增加,根据本试验结果,养殖场耐万古霉素的肠球菌的产生和传播不容忽视,且万古霉素的耐药水平较高,应避免使用。
近年来,由于养殖场临床抗生素的大量使用,肠球菌的耐药性也逐渐增强,高水平氨基糖苷类耐药菌株(HLAR)、万古霉素耐药菌株(VRE)以及多重耐药菌株(MDROs)的出现,给临床治疗带来很大的困难和挑战,应充分了解和掌握肠球菌的耐药情况,根据药敏试验结果制订相应的给药方案,合理使用抗菌药物,从而减少肠球菌耐药菌株的产生,对控制肠球菌传播具有重要意义。
