缺血性脑卒中患者合并脑微出血的危险因素分析
2020-05-15徐大飞楚兰
徐大飞 楚兰
脑微出血(cerebral microbleeds,CMBs)是脑小血管病(cerebral small vessel disease,CSVD)中很重要的一种疾病。CMBs是脑内微小血管病变导致的血管壁破坏,以微小出血为主要特征的一种脑实质亚临床损害。有研究结果显示[1-2],老年患者中出现的一些临床症状和体征,如认知、情感、睡眠、步态等障碍均与CMBs有关。关于血脂水平与CMBs相关性研究报道较少,且结论不尽相同。有研究发现[3-4],与未合并CMBs者相比,合并CMBs者三酰甘油(triglycerides,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-c)水平均较低。亦有研究报道[5],血脂水平高低与CMBs发生无相关性。本研究对缺血性脑卒中(cerebral ischemic stroke,IS)患者合并 CMBs的危险因素进行探讨,以期为IS患者的治疗提供依据。
1 对象和方法
1.1 对象回顾性收集2015年1月至2017年5月作者医院神经内科连续收治的IS住院患者共1631例,其中合并CMBs者703例,未合并CMBs者928例。纳入标准:(1)IS诊断均符合中国脑血管疾病分类2015年版诊断要点[6]。排除标准:(1)意识障碍;(2)合并严重心、肝、肾功能衰竭,严重全身感染,恶性疾病,自身免疫系统疾病;(3)既往有脑肿瘤病史;(4)脑炎和脑外伤疾病史;(5)已行溶栓治疗;(6)既往有全身出血倾向性疾病、海绵状血管瘤、脑血管畸形等。
1.2 方法
1.2.1一般资料:收集性别、年龄、血压、体重、体重指数(body mass index, BMI)、血糖、尿酸、TG、TC、LDL-c、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-c)、载脂蛋白A(apolipoproteins A,apoA)、载脂蛋白B(apolipoproteins B,apoB)、吸烟史、饮酒史、高血脂史、糖尿病史、高血压史、心脏疾病史、脑白质高信号(white matter hyperintensity,WMH)等资料。根据作者医院临床检验中心血脂水平参考值,血脂代谢异常判断标准:空腹血生化检查显示TG>1.70 mmol/L和(或)TC>5.20 mmol/L和(或)LDL-c>3.10 mmol/L和(或)HDL-c<0.91mmol/L(男),HDL-c<1.0 mmol/L(女)。
1.2.2CMBs检查:入院3 d内行脑超导型磁共振(3.0 T Philips)和磁敏感加权成像(susceptibility weighted imaging,SWI)检查。采用8通道标准头部正交线圈,SWI序列扫描参数:TR 50 ms,TE 40 ms,翻转角度10°,FOV 220 mm×180 mm,矩阵220×180,层厚0.8 mm,层数120。由影像科医师及神经科经验丰富的医师阅片,对有疑问的CMBs灶,由两位高年资影像科医师共同阅片达成一致,记录CMBs数目及分布。
1.3 统计学处理采用SPSS21.0软件进行统计学分析,符合正态分布的计量资料以均数±标准差表示,两组间比较采用t检验;计数资料以率表示,采用χ2检验;采用多因素Logistic 回归分析影响CMBs发生的因素,计算OR值和95%CI。以P<0.05为差异有统计学意义。
2 结果
2.1 两组临床资料比较CMBs组703例,年龄24~95岁;无CMBs组928例,年龄23~96岁。与无CMBs组比较,CMBs组患者年龄大,男性、吸烟、饮酒、高血压、糖尿病、WMH构成比例均高,空腹血糖、尿酸水平均高,而空腹LDL-c和apoA水平均较低(均P<0.05)。结果见表1。
2.2 多因素 Logistic回归分析以是否存在CMBs作为因变量,将单因素分析有统计学意义的指标(年龄、吸烟、饮酒、高血压、糖尿病、WMH、空腹血糖、尿酸、LDL-c、apoA)为自变量带入Logistic回归模型。结果显示吸烟、饮酒、高血压、WMH、LDL-c、apoA是发生CMBs的独立危险因素(均P<0.05)。结果见表2。
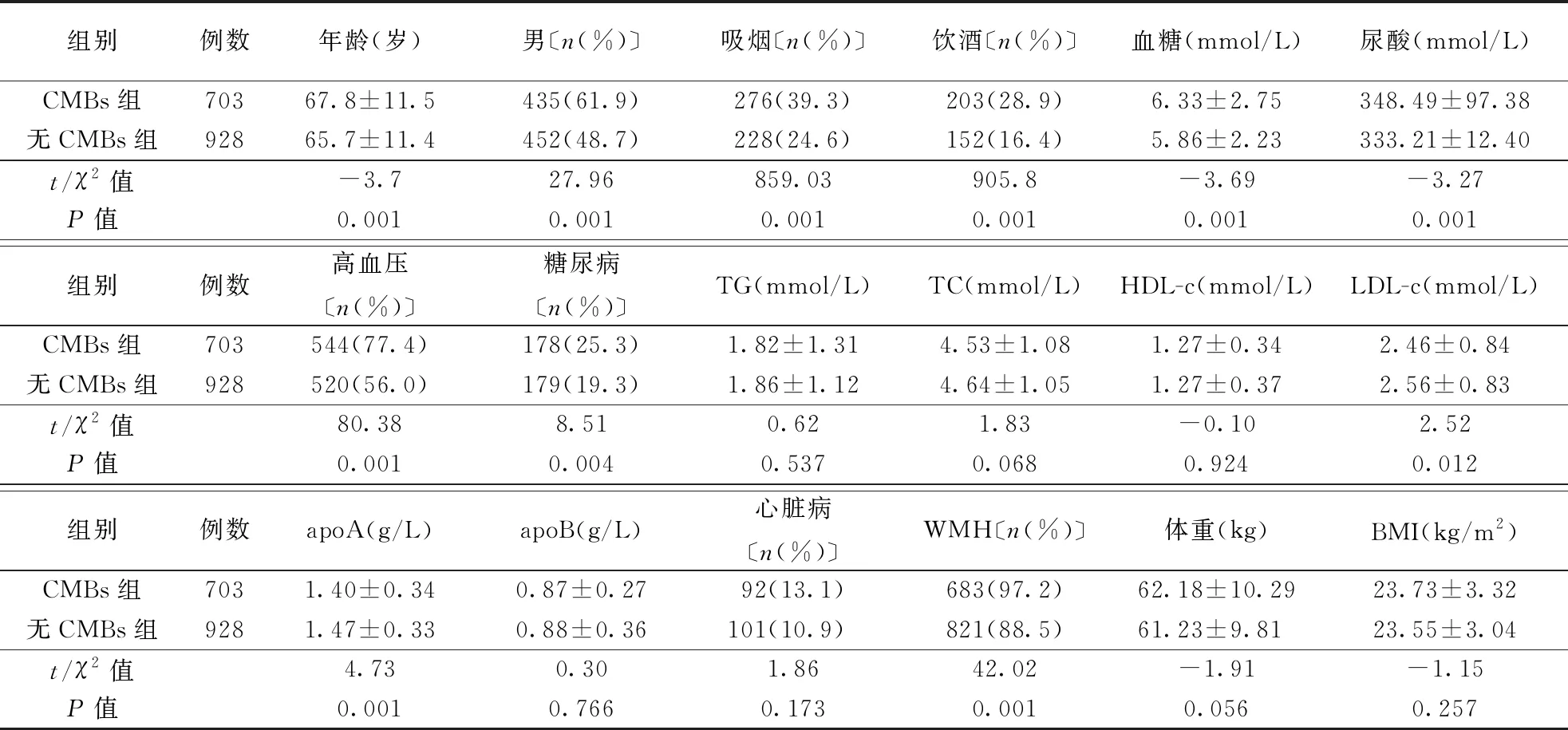
表1 IS患者有无合并CMBs组临床资料比较
注:IS:缺血性脑卒中,CMBs:脑微出血;表2同。TG:三酰甘油;TC:总胆固醇;HDL-c:高密度脂蛋白胆固醇;LDL-c:低密度脂蛋白胆固醇,apoA:载脂蛋白A;表2同。apoB:载脂蛋白B;WMH:脑白质高信号,表2同;BMI:体重指数
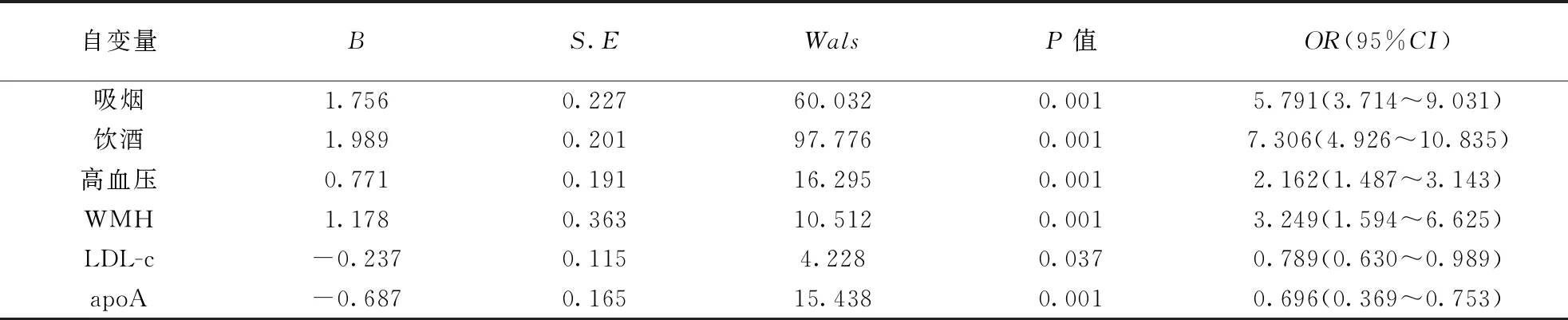
表2 IS患者合并CMBs危险因素的Logistic 回归分析结果
3 讨论
目前研究认为CMBs是对IS影响最主要的脑小血管病变之一[7],可直接或间接加重脑血管病严重程度[8],脑叶CMBs数目越多,导致出血性转化(hemorrhage transformation,HT)的危险越高,并可预示脑卒中的再发可能性。
目前已知吸烟、饮酒均是发生IS最常见的危险因素之一。本研究结果显示,吸烟、饮酒均是IS患者发生CMBs的独立危险因素,吸烟、饮酒者发生CMBs的危险是非吸烟、饮酒者的5.791倍和7.306倍。Gregoire等[9]研究发现,收缩压与CMBs发生高度相关,高血压是CMBs独立危险因素。本研究结果亦显示高血压是CMBs发生的独立危险因素之一。其机制可能为:长期高血压造成脑微小血管内皮细胞受损、微小动脉瘤形成和纤维透明样变性,从而导致CMBs形成。鉴于WMH和CMBs同属CSVD疾病分型,研究认为WMH是最早发生的CSVD之一[10],其发生可能要较患者出现临床症状早10年左右,其病理机制可能与脑慢性低或高灌注导致脑内血管反应性受损或血-脑屏障渗漏有关,WMH出现时间越早,对CMBs形成的影响越大。本研究结果显示WMH是CMBs的独立危险因素。
关于血脂水平与CMBs的确切关系尚无定论。藤振杰等[11]研究结果显示,CMBs组TG、TC、LDL-c水平均低于未合并CMBs组,但未发现血脂水平是CMBs发生的独立危险因素。王国珍等[3]和张持等[4]研究结果显示,CMBs组TG、TC、LDL-c水平均低于未合并CMBs组,并认为低水平TC是CMBs 独立危险因素。Orken等[5]研究结果显示,TC水平与CMBs发生无相关性。上述研究结论的不一致可能与研究对象不同和样本量较小有关,Orken等的研究对象为脑出血合并CMBs者,而其他报道均以缺血性脑卒中为研究对象。本研究结果显示,TC水平与CMBs的发生无相关性,亦未发现TC是CMBs发生的危险因素,这与Orken等[5]研究结论相符。这可能与TC主要导致大血管动脉粥样硬化血管斑块形成有关;而CMBs发生与脑内微小血管病变有关。但本研究发现,合并CMBs组LDL-c水平低于未合并CMBs组,且LDL-c是IS合并CMBs的独立危险因素,这结果与王本国等[12]研究结论相同。既往研究结果显示,低水平LDL-c是脑出血的危险因素[13],推测可能与过低的 LDL-c水平破坏小血管壁的完整性以及血小板聚集能力下降有关,从而导致脑出血的发生。本研究发现LDL-c是CMBs的独立危险因素,这是否与低水平LDL-c导致脑出血具有相同的病理机制尚不清楚,需要进一步针对CMBs的病理学进行基础研究。上述结果表明合理的血脂水平对维持小血管壁完整性非常重要。
目前尚未检索到关于aopA水平与CMBs关系的相关报道。Mitaki等[14]研究结果显示,低水平HDL-c与CMBs检出率呈负相关,尤其导致深部的CMBs发生。一般情况下,apoA的临床意义与HDL-c具有一致性。血清apoA是反映抗动脉粥样硬化HDL-c颗粒的总和,是HDL-c的主要载脂蛋白,参与胆固醇的逆转运,具有稳定脂蛋白结构、促进脂类运输的功能,同时也具有抗炎、抗氧化及抗冠状动脉粥样硬化的作用[15]。有研究认为,脑出血组均较对照组apoA水平下降,低水平apoA者更容易发生脑出血[16]。本研究结果发现,CMBs组apoA水平低于未合并CMBs组,且apoA是IS合并CMBs的独立危险因素,apoA水平每下降1 g/L,CMBs发生危险增加30.4%,推测可能apoA水平下降同样与HDL-c具有一致性,对脑小血管的保护因素减弱,从而造成CMBs的发生。
综上所述,本研究结果显示,吸烟、饮酒、高血压、WMH、LDL-c、apoA是IS合并CMBs的独立危险因素,且LDL-c和apoA水平下降与CMBs发生危险增加相关。因此,对于血脂水平较低的IS患者,在进行抗动脉硬化治疗过程中,应避免过度降低血脂水平,以免导致CMBs的发生危险。由于本研究为病例回顾性横断面研究,未对血脂水平进行动态观察,且IS患者均已口服抗血小板聚集类和他汀类药物进行二级预防治疗,因此限制血脂水平与CMBs之间确切的因果关系尚不完全清楚,需进一步研究。
