代谢综合征对肾癌术后肾脏功能和病理改变的影响
2020-05-15谢晶晶郭秀丽陈小青徐维佳王丽萍1
谢晶晶 郭秀丽 陈小青 张 勇 徐维佳 王丽萍1,
代谢综合征(MS)是一组由肥胖、血压、血糖、血脂异常等代谢紊乱引起的临床综合征。随着社会经济的迅速发展,MS患病率不断增长,已成为威胁人类健康的重要公共卫生问题[1]。研究表明,MS与慢性肾脏病(CKD)及估算的肾小球滤过率(eGFR)的下降有关。MS的各组分通过介导胰岛素抵抗、炎症因子激活、脂肪因子表达增加、氧化应激以及内皮功能紊乱等导致肾血管增生、系膜细胞增生、系膜基质扩张、肾小管间质损伤以及纤维化,最终引起肾小球硬化及肾小管萎缩使eGFR下降[2-3]。目前肾细胞癌发病率逐年上升,其中,肾透明细胞癌(ccRCC)是最常见的病理类型,根据2012年中国肿瘤年报表明,2012年ccRCC的发病率比2005年升高1倍以上(9.47/10万人vs3.96/10万人)[4]。根治性肾切除术(RN)仍是ccRCC主要的治疗方式。国外研究发现[5],因肾癌行RN后,合并MS患者术后第1年的eGFR低于非MS患者;MS会延缓供肾者单侧全肾切除术后eGFR的恢复[6]。但国内尚缺少MS对单侧全肾切除术后eGFR变化的研究。本文旨在探讨术前合并MS对ccRCC行单侧全肾切除术后eGFR的影响。
材料与方法
研究对象收集2012年12月到2017年1月期间于福建医科大学福总临床医学院因肾脏恶性肿瘤行单侧根治性肾切除手术的共有360例,术后肿瘤病理为ccRCC的有310例,其中合并MS且有完整资料32例。MS的诊断采用2004年中华医学会糖尿病学分会(CDS)的相关诊断标准[7],符合诊断标准四项中的三项或以上的纳入MS组,其他患者纳入非MS组。排除标准:(1)非肾透明细胞癌,术前肿瘤远处转移者、双肾肿瘤、孤立肾肾肿瘤等;(2)术前合并慢性肾脏病者;(3)术后使用化疗类药物者;(4)存在严重心脑疾病者。
研究方法
临床参数 收集患者的基本临床资料以及检验指标,术前1周内平均血清肌酐(SCr)值作为术前基线值(T0)。收集患者术后1周(T1)、术后3月(T2)、术后1年(T3)、术后2年(T4)的SCr值,并根据CKD-EPI[8]公式计算eGFR,依据KDIGO[9]诊断标准判断有无CKD。
研究分组 文献报道[10-11],单侧全肾切除术后肾功能下降与年龄、手术方式(微创或开放)、肿瘤最大径有关。故本研究通过倾向性评分匹配获得与MS组在年龄、性别、手术方式、肿瘤最大径与MS组相匹配的32例非MS的患者作为对照组。
组织取材方法 选取距离肿瘤组织边缘2 cm以上的非肿瘤肾皮质组织作为病理组织标本,组织大小约1 cm×1 cm×1 cm。总标本64例,去除因丢失的21例及非肿瘤肾皮质组织距离肿瘤组织边缘未达2 cm的标本7例,最终MS组及非MS组各有18例的肾脏组织纳入病理组织学检查。由石蜡包埋,行光学显微镜检查,并由病理科制作石蜡切片行HE染色及PASM-Masson三色染色。肾小球球性硬化及节段硬化,用病变的肾小球数占总的肾小球数百分比来表示。肾小管间质及肾血管病理改变参照2013年Banff移植肾病变的量化评分[12]。
统计学方法采用《SPSS 22.0》统计软件处理数据。计量资料以均数±标准差表示,计数资料用例数和百分比表示。所有计量资料采用Kolmogorov-Smimov检验进行正态性分布检验,符合正态分布的比较采用独立样本t检验,不符合正态分布则采用非参数秩和检验。计数资料比较采用卡方检验或Fisher确切概率法。采用重复测量方差分析比较两组术后不同时间点eGFR的变化。病理量化评分以中位数(范围)表示,两组间比较采用Mann-Whitney U检检验进行统计学分析。以P<0.05为差异有统计学意义。
结 果
一般资料两组术前1周内血红蛋白、血尿酸、SCr、eGFR、总胆固醇及低密度脂蛋白胆固醇水平无统计学差别(P>0.05);MS组的超重/肥胖比例高于非MS组,空腹血糖、血压、三酰甘油水平高于非MS组;高密度脂蛋白胆固醇水平低于非MS组(P<0.05),两组在体重、BMI、收缩压、舒张压、平均动脉压有统计学差异(P<0.001)(表1)。
术后eGFR变化两组术后eGFR均显著低于术前(P<0.001),术后1周两组eGFR统计学无意义(P=0.232),术后随访中,两组间各时间点eGFR值差异逐渐增大(P<0.05)(表2,图1)。用重复测量方差分析比较两组术后不同时间点eGFR的变化,两组的eGFR值差异存在统计学意义(F=5.227,P=0.026),时间因素对eGFR值的影响也存在统计学意义(F=152.964,P<0.001),但组别×时间之间无统计学意义(P>0.05),表明组别与时间的变化率无差别。
CKD分期的变化两组术前CKD分期均在CKD 1~2期,术后两组的CKD分期主要为CKD 2~3a期,无CKD 4~5期。随访2年时,MS组中肾功能分期持续在CKD3a期及以上的有14例,非MS组有5例,MS组CKD 3a期及以上的患者数多于非MS组(P=0.048)(表3)。
病理结果两组在癌旁肾组织肾小球硬化、肾小管萎缩及肾间质纤维化情况有统计学差异(P<0.05);在肾小球节段硬化、肾间质炎症细胞浸润及肾叶间动脉病变无统计学差异(P>0.05)(表4)。其肾叶间动脉病变主要表现为内膜增生(图2)。
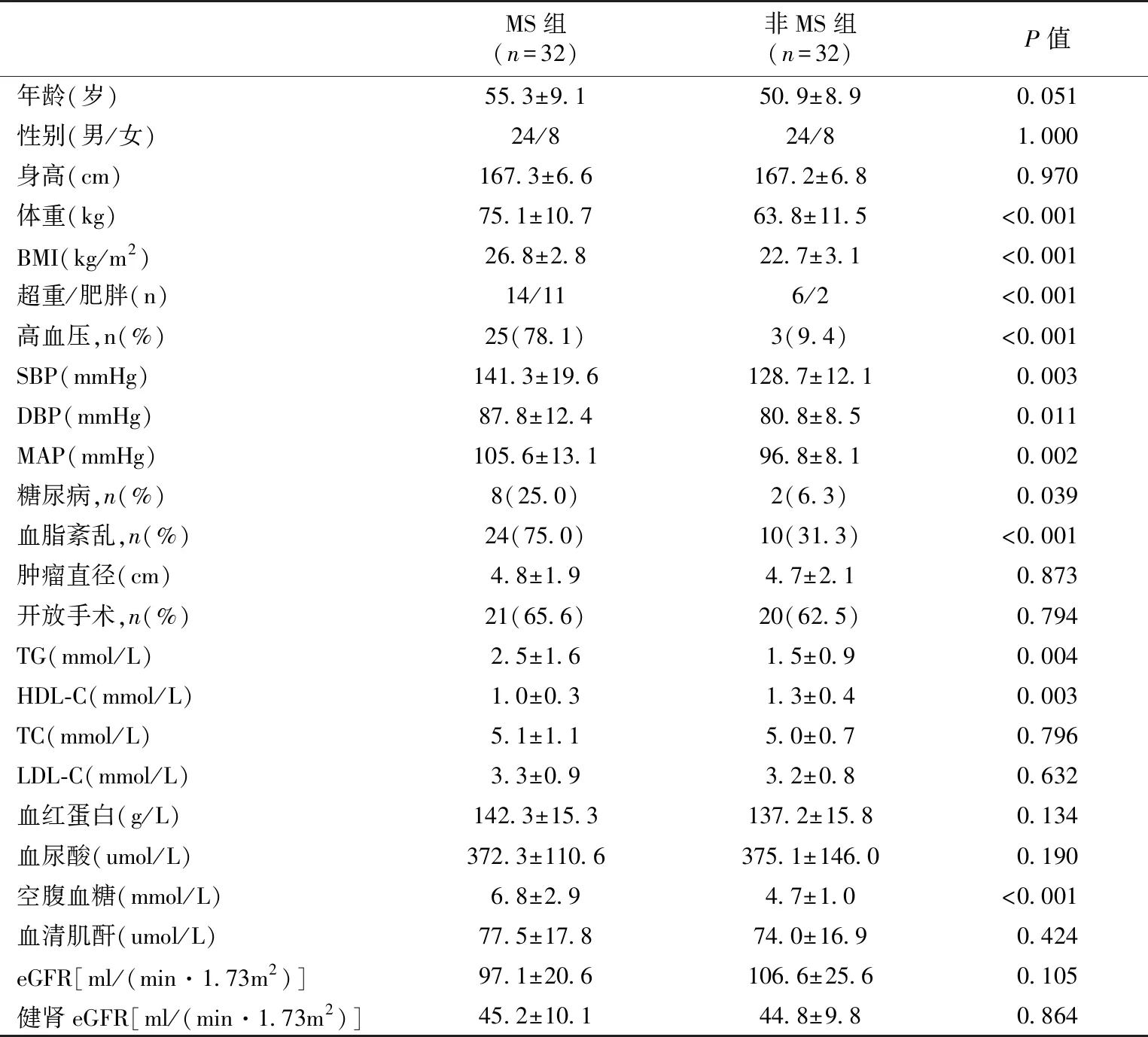
表1 MS组及非MS组术前一般资料
MS:代谢综合征;BMI:体质量指数;SBP:收缩压;DBP:舒张压;MAP:平均动脉压;TG:三酰甘油;HDL-C:高密度脂蛋白胆固醇;TC:总胆固醇;LDL-C:低密度脂蛋白胆固醇;eGFR:估算的肾小球滤过率
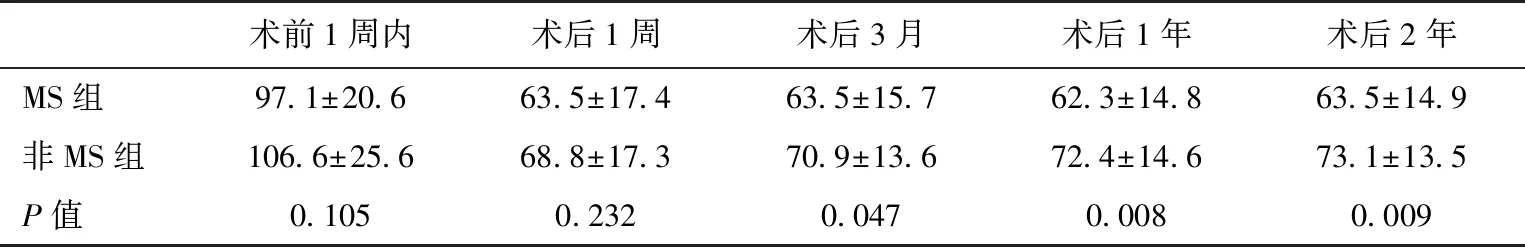
表2 不同时间点eGFR均值[ml/(min·1.73m2)]
MS:代谢综合征;eGFR:估算的肾小球滤过率
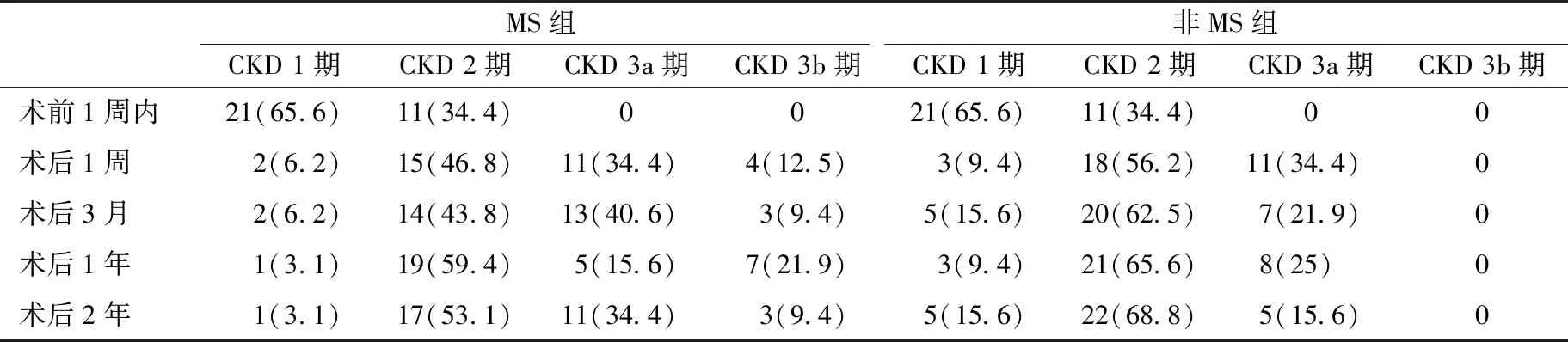
表3 两组各个时间点CKD分期[n,(%)]
MS:代谢综合征,CKD:慢性肾脏病
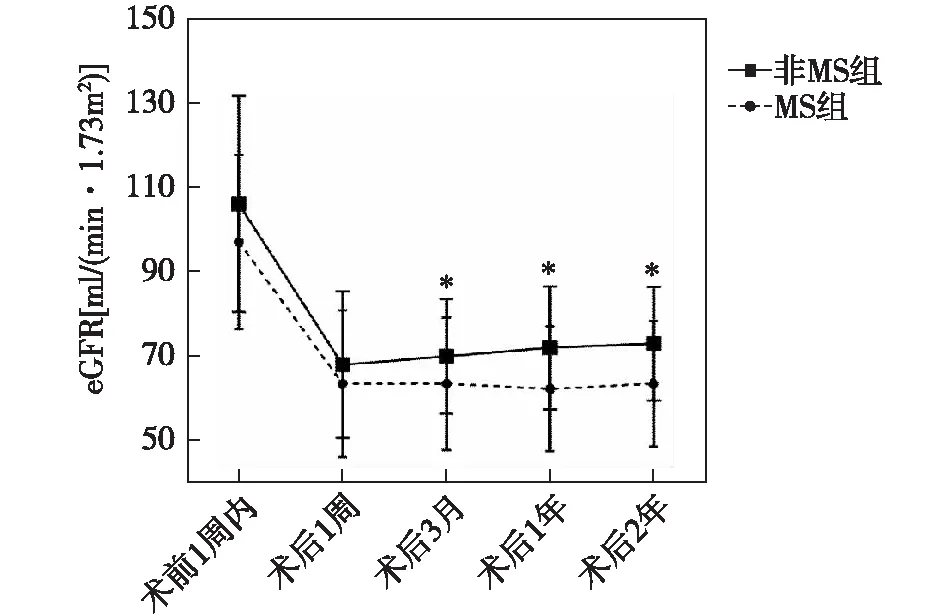
图1 不同时间点eGFR总体变化趋势图MS:代谢综合征;eGFR:估算的肾小球滤过率;*:两组间同时间点比较,P<0.05
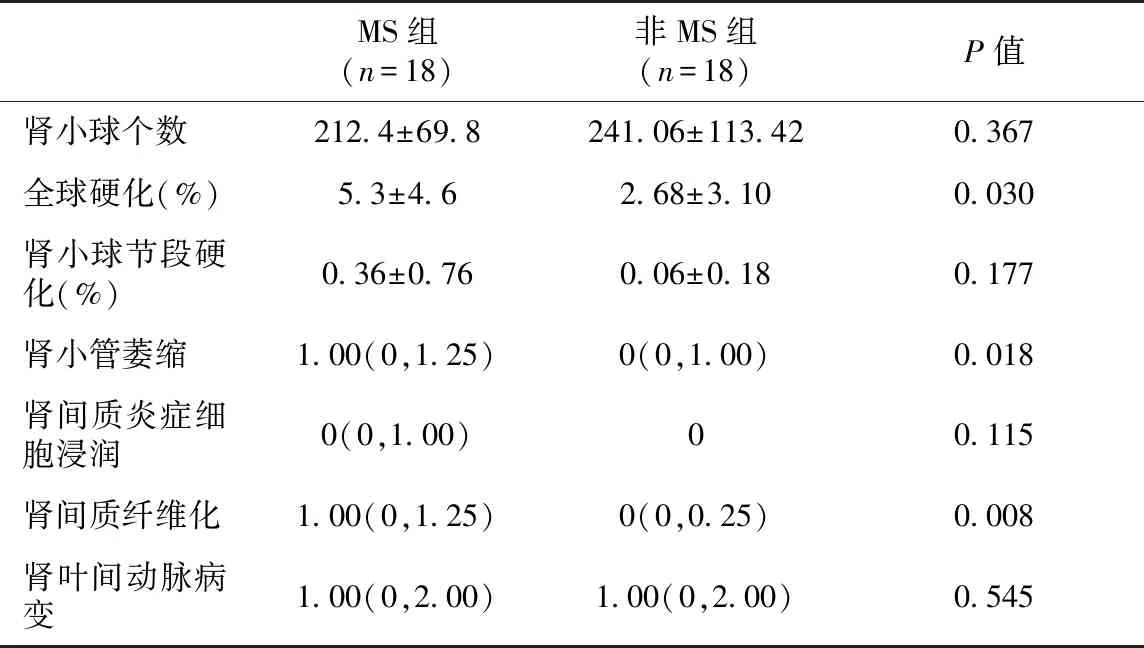
表4 MS组与非MS组癌旁肾组织脏病理改变程度积分比较
MS:代谢综合征
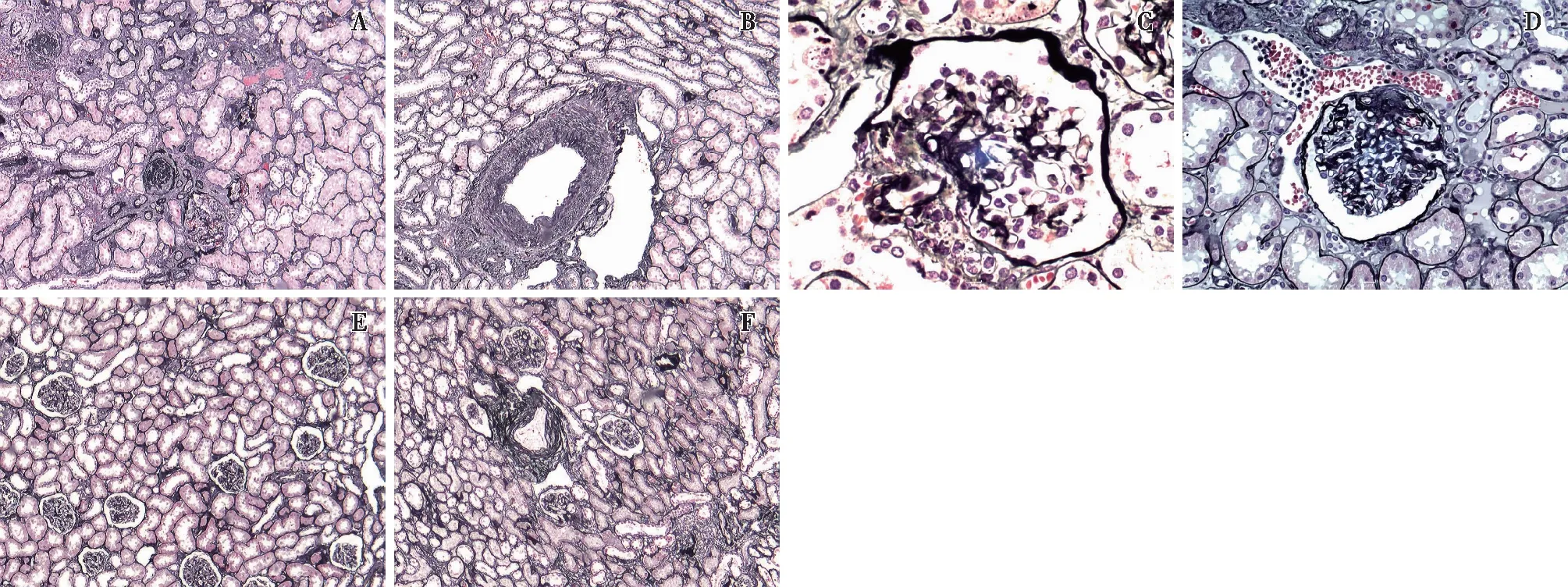
图2 A~D:代谢综合征(MS)组患者肾小球硬化(A)、肾叶间动脉内膜增生(B)、门部硬化(C)及节段硬化(D);E、F:非MS组患者肾小球及动脉结构正常(A、B、E、F:PASM-Masson,×100;C:PASM-Masson,×400;D:PASM-Masson,×200)
讨 论
ccRCC是源于肾实质小管上皮的恶性肿瘤,约占成人恶性肿瘤的2%~3%,是肾细胞癌的常见类型之一[13]。目前RN为ccRCC的主要治疗方法,研究表明术前合并MS将影响术后eGFR的恢复。MS是多种代谢因素异常聚集的病理状态,与多种疾病发生、发展有关,甚至影响全因死亡率[14]。故本研究单中心回顾性研究了64例行RN的ccRCC患者,探讨术前合并MS对术后eGFR的影响以及MS相关的肾脏病理改变。
在肾实质区域由于肿瘤组织对周围肾脏组织的机械性挤压,在正常的肾实质组织与肾脏肿瘤组织之间形成一条“过渡带”,“过渡带”随着远离肿瘤而减轻,在距离肿瘤边缘5 mm以外趋向正常的肾皮质[15]。本研究选取距离肿瘤边缘2 cm以上的非肿瘤肾皮质组织,故肾组织存在的病理改变可以认为是MS对肾脏的影响。MS导致的肾脏病理改变可见系膜细胞及基质增生,肾小管萎缩,肾间质纤维化,肾血管硬化[16]。Ohashi等[6]对合并MS的供肾者进行肾脏病理研究发现,MS组肾小球球性硬化、肾小管萎缩以及间质纤维化病变程度重于非MS组。Alexander等[5]对合并MS肾癌患者的癌旁肾组织进行病理检查结果示,MS组的肾小球球性硬化、肾小球节段硬化、肾小管萎缩、间质纤维化以及动脉硬化的病理改变程度重于非MS组,且差异均有统计学意义,提示MS可加重肾脏病理改变。本研究病理结果显示,两组肾小球球性硬化、肾小管萎缩及肾间质纤维化发生率具有明显统计学意义,但肾小球节段硬化以及肾叶间动脉病变程度两组相比无明显差异。本实验肾脏病理结果与Ohashi[6]的研究基本一致,但与Alexander等[5]的研究结果存在差异。分析原因,可能与两组研究对象的种族、行单侧根治性肾切除的患者术前BMI及收缩压水平存在不同有关。
本实验观察ccRCC患者行RN后eGFR变化,发现RN术后eGFR总体变化趋势为先下降后上升。非MS组大约在术后3月eGFR呈上升趋势直到术后2年;MS组的eGFR在术后不断下降,直至手术1年后eGFR呈恢复趋势。MS组在术后1年的eGFR低于非MS组[62.3±14.8 ml/(min·1.73m2)vs72.4±14.6 ml/(min·1.73m2)(P=0.008)]。Alexander等[5]研究也发现,合并MS的肾癌患者行RN后1年的eGFR低于非MS组(P=0.027)。Ohashi等[6]对供肾术后eGFR变化趋势研究结果表明,无论是否合并MS,eGFR总体的变化趋势为术后出现下降,MS组在术后1年内eGFR低于非MS组(P=0.005),此后肾功能逐渐恢复。以上研究结果均表明,MS加重肾脏损害,并且影响单侧全肾切除术后健肾eGFR的代偿。既往研究亦表明,MS及各代谢组分均可导致及加重肾脏损害,其中机制原因可能为:(1)肥胖引起肾小球肥大无法代偿后,引起肾小球局灶节段硬化[17]及蛋白尿[18];(2)血压升高引起肾小动脉收缩、肾血管阻力增加,导致肾血流量下降,引起eGFR下降;(3)血糖、血脂代谢异常诱发机体炎症及氧化应激反应,诱导反应性氧自由基(ROS)的产生[19-20]。ROS破坏足细胞结构和功能,致使肾小球基膜的电荷屏障受损,造成蛋白尿漏出。ROS还会对血管内皮细胞、系膜细胞以及基质产生影响,导致血管重塑、系膜细胞增生、细胞外基质蛋白增加,最终导致肾小球及肾小管损伤。
本研究发现术后两组的CKD分期主要为CKD 2~3a期,无CKD 4~5期患者。随访2年中,MS组 CKD3a期及以上的患者数多于非MS组(P=0.048)。CKD防治是世界各国所面临的重要公共卫生问题,也是心脑血管疾病发生的危险因素,RN术后CKD引起的并发症可能影响患者整体生存率。Weight等[21]发现行RN的患者较肾部分切除术肾功能明显下降,并且随着eGFR的下降,全因死亡率或心血管死亡率的风险分别增加25%及17%。合并MS肾移植供者术后肾功能中位随访时间5年的研究显示[22],术前合并MS患者约在随访5.6±0.8年时出现eGFR≤70 ml/(min·1.73m2),早于非MS患者。建议此类患者应通过饮食、适当运动及药物治疗MS,延缓肾功能进展,提高患者长期生活质量及肾脏生存期。
小结:本研究发现MS相关肾脏病理改变主要为肾小球硬化、肾间质纤维化以及肾小管萎缩等,且MS影响肾癌根治术后健侧肾功能的代偿。故合并MS的患者行RN后,需密切关注其肾功能的变化。
