二氢丹参酮I在胃癌AGS细胞中作用机制的生物信息学分析
2020-05-13梁春艳
梁春艳
四川省凉山彝族自治州攀钢西昌医院普通外科(四川 615000)
近年来,关于二氢丹参酮Ⅰ与恶性肿瘤的研究文献报道越来越多,涉及的恶性肿瘤有胃癌[1]、结直肠癌[2- 4]、乳腺癌[5]、宫颈癌[6]、骨肉瘤[7]、白血病[8]、等等,也有癌肿瘤细胞移植瘤体外模型实验研究[7-10]。从报道的文献来分析,二氢丹参酮Ⅰ抗肿瘤活性存在很多可能的通路以及机制:活化JNK/P38通路[1]、阻断tnf-α诱导的nf-kappab信号通路[11]等、抑制癌细胞增殖[9]、诱导癌细胞周期阻滞[12]、抑制癌细胞转移和侵袭[7]、诱导癌细胞凋亡[9,13]等。
前期我们的细胞试验研究表明,二氢丹参酮Ⅰ通过活性氧介导的氧化应激反应诱导胃癌AGS 细胞凋亡[14]。这仅仅是细胞学上观察到的现象。二氢丹参酮Ⅰ抗胃癌潜在机制尚未完全清晰。基于此目的,本研究尝试运用GEPIA数据库,提供包括TCGA数据库和GTEx数据库的功能,探索性地研究二氢丹参酮Ⅰ通过氧化应激作用胃癌可能潜在靶点:潜在靶点与抗氧化应激反应相关性分析、该潜在靶点在胃癌患者差异表达分析以及其生存分析,包括总生存率(OS)和无瘤生存率(DFS)。寻找二氢丹参酮Ⅰ通过氧化应激反应作用于胃癌候选潜在药物靶点,为诊断和识别胃癌、治疗胃癌提供生物标志物铺下基础理论。
1 资料与方法
1.1 在数据库检索二氢丹参酮Ⅰ作用胃癌AGS细胞潜在靶点研究的文献
在PubMed、中国知网(CNKI)等数据库(2019年3月12日前)中进行检索,以查询所有公开已发表的研究二氢丹参酮Ⅰ作用于胃癌靶点的文献。使用检索词“gastric cancer”、“gastric neoplasms”、“malignant tumors of stomach”、“dihydrotanshinone”、“dihydrotanshinoneⅠ”、“DHTS”、“DHT”、“dht”、“dhts”、“DI”,中文使用“胃癌”、“胃肿瘤”、“胃恶性肿瘤”、“胃肿瘤恶变”,以及“丹参酮”、“二氢丹参酮”、“二氢丹参酮Ⅰ”“丹参”,进行检索。
从检索结果的文献题目中初步筛选符合二氢丹参酮作用胃癌潜在靶点的文献,然后阅读文献摘要以及全文,决定选取的文献。根据文献内容,仔细深入判读二氢丹参酮作用胃癌靶点是上游的靶点还是下游的靶点。如果不能正确做出抉择时,翻阅专业文献研究结果以及请生物化学等相关专业教授学者协助做出取舍。
1.2 GEPIA数据库工具分析二氢丹参酮Ⅰ作用胃癌AGS细胞潜在机制
Gene Expression Profiling Interactive Analysis数据库(简称GEPIA数据库),中文一般称该数据库为癌症和正常基因表达分析和交互分析网络数据库,包含9 736肿瘤和8 587例正常样本的TCGA和GTEX的数据,用以分析RNA序列表达。
1.2.1 潜在靶点基因和表达抗氧化应激关键蛋白的基因的相关性分析
根据检索文献报道二氢丹参酮Ⅰ作用胃癌所有靶点,并在PubMed数据库(https://www.ncbi.nlm.nih.gov/pubmed)检索这些靶点蛋白对应的人基因。文献检索抗氧化应激关键基因。在文献检索抑制氧化应激的重要调节蛋白,然后将此蛋白在PubMed数据库检索该蛋白对应的基因。在GEPIA数据库中输入基因,查找该基因的简要描述,再次确定该基因是调节抗氧化应激关键基因。
将检索的这些靶点对应的人基因在GEPIA数据库中进行分析这些潜在靶点基因和表达抗氧化应激关键蛋白(超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶、转录因子Nrf- 2)的基因的相关性分析。
在基因相关性分析功能中,以二氢丹参酮Ⅰ作用胃癌潜在靶点基因为横坐标,抗氧化应激关键基因为纵坐标,分别输入待检测基因相关性的两个基因。相关系数选择Pearson,选择TCGA Tumor数据库中的STAD Tumor。然后点击得出其相关性关系的结果。采用Pearson方法确定相关系数。相关强度为使用以下绝对值指南确定:0.00~0.19“非常弱”,0.20~0.39“弱”,0.40~0.59“中等”0.60~0.79“强”,0.80~1.0“非常强”,P值<0.05,被认为具有统计学意义。
1.2.2 二氢丹参酮Ⅰ作用胃癌潜在靶点基因在胃癌患者的表达水平分析
通过Pearson相关性和统计显著性评估二氢丹参酮Ⅰ作用胃癌潜在靶点在胃癌患者的基因表达分析。 在GEPIA数据Express DIY中选择Boxplot(当然也可以选择Profile或者Stage plot等),在基因框内输入潜在靶点基因,|Log2 FC|Cutoff选择“1”,P值选择“0.01”,选择红色为潜在靶点基因在肿瘤中表达,蓝色为潜在靶点基因在正常组织中表达。数据库设置选择“STAD”, Log Scale选择“Yes”, Jitter Size选择“0.4”,选择匹配TCGA和GTEx数据库,最后点击,得出分析结果。
1.2.3 二氢丹参酮Ⅰ作用胃癌潜在靶点基因在胃癌患者的预后分析
用Prognoscan和Kaplanmeier图生成生存曲线。在GEPIA数据库Surnival中选“Surnival Plot”,在基因框内输入二氢丹参酮Ⅰ作用胃癌潜在靶点基因,方法选择“Overall Survival”,选择最佳Cutoff-High(%),Hazards Ratio(HR)选择“Yes”, 95% Confidence Interval选择“Yes”, Axis Units选择“Months”。 二氢丹参酮Ⅰ作用胃癌潜在靶点基因在胃癌患者高表达选择红色,低表达选择蓝色。数据库设置选择“STAD”,最后得出生存曲线图。运用同样的方法得出无瘤生存曲线图。
2 结 果
2.1 在数据库检索二氢丹参酮作用胃癌AGS细胞靶点研究的文献
从PubMed、CNKI等数据库检索二氢丹参酮Ⅰ作用肿瘤靶点基因的文献,一共76篇。经过阅读题目、摘要以及全文后筛选符合检索条件的文献。结果如下。见表1。
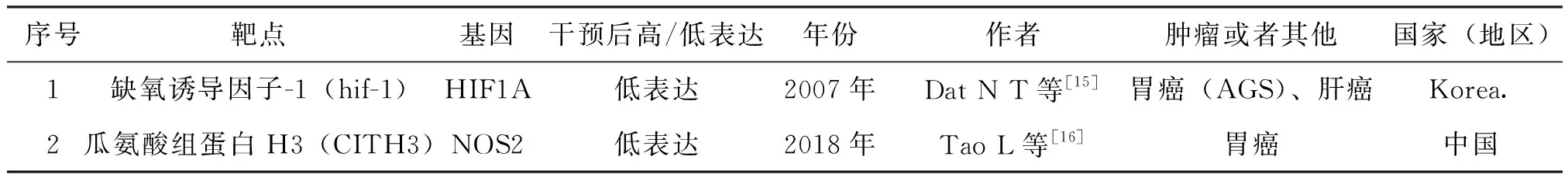
表1二氢丹参酮Ⅰ作用肿瘤靶点基因的文献表
从表1可以得知,关于二氢丹参酮Ⅰ作用胃癌靶点,报道二氢丹参酮与胃癌相关研究的文献有2篇。在这些肿瘤的文献中,二氢丹参酮作用于肿瘤的主要作用的靶向基因(蛋白)为缺氧诱导因子-1(hif-1)和瓜氨酸组蛋白H3(CITH3),分别对应的基因是HIF1A和NOS2。
2.2 二氢丹参酮Ⅰ的作用靶点与抗氧化应激关键基因的关系
表达抗氧化应激关键蛋白酶(超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶、转录因子Nrf- 2)的基因分别是:SOD1、CAT、GPX1、NFE2L2。
在GEPIA数据库中分别检索HIF1 A和NOS2基因和表达抗氧化应激关键基因SOD1、CAT、GPX1、NFE2L2之间相关关系。
2.2.1 HIF1A和SOD1、CAT、GPX1、NFE2L2相关关系
GEPIA数据库显示HIF1A和SOD1相关性P=0.28,R=0.054,由于P=0.28,大于0.05,差异无统计学意义,即是HIF1A和SOD1无明显相关性,见图1A;HIF1A和CAT相关性P<0.001,R=0.18,由于P<0.001,小于0.05,差异有统计学意义,即是HIF1A和CAT有正相关关系,见图1B;HIF1A和GPX1相关性P=0.033,R=0.11,由于P=0.033,小于0.05,差异有统计学意义,即是HIF1A和GPX1有正相关关系,见图1C;HIF1A和NFE2L2相关性P<0.001,R=0.41,由于P<0.001,小于0.05,差异有统计学意义,即是HIF1A和NFE2L2有正相关关系,见图1D。
2.2.2 NOS2和SOD1、CAT、GPX1、NFE2L2相关关系
GEPIA数据库显示NOS2和SOD1相关性P<0.001,R=0.18,差异有统计学意义,即是NOS2和SOD1具有正相关性,见图2A;NOS2和CAT相关性P=0.99,R=- 0.67,由于P>0.05,差异无统计学意义,即是NOS2和CAT无相关关系,见图2B;NOS2和GPX1相关性P=0.17,R=- 0.068,由于P>0.05,差异无统计学意义,即是NOS2和GPX1无正相关关系,见图2C;NOS2和NFE2L2相关性P=0.37,R=- 0.045,差异无统计学意义,即是NOS2和NFE2L2无相关关系,见图2D。

图1 HIF1A和SOD1、CAT、GPX1、NFE2L1的相关关系

图2 NOS2和SOD1、CAT、GPX1、NFE2L2相关关系
2.3 二氢丹参酮Ⅰ的作用潜在靶点在胃癌患者的表达水平
HIF1A和NOS2在胃癌患者高表达(白色)。

图3 HIF1A和NOS2在胃癌患者中的表达
这个是HIF1A和NOS2在胃癌的表达水平,HIF1A和NOS2在胃癌中表达显著增高(白色),灰色表示HIF1A和NOS2在胃癌癌旁组织中低表达。见图3。
2.4 二氢丹参酮Ⅰ潜在靶点对胃癌患者预后的影响
HIF1 A和NOS2在胃癌患者预后的影响。HIF1A高表达,胃癌患者的总体生存率(Overall Survival)下降,相反,HIF1A低表达,胃癌患者的总体生存率(overall survival)提升,P=0.017,P<0.05,HR(high)=0.5;HIF1A低表达,胃癌患者的无瘤生存率(Disease Free Survival)视乎高于HIF1A高表达的胃癌患者,但是由于P=0.057,P>0.05,差异无统计学意义,见图4A、B。同理,NOS2高表达或者低表达,其在胃癌患者的总体生存率和无瘤生存率都是无统计学差异,P值分别为0.21、0.18(见图4C和D)。
3 讨 论
氧化代谢已经是机体细胞物质代谢和能量代谢重要途径之一。氧化应激伴随着自由基的产生。在机体细胞中产生活性氧(ROS),包括超氧化物和过氧化氢等,用于信号传递,作为免疫反应的效应器,以及作为细胞代谢的副产物[17]。目前相当一部分的网络数据库被用作科学研究是有价值的。Gene Expression Profiling Interactive Analysis数据库(简称GEPIA数据库)(http://gepia.cancer-pku.cn/index.html),包括癌症基因组图谱(TCGA数据库)和基因型组织表达(GTEx数据库)产生数以万计份癌症和非癌症样本RNA测序数据,为包括癌症生物学在内的许多相关研究领域提供了前所未有的机遇。到目前为止,除了726个癌旁组织数据之外,TCGA数据库已经产生33种癌症类型9 736个肿瘤样本数据。

图4 HIF1和NOS2在胃癌患者预后的影响
细胞凋亡被学者们定义为是程序性细胞死亡(PCD)的过程。细胞凋亡是一种基因调控现象。在高倍显微镜和电镜下发现它引起细胞形态学方面的改变、出血、核碎裂、细胞收缩、染色质凝聚、染色体DNA碎裂和整体mRNA衰变[18- 20]。
缺氧诱导因子-1(hif-1),它的基因名为HIF1A。缺氧诱导因子(HIF-1)是一种二聚体转录复合物,是细胞对低氧(缺氧)反应适应过程中的一个重要调节因子,主要因其在维持氧和能量均一性中的作用而被认识[21]。由于细胞增殖率高,肿瘤细胞生长速度快,以及新血管生成机制,肿瘤中常发生缺氧供血不足,缺氧是肿瘤环境中常见的一种情况[22]。低氧微环境有利于肿瘤的生长和转移,对肿瘤的发生和发展起作用。本项目以及本部分文献综述表明,二氢丹参酮Ⅰ作用胃癌细胞,产生活性氧介导氧化应激,抑制HIF-1的表达,而文献报道低氧环境促进HIF-1的高表达出现肿瘤进展和转移[23- 26]。因此,我们认为,二氢丹参酮作用胃癌细胞,产生活性氧介导氧化应激,抑制HIF-1的表达,从而抑制胃癌细胞的生长和转移,促进胃癌细胞凋亡。
抗氧化应激系统主要包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GPX)[27]以及转录因子Nrf- 2[28- 29]。
超氧化物歧化酶(Superoxide dismutase,SOD,基因名SOD1)自1968年发现SOD以来,已被证明具有重要的生物学意义,超氧化物歧化酶(SODS)是保护细胞免受活性氧(ROS)侵害的必要的抗氧化酶。超氧化物歧化酶在体内可以直接清除氧化反应产生过多的自由基,保护细胞膜免受活性氧的过氧化作用导致细胞膜脂质发生过氧化,从而维护细胞膜的生理功能。在本部分GEPIA数据库研究里,HIF1A和SOD1相关关系图,P=0.28,R=0.054,HIF1A和SOD1无相关性。即是说,丹参酮干预后胃癌后可导致HIF1A低表达,可能不是通过潜在降低SOD1的活性减少胃癌的抗氧化应激,诱导细胞凋亡,可能存在其他潜在靶点机制。
过氧化氢酶(Catalase,CAT,基因名cat) 包含四个相同的62 kda亚单位,每个亚单位包含四个不同的结构域和一个假体血红素基团。过氧化氢酶的主要生理作用是抗氧化物,催化过氧化氢转化为水和氧这一系列生化反应,属于抗氧化剂。在酶促反应导致H2O2共价键断裂的过程中,过氧化氢酶首先被氧化成一种高价铁中间物的化合物I(CPD I),然后被第二个H2O2分子还原回静止状态。过氧化氢酶不直接清除氧自由基,主要清除体内细胞氧化反应产生的过氧化氢,缓解或者避免细胞膜脂质过氧化作用,从而维持细胞膜正常的生理功能,使得机体细胞达到氧化还原反应的动态平衡状态,机体内环境稳态得以保持。由于过氧化氢酶该酶虽不直接清除自由基,但可降低自由基,因此其可能介导了胃癌的抗氧化应激效果。HIF1A与它表达呈正相关。根据文献报道,丹参酮干预后胃癌后可导致HIF1A低表达,因此,也潜在地减少了CAT的表达水平,减少了胃癌的氧化应激耐受,促进了胃癌的氧化应激凋亡。
谷胱甘肽过氧化物酶(Glutathione peroxidases,GPxs,基因名GPX1)其生物化学和生理功能发挥是以还原型谷胱甘肽为底物清除氧化反应生成过多的过氧化物,例如减少自由基生成、清除过多的自由基、过氧化氢以及羟自由基等。还原型谷胱甘肽是机体内细胞主要的活性形式存在。其抗氧化应激系统主要表现在两方面的调控:一是调控谷胱甘肽过氧化物酶的含量,二是调控谷胱甘肽还原酶的含量。较早以前研究发现[30],细胞谷胱甘肽(GSH)早期下降,随后活性氧(ROS)生成增加,在没有任何外部凋亡刺激的情况下,诱导多种凋亡信号(在不同时间点例如24 h、48 h、72 h均可检测到),当线粒体谷胱甘肽耗尽时,ROS产生增加内发生不可逆的凋亡,这表明降低谷胱甘肽过氧化物酶的含量可以潜在地诱导细胞凋亡。二氢丹参酮Ⅰ作用胃癌细胞,以活性氧为介导的氧化应激反应抑制HIF1A,致HIF1A低表达,且HIF1A与GPX1表达呈正相关。因此,也潜在地减少了谷胱甘肽过氧化物酶的表达水平,减少了胃癌的抗氧化应激作用,促进了胃癌的氧化应激凋亡,即促进了诱导胃癌细胞凋亡。
转录因子Nrf- 2,它的基因名是NFE2L2。1996年Venugopal R第一次提出转录因子Nrf- 2的抗氧化作用[31]。转录因子Nrf- 2的抗氧化机制大概如下[32]:转录因子Nrf- 2在胞浆内与Keap1(Kelch样ech相关蛋白1)结合成二联体,此二联体在活性氧亲电子剂的作用下解离成转录因子Nrf- 2和Keap1(Kelch样ech相关蛋白1),然后转录因子Nrf- 2转入细胞核,在核内与Maf(亮氨酸的一种拉链蛋白)结合,作用在核酸5′-TGACnnnGCA- 3′,启动相关抗氧化应激基因表达,相关抗氧化应激酶高活性或者高表达,从而清除活性氧等氧自由基等,达到抗氧化应激目的。从本研究结果来看,二氢丹参酮Ⅰ作用胃癌细胞,以活性氧为介导的氧化应激反应抑制HIF1A,致HIF1A低表达,根据GEPIA数据库结果得知,HIF1A与转录因子Nrf- 2表达呈正相关,即是低表达的HIF1A也可能潜在地抑制转录因子Nrf- 2对胃癌的抗氧化应激作用,促进了胃癌的氧化应激凋亡。
HIF1A的表达结果表明它在胃癌中表达增高(白色),而在胃癌癌旁组织中HIF1A呈现低表达(灰色)。预后分析HIF1A高表达,胃癌患者的总生存率降低,P=0.017,表明HIFA1确实在胃癌中高表达,而高表达后胃癌患者的总体生存率(Overall Survival)下降。因此,对胃癌中采用二氢丹参酮Ⅰ干预的潜在机制:二氢丹参酮Ⅰ干预可能下降HIFA的表达水平,具有潜在性通过调控了CAT、GPX1、NFE2L2的表达水平;二氢丹参酮Ⅰ干预可能下降NOS2的表达水平,具有潜在性通过调控了SOD1的表达水平;从而减少胃癌细胞的抗氧化应激潜力,促进肿瘤氧化应激凋亡,且HIFA的高表达显著影响了胃癌患者的预后。因此,采用二氢丹参酮Ⅰ可能有望改善患者的预后,在胃癌的进一步应用中具有良好的临床前景。
